Розділ 2. Молекулярна фізика.
§1. Загальні відомості про молекулярну фізику.
Якщо ви думаєте, що молекулярна фізика, це наука про будову та властивості молекул, то помиляєтесь. Молекулярна фізика не вивчає молекули. Вона вивчає загальні властивості твердих, рідких та газоподібних речовин та ті теплові процеси які відбуваються з цими речовинами. Іншими словами, предметом вивчення молекулярної фізики є загальні властивості речовин та різноманіття тих теплових процесів які відбуваються з ними.
Відразу ж зауважимо, що в науці загалом і фізиці зокрема, терміном речовина позначають все різноманіття матеріальних об’єктів Природи, які мають масу спокою (m0=0) та складаються з тих чи інших частинок (електронів, протонів, нейтронів, атомів, молекул, тощо). А це означає, що речовинами є не лише хімічно прості матеріали як то залізо, вода чи сіль, а й такі надскладні органічні структури як клітини, рослини, тварини та ми з вами. Втім, в фізиці ми будемо вивчати загальні властивості лише тих хімічно простих речовин які складаються з атомів, молекул або іонів і які можуть бути твердими, рідкими та газоподібними.
Ви можете запитати: “А чому наука про загальні властивості речовин, називають молекулярною фізикою?”. Відповідь на це слушне запитання очевидно проста. В молекулярній фізиці, властивості твердих, рідких та газоподібних речовин і ті теплові процеси які з ними відбуваються, пояснюють виходячи з того, що ці речовини складаються з надзвичайно дрібних частинок, які прийнято називати молекулами. Звичайно, хімічно прості речовини можуть складатись не лише з молекул, а й з атомів, іонів або певної суміші цих частинок. Однак, в межах молекулярної фізики, ми без нагальної потреби не будемо заглиблюватись в подробиці внутрішнього устрою тих структурних одиниць з яких складається та чи інша конкретна речовина. Ми будемо виходити з того, що всі речовини складаються з надзвичайно дрібних, невидимих частинок. І давайте домовимось, називати ці частинки молекулами.
Про те, що тіла складаються з дрібних, невидимих частинок, люди здогадувались дуже давно. Ще за 400 років до нашої ери, давньогрецький філософ Демокрит стверджував, що всі тіла складаються з надзвичайно дрібненьких, неподільних частинок, які були названі атомами, що в буквальному перекладі означає “неподільний” (від грец. atomos – неподільний). Однак, гіпотезі про молекулярну (атомарну) будову речовини, доля приготувала складний та тернистий шлях. Шлях довжиною в понад два тисячоліття. Лише в 1908 році ця гіпотеза стала безумовно доведеною науковою теорією.
Та як би там не було, а сьогодні ми точно знаємо, що всі тіла складаються з молекул, які безперервно рухаються і певним чином взаємодіють між собою. Власне ці знання і лежать в основі тієї науки яка називається молекулярною фізикою.
Починаючи вивчення молекулярної фізики ми маємо усвідомлювати складність того завдання що стоїть перед нами. А ця складність полягає в тому, що будь яке реальне тіло складається з неймовірно величезної кількості наддрібних частинок, які безладно рухаються та складним чином взаємодіють між собою. Скажімо, в одному літрі повітря міститься 2,7?1022 молекул. Навіть якщо виходити з того, що молекули повітря ідеально однакові, ідеально круглі, ідеально пружні і такі що повністю підпорядковуються законам ньютонівської механіки, то навіть в цьому випадку, для кількісного описання поведінки цих молекул, потрібно розв’язати систему що найменше 3(2,7?1022) рівнянь. Задача, прямо скажемо безнадійна. Вона тим більше безнадійна, якщо врахувати факт того, що насправді молекули повітря не надто схожі одна на одну, не ідеально круглі, не ідеально пружні і не в точності підпорядковуються законам ньютонівської механіки.
Зважаючи на вище сказане, ми з самого початку відмовимось від будь яких спроб кількісно описати поведінку кожної окремо взятої молекули. Натомість, застосуємо так званий статистичний метод досліджень. Суть цього методу полягає в тому, що поведінку складної системи, описують на основі відомих законів механіки та статистично усереднених параметрів окремих елементів цієї системи. Наприклад, ми не можемо точно визначити миттєві значення швидкості, імпульсу та енергії довільно обраної молекули в довільно вибраний момент часу. Натомість, ми абсолютно точно можемо говорити про статистично усереднені значення цих величин. При цьому, знаючи ці усереднені значення та застосовуючи відомі закони ньютонівської механіки, можна достатньо точно описати загальну поведінку системи.
Такий підхід є тим більш обгрунтованим, якщо врахувати факт того, що наші органи відчуттів реагують не на поведінку окремо взятої молекули, а на усереднену результуючу їх загальної поведінки. А це означає, що досліджуючи, описуючи та пояснюючи властивості навколишнього світу, зовсім не обов’язково знати поведінку кожної окремо взятої молекули. Достатньо знати усереднену поведінку середньостатистичної молекули. Власне на основі знань про цю поведінку, в молекулярній фізиці і пояснюються загальні властивості твердих, рідких і газоподібних речовин та все різноманіття тих теплових процесів які відбуваються з ними.
Таким чином:
Молекулярна фізика – це розділ фізики, в якому вивчаються загальні властивості твердих, рідких та газоподібних речовин і ті теплові процеси які відбуваються з ними.
Теоретичною основою молекулярної фізики є три твердження, які називаються основними положеннями молекулярно – кінетичної теорії і суть яких полягає в наступному:
- Всі речовини складаються з молекул (молекул, атомів, іонів).
- Молекули в речовині безперервно і безладно рухаються.
- На невеликих відстанях, молекули взаємодіють між собою.
Методологічною основою молекулярної фізики є статистичний метод досліджень, суть якого полягає в тому, що поведінку і властивості надскладної системи молекул, описують на основі законів ньютонівської механіки та статистично усереднених характеристик цих молекул.
Тема 2.1 Основи молекулярно – кінетичної теорії.
§2. Основні положення молекулярно – кінетичної теорії.
Теоретичну основу молекулярної фізики складають три базові твердження, які називаються основними положеннями молекулярно – кінетичної теорії (м. к. т.). Ось ці твердження.
- Всі речовини складаються з молекул (молекул, атомів, іонів).
- Молекули в речовині безперервно та безладно (хаотично) рухаються.
- На невеликих відстанях (~10-9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
Виходячи з цих базових тверджень та застосовуючи закони ньютонівської механіки, можна пояснити практично все, що є предметом вивчення молекулярної фізики. Тобто пояснити загальні властивості твердих, рідких та газоподібних речовин і ті теплові процеси які відбуваються з цими речовинами при їх переході з одного агрегатного стану в інший, або без такого переходу.
Однак, чому ми вирішили що речовини складаються з надзвичайно дрібненьких частинок, які рухаються і певним чином взаємодіють між собою? Адже ніхто з нас цих частинок ніколи не бачив і напевно ніколи не побачить. А якщо ви чули, що ті прилади які називаються електронними мікроскопами дозволяють побачити молекули (атоми), то маєте знати, що ці молекули представляють собою певні розмиті згустки матерії які не мають певних, чітко визначених розмірів, не мають певної чітко визначеної форми, певної густини, певної твердості і взагалі тих властивостей, що є притаманними звичним для нас тілам.
І тим не менше, ще за сотні років до нашої ери, думаючі люди обгрунтовано стверджували, що всі тіла складаються з надзвичайно дрібненьких частинок (атомів), які безперервно рухаються і певним чином взаємодіють між собою. Ось що з цього приводу писав один з засновників атомістичного (молекулярного) вчення, давньогрецький філософ Демокрит (приблизно 460 – 370 р.р. до н.е.). “Не існує нічого окрім атомів та чистого простору. Атоми є неподільні і не мають внутрішнього устрою. Атоми безкінечні за своєю кількістю і безкінечно різноманітні за своєю формою. Відмінності між речами, визначаються відмінностями між тими атомами з яких вони складаються. Атоми діють один на одного шляхом тиску та удару.”*
*) Потрібно зауважити, що оригінали книг Демокрита не збереглися. І тому, про суть його філософських поглядів ми знаємо з книг більш пізніх авторів, зокрема Епікура (341 -270 р.р. до н.е.) та Лукреція (99 – 55 р.р. до н.е.)
Ви можете запитати: “А як це може бути, щоб ті люди які не мали бодай елементарного наукового обладнання, з такою впевненістю говорили про ті речі, факт існування яких був науково доведений лише в 1908 році?” Відповідаючи на це запитання можна сказати наступне. По суті люди кардинально відрізняються від інших живих істот лише одним – здатністю логічно мислити. Власне ця здатність і дозволяє людям “бачити” те, чого вони ніколи не бачили і чого наочно побачити взагалі не можливо.
Скажімо, ми говоримо про те існують молекули чи не існують. Відповідаючи на це запитання зовсім не обов’язково мати надскладне обладнання та проводити надскладні експерименти. Цілком достатньо придивитись до навколишнього світу і проаналізувати ті події що в ньому відбуваються. Наприклад, ви берете склянку води і кладете в воду шматочок цукру. При цьому цукор швидко зникає (розчиняється). Ви можете скільки завгодно роздивлятись воду під мікроскопом в надії відшукати видимі частинки цукру і не знайдете їх. І тим не менше цукор нікуди не зник. Адже збереглась його визначальна смакова властивість відома кожному з вас. Чи не говорить даний експериментальний факт про те, що цукор складається з надзвичайно дрібненьких частинок? Частинок, які настільки дрібні, що їх не видно навіть в найпотужніший оптичний мікроскоп і про факт існування яких говорить те, що після розчинення та візуального зникнення цукру, зберігається його визначальна смакова, а по суті хімічна властивість. І чи не говорить факт рівномірного розподілу цукру в наявному об’ємі води про те, що наддрібні частинки цукру рухаються?
Або, скажімо, ви наливаєте в склянку певну кількість води і помічаєте, що з плином часу цієї води стає все менше і менше. Ви можете скільки завгодно придивлятись до того що ж відбувається і не помітите нічого, окрім факту того, що води стає все менше і менше. Чи не говорить цей експериментальний факт про те, що вода складається з надзвичайно дрібненьких частинок, які непомітно вилітають (випаровуються) зменшуючи тим самим загальну кількість води?
Або, наприклад, той факт що крапля пахучої рідини поступово зникає, а натомість ви відчуваєте відповідний запах у всіх куточках кімнати. Чи не говорить цей факт про те, що відповідна рідина складається з надзвичайно дрібненьких частинок які є носіями певних властивостей цієї рідини і що ці частинки рухаються?
Або, скажімо, факт того, що в процесі охолодження повітря, в ньому та на тих предметах що в цьому повітрі знаходяться, з’являються (конденсуються) крапельки води. Чи не говорить цей факт про те, що відповідна вода й до того знаходилась в повітрі і що ми її не помічали тільки тому, що відповідні мікрочастинки води є неймовірно маленькими?
А хімічні реакції? А процес горіння? А електроліз? А факт того, що атмосфера Землі представляє собою однорідну суміш різних газів? Чи не вказують ці та їм подібні явища і факти на те, що речовини складаються з дрібненьких частинок які постійно рухаються? А той факт, що загальний об’єм суміші двох різних речовин, наприклад води і солі, або води і спирту, виявляється суттєво меншим за суму об’ємів окремих складових цієї суміші. Чи не вказує він на те, що речовини складаються з дрібних частинок, між якими є проміжки пустоти?
Мал.1 Про що говорить факт того, що загальний об’єм суміші одного літра води і одного літра спирту є суттєво меншим за два літра?
Звичайно, вище наведені факти не є такими, що безумовно доводять факт існування молекул. Однак вони безумовно вказують на те, що гіпотеза про молекулярну будову речовини є науково обгрунтованою. Якщо ж говорити про ті експериментальні дослідження які науково доводять факт існування молекул, то вони тісно пов’язані з явищем, яке було відкрите та описане англійським ботаніком Робертом Броуном (1773 – 1858). В 1827 році, Броун намагаючись за допомогою мікроскопа розгледіти будову квіткового пилку, звернув увагу на те, що у водному розчині окремі пилинки постійно рухаються. Він розумів, що пилинки не є тими об’єктами які можуть самостійно рухатись. І тим не менше вони рухались. Дослідивши цей рух Броун з’ясував, що він є безперервним та безладним і що його інтенсивність залежить від розмірів пилинок: чим дрібніші пилинки, тим інтенсивніше вони рухаються. Однак Броун так і не зумів пояснити причини відкритого ним явища.
Певний час причини броунівського руху були не зрозумілими. Цей рух намагались пояснити тремтінням того стола на якому стоїть мікроскоп; впливом того світла яким опромінюють ті об’єкти що знаходяться під мікроскопом; конвекційними потоками тієї рідини в якій плавають броунівські частинки, тощо. Однак, експериментальні факти вказували на те, що ці та їм подібні обставини практично не впливають на поведінку броунівських частинок. На цю поведінку суттєво впливали лише розміри частинок та температура того середовища яке їх оточує.
Поступово вчені прийшли но того висновку, що єдиним обгрунтованим поясненням броунівського руху є хаотичний рух молекул того середовища яке оточує броунівські частинки: невидимі молекули середовища, барабанять дрібні частинки речовини і ті, реагуючи на ці хаотичні удари, відповідним чином рухаються. Броунівський рух – це безладний рух дрібних, видимих частинок речовини, причиною якого є хаотичний (тепловий) рух молекул навколишнього середовища.
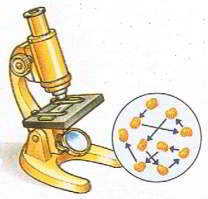
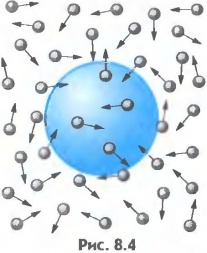
Мал.2 Хаотичний рух видимих мікрочастинок речовини (броунівський рух), є прямим наслідком хаотичного руху молекул навколишнього середовища.
Броунівський рух не лише вказує на те, що молекули речовини рухаються, а й несе в собі певну кількісну інформацію про цей рух. А це означає, що знаючи геометричні та вагові параметри броунівських частинок і кількісно аналізуючи їх поведінку, можна визначити параметри руху невидимих молекул. Наукову теорію броунівського руху розробив в 1905 році видатний німецький фізик Альберт Ейнштейн (1879 – 1955). Виходячи з того, що рух броунівських частинок є результатом хаотичного руху тих молекул які їх оточують, Ейнштейн теоретично описав закономірності руху цих частинок.
Ейнштейнівська теорія броунівського руху була експериментально перевірена і підтверджена в 1908 році французьким фізиком Жаном Переном (1870 – 1942). Власне лише після експериментів Перена, реальність існування молекул стала науково доведеним фактом.
До числа тих явищ які вказують на факт хаотичного руху молекул, відносяться дифузія та осмос. Розповсюдження запахів в повітрі, перемішування молекул тієї речовини що розчиняється, з молекулами розчинника, і взагалі все що пов’язано з тим перемішуванням молекул різних речовин, причиною якого є хаотичний рух цих молекул, прийнято називати дифузією (від лат. diffusion – розповсюдження). Дифузія – це явище, суть якого полягає в тому, що в процесі хаотичного руху молекул, молекули однієї речовини перемішуються з молекулами іншої речовини.
Дифузія відбувається не лише в рідинах і газах, а й в твердих тілах. Щоправда, в твердих тілах дифузійні процеси відбуваються надзвичайно повільно. Наприклад в одному з експериментів, дзеркально відполіровані пластини золота і свинцю поклали одна на одну і навантажили зовнішньою силою. Коли через п’ять років дані пластини спробували роз’єднати, то з’ясувалось, що вони в буквальному сенсі зрослись. При цьому, на межі контакту двох речовин утворився сантиметровий шар суміші їх молекул.

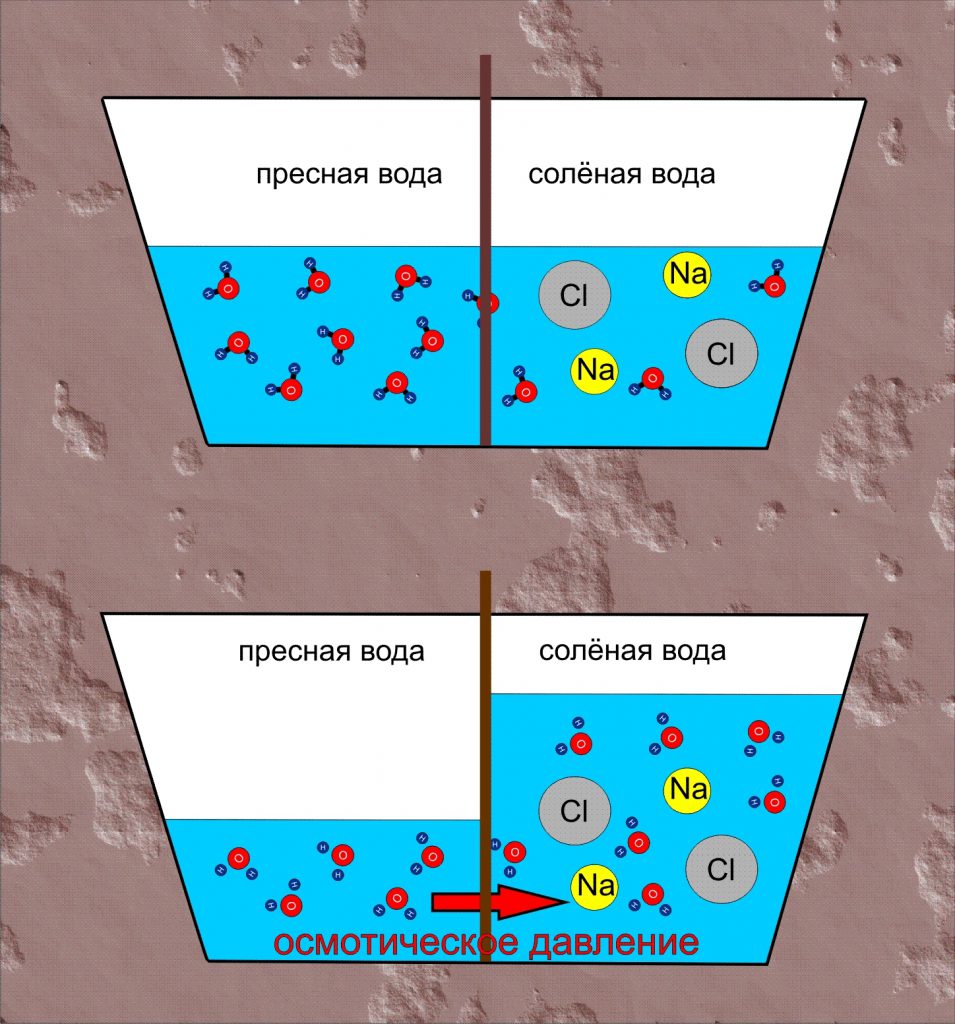
Мал.3 Деякі прояви дифузії та осмосу.
Однією з важливих різновидностей дифузії є осмос (від грец. osmos – тиск). Осмос – це явище, суть якого полягає в тому, що в процесі хаотичного руху молекул, одні з них проникають через напівпрозору перешкоду, а інші – не проникають через неї. Ілюструючи фізичну суть осмосу проведемо наступний експеримент. Візьмемо морквину і в її верхній частині зробимо циліндричний отвір діаметром 1см і глибиною ~8см. Наповнимо це заглиблення концентрованим розчином цукру і вставимо в нього скляну трубку відповідного діаметру. Після цього, опустимо моркву в посудину з дистильованою водою так, щоб рівень рідини в посудині та заглиблені моркви був однаковим. Через декілька годин ви побачите, що рівень тієї рідини яка знаходиться в заглиблені моркви суттєво збільшився.
Коментуючи результати даного експерименту можна сказати наступне. Різні молекули мають суттєво різні розміри та різні фізико-хімічні властивості. Тому один і той же матеріал для одних молекул може бути “прозорим”, а для інших – “непрозорим”. Наприклад, той матеріал з якого виготовлена морква, відносно легко пропускає дрібні молекули води (Н2О) і практично не пропускає значно об’ємніші молекули цукру (С6Н12О6). А оскільки концентрація молекул води в розчині цукру значно менша за їх концентрацію в чистій воді, то кількість молекул Н2О які проникають в розчин, значно більша за ту їх кількість яка покидає його. А це означає, що в процесі осмосу, кількість води в цукровому розчині буде збільшуватись. При цьому, надлишкова вода створює відповідний надлишковий тиск, який прийнято називати осмотичним.
Дифузія і осмос відіграють надзвичайно важливу роль в багатьох життєво важливих процесах. Наприклад, завдяки осмосу поживні і мінеральні речовини із навколишнього середовища потрапляють в тіла рослин, грибів та бактерій. Завдяки осмосу здійснюється обмін речовинами на міжклітинному і внутріклітинному рівнях всіх складних організмів. Завдяки дифузії, атмосфера Землі є тим чим вона є – сумішшю різних газів. Завдяки дифузії, розчини різних речовин є однорідними, тощо.
Словник фізичних термінів.
Основні положення молекулярно – кінетичної теорії (м. к. т.).
- Всі речовини складаються з молекул (молекул, атомів, іонів).
- Молекули в речовині безперервно та безладно (хаотично) рухаються.
- На невеликих відстанях (~10-9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
Броунівський рух – це безладний рух дрібних, видимих частинок речовини, причиною якого є хаотичний (тепловий) рух молекул навколишнього середовища.
Тепловий рух – це безладний (хаотичний) рух молекул речовини.
Дифузія – це явище, суть якого полягає в тому, що в процесі хаотичного руху молекул, молекули однієї речовини перемішуються з молекулами іншої речовини.
Осмос – це явище, суть якого полягає в тому, що в процесі хаотичного руху молекул, одні з них проникають через напівпрозору перешкоду, а інші – не проникають через неї.
Осмотичний тиск – це той додатковий тиск, який створює та додаткова речовина що проникає в даний об’єкт за рахунок осмосу.
Контрольні запитання.
- Наведіть приклади тих явищ та фактів які вказують на те, що тіла складаються з молекул і що ці молекули рухаються.
- Поясніть, чому думаючі люди, ще з прадавніх часів стверджували, що всі тіла складаються з надзвичайно дрібненьких частинок?
- Від чого залежить інтенсивність броунівського руху?
- Чому хаотичний рух молекул речовини часто називають тепловим?
- Чим схожі і чим відрізняються броунівський та тепловий рухи?
- Як ви думаєте, чому в твердих тілах дифузійні процеси відбуваються набагато повільніше аніж в рідинах?
- В чому суть осмосу і яка його роль в природі?
§3. Про силу міжмолекулярної взаємодії.
В попередньому параграфі ми навели вагомі докази того, що всі речовини складаються з молекул (молекул, атомів, іонів) і що ці молекули безперервно та безладно рухаються. Однак, чому ми вирішили що молекули взаємодіють між собою, та ще й таким дивним чином, що в залежності від міжмолекулярної відстані, притягуються або відштовхуються? Втім, переконатися в тому що молекули дійсно взаємодіють і взаємодіють саме таким чином, зовсім не складно. Достатньо взяти в руки будь яке тверде тіло, будь то лінійка, олівець, ручка чи гвіздок і запитати себе: “Якщо це тіло складається з молекул які рухаються, то чому ці молекули не розлітаються, а утворюють єдине ціле?”. Більше того, якщо ви спробуєте розтягнути тіло, тобто збільшити відстань між його молекулами, то неминуче відчуєте, що молекули притягуються. Якщо ж ви спробуєте стиснути тіло, тобто зменшити відстань між його молекулами, то з не меншою неминучістю відчуєте, що молекули відштовхуються. Висновок очевидний: молекули прагнуть розташуватися на певній відстані одна від одної, при цьому, якщо ця відстань збільшується, то молекули автоматично притягуються, а якщо зменшується – відштовхуються.
І не важко збагнути, що сили міжмолекулярної взаємодії суттєво проявляють себе лише на дуже маленьких відстанях. Адже якщо ви розібєте чашку, або зламаєте брусочок крейди, а потім спробуєте обєднати фрагменти раніше цілого тіла, то нічого путнього з цього не вийде. Не вийде тому, що навіть візуально мікроскопічна тріщинка між наявними фрагментами, для молекул представлятиме собою нездоланну прірву.
Пояснюючи вище наведені експериментальні факти можна сказати наступне. Та сила яку прийнято називати силою міжмолекулярної взаємодії представляє собою результуючу багатьох сил які так чи інакше впливають на поведінку молекул. Сьогодні ми не будемо говорити про природу та механізм дії цих сил. Сьогодні ми просто констатуємо той факт, що сила міжмолекулярної взаємодії представляє собою результуючу складної комбінації електростатичних, електромагнітних та квантово-механічних сил, з властивостями та проявами яких ми поговоримо у відповідних розділах фізики.
Та навіть не маючи уявлення про походження і механізм дії тих сил які визначають поведінку молекул, ми все ж спробуємо стисло пояснити, як це виходить, що ця поведінка таким складним чином залежить від міжмолекулярної відстані. Відразу ж зауважимо, що наші пояснення будуть гранично спрощеними, однак такими, що максимально точно відображають суть міжмолекулярних взаємодій.
Уявіть собі ситуацію, коли до відносно нерухомої молекули повільно наближається інша молекула. При цьому, ця рухома молекула оснащена двома датчиками, один з яких фіксує силу міжмолекулярного притягування (Fпр), інший – силу міжмолекулярного відштовхування (Fвід). Ми спостерігаємо за поведінкою молекул, фіксуємо показання приладів та аналізуємо їх. І ось що ми бачимо. Допоки молекули знаходяться на відносно великій відстані (r > 1?10-9м), прилади показують, що сили міжмолекулярного притягування і сили міжмолекулярного відштовхування практично не проявляють себе (Fпр=0; Fвід=0). Та коли міжмолекулярна відстань зменшиться до величини r ?1?10-9м, прилад який реагує на силу міжмолекулярного притягування, зафіксує що така сила з’являється і що по мірі наближення молекул, вона зростає. Аналізуючи характер цього зростання, ми приходимо до висновку, що воно відбувається за законом: Fпр=а/r7 , де а – коефіцієнт пропорційності, величина якого залежить від сорту взаємодіючих молекул. Даний закон говорить про те, що коли в області дії сил міжмолекулярного притягування, відстань між молекулами зменшиться в 2 рази, то сила їх притягування збільшиться в 27=128 разів.
Ясно, що якби між молекулами діяли лише сили притягування, та ще й такі що так швидко зростають, то ці сили із всіх молекул тіла зробили б одну надмасивну молекулу. Тому не важко передбачити, що на певному етапі зближення молекул, мають з’явитися достатньо потужні сили міжмолекулярного відштовхування. І такі сили дійсно з’являються. Приблизно на відстані r ? 0,5?10-9м, прилад який реагує на сили міжмолекулярного відштовхування фіксує, що відповідні сили з’являються і що по мірі наближення молекул вони зростають. Аналізуючи характер цього зростання, ми приходимо до висновку, що воно відбувається за законом Fвід=b/r13 , де b – коефіцієнт пропорційності величина якого залежить від сорту взаємодіючих молекул. Даний закон вказує на те, що коли в області дії сил міжмолекулярного відштовхування, відстань між молекулами зменшується в 2 рази, то сила їх відштовхування збільшиться в 213=8192 разів.
Таким чином, при міжмолекулярних взаємодіях на молекулу одночасно діють як сили міжмолекулярного притягування так і сили міжмолекулярного відштовхування. При цьому поведінка молекули визначається результуючою цих сил: F = Fпр + Fвід . Маючи загальні уявлення про характер залежності сил міжмолекулярного притягування та міжмолекулярного відштовхування від відстані між молекулами, не важко побудувати графік відповідної результуючої сили.
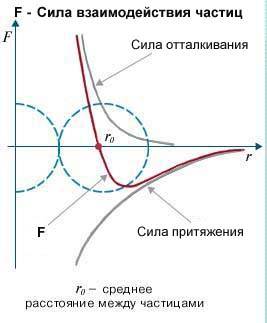
мал.4. При міжмолекулярних взаємодіях, поведінка молекули визначається результуючою сил міжмолекулярного притягування та міжмолекулярного відштовхування.
Із аналізу графіку результуючої сили міжмолекулярної взаємодії ясно, що під дією цієї сили, молекули прагнуть розташуватись на тій відстані для якої Fпр = Fвід , тобто на відстані r = r0 . Адже, якщо r > r0 , то молекули взаємно притягуються і прагнуть наблизитись одна до одної. А якщо r < r0 , то молекули взаємно відштовхуються і прагнуть віддалитися одна від одної. Ситуація нагадує таку, в якій дві кульки з’єднані пружиною: при наближені кульок, пружина стискається і кульки взаємно відштовхуються, а при віддалені – пружина розтягується і кульки взаємно притягуються (мал.5).
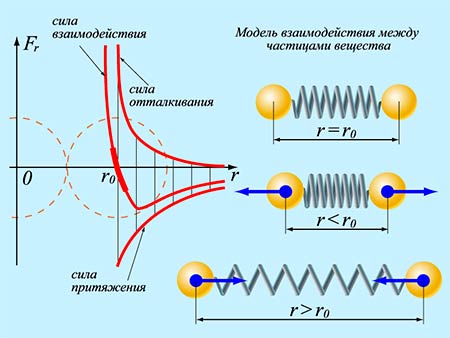
Мал.5. З’єднані пружиною кульки, прагнуть розташуватись на відстані r0 .
Втім, аналогія з пружно зв’язаними кульками не є надто вдалою. Адже при віддалені таких кульок, сили їх взаємного притягування лише збільшуються. Якщо ж віддаляються молекули, то сили міжмолекулярного притягування спочатку збільшуються, а потім – зменшуються. Більш вдалою та більш адекватною моделлю поведінки молекул є так звана механічна модель потенціальної ями.
Уявіть собі яму з ідеально гладенькою пружною поверхнею, профіль якої нагадує графік результуючої сили міжмолекулярної взаємодії (мал.6). Якщо в такій ямі опиниться пружна кулька, то її поведінка в значній мірі буде схожою на поведінку взаємодіючих молекул. Скажімо, якщо кінетична енергія кульки буде більшою за ту потенціальну енергію яка визначається глибиною потенціальної ями (Ек > Еп0), то здійснивши певне коливання, кулька викотиться з ями і безповоротно покине її. Це еквівалентно тому як молекули газу після їх взаємодії безповоротно розлітаються. Якщо ж кінетична енергія кульки менша за глибину потенціальної ями (Ек < Еп0), то кулька буде здійснювати певні коливання навколо найнижчої точки ями. При цьому її поведінка буде еквівалентною поведінці молекул твердого тіла.
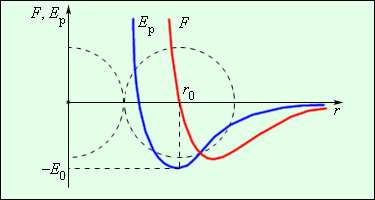
Мал.6. Механічна модель потенціальної ями – наочна модель енергетичної суті міжмолекулярних взаємодій.
По суті, в процесі міжмолекулярних взаємодій, молекула завжди потрапляє в певну потенціальну яму. При цьому, поведінка молекули, а відповідно і агрегатний стан речовини, визначальним чином залежатимуть від співвідношення між величиною кінетичної енергії молекули та глибиною відповідної потенціальної ями. І не важко збагнути, що:
для газів Ек > Еп0 ;
для рідин Ек ? Еп0 ;
для твердих тіл Ек < Еп0 .
Словник фізичних термінів.
Сила міжмолекулярної взаємодії – це результуюча системи багатьох сил, які в своїй сукупності забезпечують міжмолекулярні взаємодії. Суть цих взаємодій полягає в тому, що на невеликих відстанях (r ? 1?10-9м) молекули, в залежності від цієї відстані взаємно притягуються або взаємно відштовхуються.
Контрольні запитання.
- Наведіть докази того, що молекули взаємодіють між собою і що в залежності від міжмолекулярної відстані вони можуть як притягуватись так і відштовхуватись.
- Наведіть докази того що молекули взаємодіють на надзвичайно малих відстанях.
- Чому частинки зламаного твердого тіла не об’єднуються в єдине ціле? Що можна зробити для того щоб з’єднати ці частинки?
- Поясніть, яким чином виходить так що на одних відстанях молекули притягуються, а на інших – відштовхуються?
- Наведіть приклади механічних моделей які певним чином пояснюють поведінку взаємодіючих молекул.
- Поясніть яким чином агрегатний стан речовини залежить від співвідношення між потенціальною та кінетичною енергіями їх молекул.
§4. Про маси та розміри молекул.
В молекулярній фізиці ми не будемо вивчати подробиці будови атомів і молекул. Не будемо вивчати їх електричні, хімічні та біологічні властивості. Однак загальні відомості про атоми та молекули і перш за все про їх маси та розміри, ви все ж маєте знати.
Як зважити атом? Наївно думати, що існують такі надточні терези, на одну шальку яких можна покласти атом, а на іншу – гирьку відповідної маси. Ясно, що таких терезів не існує. Натомість існують опосередковані (непрямі) методи вимірювань, застосування яких дозволяє визначити масу атома з надзвичайно високою точністю.
Сьогодні ми не будемо заглиблюватись в деталі того, як вчені вимірюють маси атомів та молекул. Зауважимо тільки, що не довіряти цим вимірюванням, це все рівно ніби не довіряти тому, що визначена за формулою S=?R2 площа круга, гранично точно відповідає його реальній площі. Не довіряти лише на тій підставі, що визначаючи площу, ми фактично вимірювали не площу круга а його радіус. Зважаючи на вище сказане, ми зупинимся лише на тих аспектах вимірювання мас атомів, які пов’язані з фактом того, що різні атоми вступають в хімічні взаємодії в певних, строго визначених пропорціях.
На основі аналізу величезної кількості хімічних реакцій, було з’ясовано, що атомні маси всіх хімічних елементів знаходяться в певних співвідношеннях. При цьому вимірювання показували, що найлегшим атомом є атом водню (гідрогену Н). Виходячи з цього, в якості одиниці вимірювання атомних мас була обрана воднева одиниця маси. В такій системі вимірювань, маса атома водню приймалась за одиницю (m0(Н)=1,0000), а маси інших атомів визначались на основі того, в яких співвідношеннях ці атоми реагують з воднем. Так, наприклад, маса атому кисню (оксигену О) становила 15,874 водневих одиниць маси, а маса атому вуглецю (карбону С) – 11,917 цих одиниць і т.д.
Вимірювати атомні маса в водневих одиницях маси, тобто в масах найлегшого з атомів, представлялось абсолютно логічним та доцільним. Однак, в хімічній практиці маси подавляючої більшості елементів визначались на основі того в яких пропорціях вони взаємодіють не з воднем, а з киснем. І це закономірно. Адже кисень, це один з найактивніших хімічних елементів. Тому хіміки наполягли на тому, щоб атомну масу кисню вважати рівною 16,0000 , а маси інших елементів вимірювати не в водневих, а в кисневих одиницях маси. При цьому за таку потрібно було вважати 1/16 маси атома кисню.
Якщо ви думаєте, що на цьому епопея з вибором одиниці вимірювання атомних мас закінчилась, то помиляєтесь. Через певний час, фізики з’ясували, що навіть хімічно найчистіший кисень, представляє собою певну суміш дуже схожих але все таки суттєво різних атомів кисню. Ці схожі атоми називають ізотопами. Ізотопи мають практично однакові хімічні властивості але суттєво різні маси.
Оскільки хімічними методами розділити ізотопи практично не можливо, то хіміки за кисневу одиницю маси вважали 1/16 маси усередненого атома кисню. Фізики ж вміли розділяти ізотопи і тому за кисневу одиницю маси вважали 1/16 маси кисню ізотопу-16. Це означало що в хімії і фізиці атомні маси вимірювались фактично різними одиницями, які до того ж мали одну і ту ж назву. Так тривало до 1961 року. В цьому році було прийнято компромісне рішення – маси атомів, молекул, іонів та елементарних частинок вимірювати в атомних одиницях маси.
Атомна одиниця маси (а.о.м.) – це позасистемна одиниця вимірювання маси, яка дорівнює 1/12 маси атома вуглецю-12: а.о.м. = m0(С612)/12 .
На основі точних експериментальних досліджень встановлено:
а.о.м. = 1,6605655?10-27кг.
Загальні відомості про атоми, в тому числі і про їх маси , можна знайти в таблиці яка називається періодичною системою хімічних елементів (мал.7). В цій таблиці, кожен атом характеризується двома числами: порядковим номером атома (Z) та його масовим числом (Мr). Наприклад: Н11,0079; Не24,0026; С612,011; О815,999; С?1735,453; Рb82207,20 .
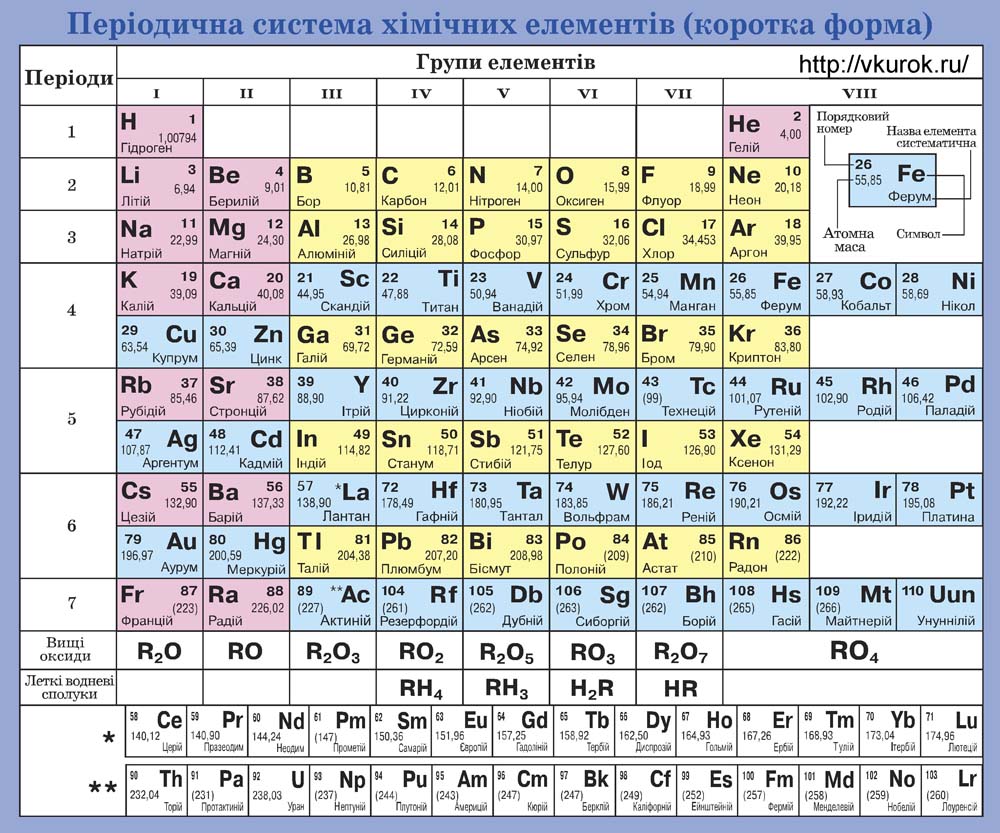
Мал.7 Періодична система хімічних елементів.
Масове число (відносна атомна маса) – це безрозмірна величина, яка показує у скільки разів маса усередненого атома даного хімічного елементу (m0) більша за одну атомну одиницю маси. Позначається Мr (“r” – від англ. relative – відносний). Відносна атомна маса даного хімічного елементу визначається на основі аналізу відповідних хімічних реакцій і записується у відповідну клітинку періодичної системи хімічних елементів.
Коли ми говоримо про усереднену масу атома (m0) даного хімічного елементу, то маємо на увазі той факт, що практично будь яка хімічно проста речовина, представляє собою певну суміш хімічно однакових але різних за масою ізотопів. Ізотопами – називають різновидності хімічно однакових атомів, в ядрах яких міститься однакова кількість протонів але різна кількість нейтронів. Це означає, що ізотопи мають практично однакові хімічні властивості, але суттєво різні атомні маси.
Наприклад, хімічно чистий природний хлор приблизно на 75% складається з ізотопу хлор-35, атомна маса якого 35а.о.м. і на 25% з ізотопу хлор-37, атомна маса якого 37а.о.м. А це означає, що визначаючи відносну атомну масу природної суміші цих ізотопів, завжди отримують Мr=35,45. Тому, коли масу атома хлору визначають на основі записаного в таблиці хімічних елементів масового числа (Мr=35,45), то фактично визначають не масу конкретного атома, а усереднену масу атомів даного хімічного елементу:
m0(C?) = 35,45(а.о.м.) = 35,45?1,66?10-27кг.
До речі, те що масові числа більшості хімічних елементів суттєво відрізняються від цілих чисел, це прямий наслідок того, що відповідні елементи представляють собою певну суміш різних ізотопів. Наприклад:
С612,011 = 98,89% С612 + 1,11% С613 ;
Сu2963,546 = 69,1% Cu2963 + 30,9% Cu2965 ;
Зважаючи на вище сказане, усереднену масу атома певного хімічного елемента (цю масу зазвичай називають масою відповідного атома) ми будемо визначати за формулою m0 = Mr (а.о.м.) = Mr ? 1,66?10-27кг, де Мr – масове число, значення якого визначається з таблиці хімічних елементів. Якщо ж мова йтиме про масу однієї молекули, то вона визначатиметься як сума мас тих атомів з яких ця молекула складається. Наприклад:
m0(H2O) = (2?1+16)а.о.м. = 18?1,66?10-27кг ;
m0(H2SO4) = (2?1+32+4?16)а.о.м. = 98?1,66?10-27кг ;
m0(NaCl) = (23+35,5)а.о.м. = 58,5?1,66?10-27кг .
Зауважимо. Маса атома (m0) виражена в а.о.м. і його відносна атомна маси (Mr) – чисельно рівні величини. Однак це не означає, що поняття “маса атома” і “відносна атомна маса” є тотожними. Тому потрібно говорити і писати: m0(H2O) = 18а.о.м. ; Mr = 18 , а не Mr = 18а.о.м.
Закінчуючи розмову про маси атомів і молекул, наведемо простий приклад, який наочно демонструє масштаби цих мас: маса середнього яблука (?100гр) у скільки разів більша за масу атома водню, у скільки разів маса Землі більша за масу цього яблука. Іншими словами:
Говорячи про розміри молекул ви маєте розуміти, що молекули (атоми) зовсім не схожі на все те що ви звикли бачити. Що вони не мають а ні чітких обрисів, а ні чітких меж. Молекули взагалі не мають того що прийнято називати розмірами, формою, об’ємом, густиною, тощо. Тому, коли ми говоримо про певні геометричні параметри молекули, то маємо на увазі параметри тієї умовної пружної кульки яка є гранично спрощеною моделлю відповідної молекули і яка лише віддалено схожа на неї.


Мал.8 Атом, а тим більше молекулу, лише досить умовно можна представити у вигляді певної пружної кульки.
Наближено оцінити умовні розміри молекул можна на основі наступних міркувань. Відомо, що в 18г води (1моль води) міститься 6,02?1023 її молекул. Відомо, що 18г води займають об’єм 18см3 =18?10-6м3. А це означає, що на одну молекулу води припадає об’єм 3?10-29м3 :
V0 = V/N = 18?10-6м3/6?1023 = 3?10-29м3,
і що діаметр цієї гіпотетичної молекули становить 0,38?10-9м :
оскільки Vкулі =?d3/6, d = (6V0/?)1/3 = 0,38?10-9м.
Ясно, що реальні розміри молекули води суттєво менші. Менші по перше тому, що кулі не можливо ущільнити настільки щоб між ними не було проміжків пустоти. А по друге, нам достеменно відомо що молекули рухаються і що тому вони знаходяться на певній відстані одна від одної. Більш точні розрахунки і вимірювання показують, що реальний діаметр молекули води (цей діаметр прийнято називати ефективним діаметром молекули) становить 0,2610-9м. Ілюструючи мізерність цього числа достатньо сказати, що молекула води у стільки разів менша за середнє яблуко, у скільки разів це яблуко менше за Землю. Іншими словами:
Дослідження показують, що ефективні діаметри атомів та хімічно простих молекул знаходяться в межах (0,2 – 0,4)нм = (0,2 – 0,4)10-9м. Наприклад: d(H2O) = 0,26нм ; d(H2) = 0,23нм ; d(O2) = 0,29нм ; d(N2) = 0,31нм; d(He) = 0,19нм ; d(CO2) = 0,32нм .
Словник фізичних термінів.
Атомна одиниця маси (а.о.м.) – це позасистемна одиниця вимірювання маси, яка дорівнює 1/12 маси атома вуглецю-12:
а.о.м. = m0(С612)/12 = 1,6605655?10-27кг.
Масове число (відносна атомна маса) – це безрозмірна величина, яка показує у скільки разів маса усередненого атома даного хімічного елементу (m0) більша за одну атомну одиницю маси. Позначається Мr (“r” – від англ. relative – відносний). Визначається експериментально і записується у відповідну клітинку періодичної системи хімічних елементів.
Контрольні запитання.
- Чому маси атомів спочатку вирішили вимірювати в водневих одиницях маси, а потім в кисневих одиницях?
- Чому на зміну кисневій одиниці маси прийшла атомна одиниця маси?
- Що називають ізотопами?
- Якщо а.о.м. це 1/12 маси атома вуглецю-12, то чому в таблиці хімічних елементів відносна атомна маса вуглецю не 12,000 а 12,011?
- Чи правильне твердження: масове число оксигену – 16а.о.м.?
Вправа 1.
- Визначити масу однієї молекули (в а.о.м. та кг): СО2; АgNO3; CuSO4; Ca(OH)2; C12H22O11 .
- Відомо, що природний вуглець на 99% складається з ізотопу С612 і на 1% з ізотопу С613. Визначте відносну атомну масу природного вуглецю.
- Скільки атомів знаходиться в 12 грамах вуглецю (С612)?
- Скільки атомів (молекул) міститься в: а) 18г Н2О; б) 27г А?; в) 98г Н2SO4; г) 207г Рb ? На основі отриманих результатів, зробіть узагальнюючий висновок.
§5. Маса, як міра кількості речовини.
Про те, що маса є кількісною мірою інерціальних, гравітаційних та енергетичних властивостей тіла, написано у всіх підручниках та енциклопедіях. Таке твердження не викликає жодних заперечень. Та от біда. В свідомості людей і в науковій практиці маса (в обіході ми часто говоримо “вага”) завжди сприймалась і напевно завжди буде сприйматись, як міра кількості речовини в тому чи іншому об’єкті. Адже коли в крамниці ви цікавитесь масою товару, скажімо цукру, картоплі, гречки чи золота, то вам нема справи до його інерційних, гравітаційних чи загально енергетичних властивостей. Вас цікавить кількість певної речовини в даному товарі, і ви знаєте – чим більша маса товару, тим більше в ньому відповідної речовини. І ось саме ця, здавалося б абсолютно очевидна і природна властивість маси, бути мірою кількості речовини в тому чи іншому об’єкті, є джерелом серйозних наукових суперечок, які не припиняються і до сьогоднішнього дня.
З’ясовуючи суть цих суперечок, необхідно бодай декілька слів сказати про теорію, яка є однією з основ сучасної науки і яка називається теорією відносності. В цій теорії стверджується і це твердження є експериментально доведеним фактом, що маса тіла певним чином залежить від його швидкості, і що при збільшенні швидкості тіла, його маса збільшується. Звичайно, для тих швидкостей з якими ми маємо справу в повсякденному житті, ефект збільшення маси настільки мізерний, що про нього нема сенсу навіть згадувати. Скажімо, навіть для сучасних космічних кораблів, швидкість яких в десятки разів перевищує швидкість кулі, приріст маси не перевищує 0,001 грама на 20 тон їх загальної маси. Що тоді говорити про наші автомобілі та велосипеди. Однак, як кажуть, справа принципу. Тим більше, що при швидкостях близьких до швидкості світла (300.000км/с), маса рухомого об’єкту може збільшуватись в десятки, сотні і тисячі разів. Наприклад, сучасні прискорювачі, здатні розганяти елементарні частинки до таких швидкостей, при яких їх маса збільшується в тисячі разів.
Прямим наслідком залежності маси тіла від його швидкості є і відповідна залежність цієї маси від температури. Адже тіло складається з молекул, швидкість руху яких при збільшенні температури збільшується. А це означає, що при збільшенні температури маса молекул, а відповідно і загальна маса тіла збільшується.
Тепер, коли ви знаєте що маса тіла певним чином залежить від його температури та швидкості руху, повернемося до нашого головного питання: чи можна вважати масу мірою кількості речовини? Щоб зрозуміти суть суперечностей між тими хто вважає масу об’єктивною мірою кількості речовини (прихильники маси) і тими хто так не вважає (противники маси), послухаємо короткий діалог між ними.
– Противники маси стверджують: “Якщо виходити з того, що кількість речовини в тілі є величиною абсолютною, тобто такою яка не залежить ні від температури тіла ні від швидкості його руху, а маса тіла від цієї температури та швидкості залежить, то можна стверджувати, що маса не є об’єктивною мірою кількості речовини в тілі”.
– Прихильники маси заперечують: “Ну по перше, з наукової точки зору, твердження про те що кількість речовини в тілі є абсолютно незмінною величиною, є відверто хибним. А по друге, в чому ж по вашому потрібно вимірювати кількість речовини в тілі?”
– “Дуже просто, – відповідають противники, – кількість речовини в тілі потрібно вимірювати числом тих структурних одиниць з яких це тіло складається. Воно ж бо напевно залишається незмінним.”
– “В такому разі дозвольте запитати, – не вгамовуються прихильники, – а що потрібно вважати структурною одиницею речовини: атом, молекулу, іон, атомне ядро, протон, електрон чи щось інше?”
– “Як ви не розумієте, – сердяться противники, – якщо речовина алюміній, то її структурною одиницею є атом алюмінію, якщо речовина свинець, то її структурною одиницею є атом свинцю, якщо речовина вода, то її структурною одиницею є молекула води і т.д.”
– “Даруйте, – дивуються прихильники, – по вашому виходить що в 27 грамах алюмінію і в 207 грамах свинцю міститься однакова кількість речовини? По вашому виходить, що в атомі свинцю, який складається з 207 протоно-нейтронів і 82 електронів, міститься стільки ж речовини як і в атомі алюмінію який складається з 27 протоно-нейтронів і 13 електронів? І потім, а як по вашому визначити кількість речовини в шматку дерева, шматку тканини, пінопласту, шкіри і взагалі того що прийнято називати полімерами та речовинами органічного походження? Адже не існує молекули дерева, молекули шкіри, молекули трави. А може ці об’єкти не є речовинними?”
Не будемо сперечатись відносно того чия аргументація є більш переконливою. Натомість, звернемось до визначень та фактів. А ці визначення та факти є наступними. По перше, за загально прийнятим визначенням:
Речовина – це вид матерії який складається з тих чи інших частинок і має масу (масу спокою). А це означає, що речовинами є не лише хімічно прості об’єкти, як то вода, золото, сірка, вапно чи кисень і не лише хімічно складні полімери, а й об’єкти органічного походження як то деревина, шкіра, бавовна, а з рештою і самі живі структури.
По друге. Стверджувати, що в 27 грамах алюмінію і в 207 грамах свинцю міститься однакова кількість речовини, можна лише в тому сенсі, що в даних кількостях даних речовин міститься однакова кількість їх атомів. І лише в тому розумінні речовини яке прийнято в хімії : “Кожний окремий вид матерії, який за даних умов має певні фізико-хімічні властивості, наприклад вода, залізо, сірка, вапно, кисень, в хімії називають речовиною” (Н.Л.Глінка “Загальна хімія”).
По третє. Стверджувати, що кількість речовини можна вимірювати лише числом її (речовини) структурних одиниць, або числом певним чином вибраних порцій речовини (ці порції прийнято називати молями), м’яко кажучи неправильно. Неправильно бодай тому, що виміряти кількість речовини, числом її структурних одиниць (N), або числом молей в ній (?), можна лише в тому випадку коли мова йде про хімічно прості речовини. Тобто такі речовини, які складаються з однакових хімічно простих структурних одиниць (атомів, молекул, іонів) і які можна представити у вигляді відповідної хімічної формули. Якщо ж мова йде про суміші хімічно простих речовин, про хімічно складні речовини (полімери), а тим більше про речовини органічного походження та живі структури, то визначити їх кількість в структурних одиницях чи молях практично не можливо. Цю кількість можна виміряти лише в кілограмах.
В четвертих. Навіть в тих випадках, коли кількість речовини в тілі можна визначити як числом її структурних одиниць (N) так і числом молей в ній (?), навіть в цьому випадку, це не можливо зробити без визначення маси речовини (m). Адже за визначенням: N=m/m0 ; ?=m/M.
В п’ятих. Коли ми стверджуємо, що за певних обставин маса тіла збільшується, то фактично це означає що відповідним чином збільшується і кількість тієї речовини яка в цьому тілі зосереджена. І це закономірно. Адже по суті, речовина – це певний згусток конденсованої енергії. І якщо в процесі руху, або в процесі нагрівання, величина цього енергетичного згустку збільшується, то відповідним чином збільшується і кількість речовини в тілі.
До речі. В процесі збільшення швидкості руху тіла і в процесі його нагрівання, збільшується не лише маса тіла, а й формально збільшується кількість зосереджених в ньому структурних одиниць. Дійсно. Якщо в процесі нагрівання, маса тіла збільшилась на ?m , то визначаючи кількість зосереджених в тілі структурних одиниць ви отримаєте:
– до нагрівання N=m/m0 ;
– після нагрівання N=(m+?m)/m0 .
Звичайно, це не означає що в реальності атомів дійсно стало більше. Однак ваші розрахунки покажуть, що їх стало більше.
Що ж, Природу не можливо обдурити. Тому, якщо за тих чи інших обставин, речовини стало більше, то щоб ви не обрали в якості одиниці її вимірювання – кілограм, структурну одиницю, моль чи джоуль, – результат буде незмінним: ви неодмінно з’ясуєте, що речовини дійсно стало більше.
Таким чином, неупереджений аналіз загально прийнятих визначень та реальних фактів безумовно вказує на те, що маса – це не просто об’єктивна міра кількості речовини, а основна, базова міра цієї кількості.
Маса – це фізична величина, яка є загальною мірою кількості речовини в тілі, виміряної в кілограмах.
Позначається: m
Визначальне рівняння: нема
Одиниця вимірювання: [m] = кг .
Завершуючи розмову про масу нагадаємо, що в фізиці терміном “маса” позначають чотири, по суті різні фізичні величини:
маса – міра інерціальних властивостей тіла;
маса – міра гравітаційних властивостей тіла;
маса – міра енергетичних властивостей тіла;
маса – міра кількості речовини в тілі, виміряної в кілограмах.
При цьому, в різних розділах фізики термін маса має суттєво різні значення. Наприклад в механіці, маса є мірою інерціальних властивостей тіла. В теорії гравітації, маса є мірою гравітаційних властивостей тіла. А в молекулярній фізиці – мірою кількості речовини в тілі.
Словник фізичних термінів.
Речовина – це вид матерії який складається з тих чи інших частинок і має масу (масу спокою).
Маса (в молекулярній фізиці) – це фізична величина, яка є загальною мірою кількості речовини в тілі, виміряної в кілограмах.
Позначається: m
Визначальне рівняння: нема
Одиниця вимірювання: [m] = кг .
Контрольні запитання.
- Чому твердження про те, що маса є мірою кількості речовини, викликає певні заперечення?
- Чи правильне твердження: з підвищенням температури, маса тіла збільшується? Наскільки суттєвим є це збільшення?
- Чим відрізняється загально наукове визначення терміну “речовина” від того що прийняти в хімії?
- Чи можна визначити кількість деревини: а) в структурних одиницях; б) в молях; в) в кілограмах? Про що це говорить?
- Чи можна визначити кількість структурних одиниць та кількість молей в тілі, не визначивши масу цього тіла? про що це говорить?
- Наведіть вагомі докази того, що маса є найбільш об’єктивною та універсальною мірою кількості речовини в тілі.
- §6. Про кількість речовини в тілі, та про ті величини які цю кількість характеризують.
В попередньому параграфі ми говорили про те, що речовинами називають такі матеріальні об’єкти, які складаються з тих чи інших частинок і мають масу спокою (тобто мають масу навіть в тому випадку якщо вони не рухаються). При цьому ми з’ясували, що загальною мірою кількості речовини в тілі є його маса. Однак, якщо мова йде про хімічно прості речовини, то кількість такої речовини можна оцінити не лише її масою (m), а й величинами які називаються кількістю структурних одиниць (N) та кількістю речовини (?). Визначаючи ці та похідні від них величини, можна сказати наступне.
Кількість структурних одиниць – це фізична величина, яка характеризує кількість речовини в тілі, виміряну в структурних одиницях цієї речовини.
Позначається: N
Визначальне рівняння: N=m/m0 , де m – загальна маса речовини; m0 – маса однієї структурної одиниці даної речовини;
Одиниця вимірювання: [N] =ст.од. (атоми, молекули, іони).
Кількість речовини – це фізична величина, яка характеризує кількість речовини в тілі, виміряну в молях, тобто в певним чином вибраних порціях (кучках) цієї речовини.
Позначається: ?
Визначальне рівняння: ?= m/M , де m – загальна маса речовини; M – молярна .маса даної речовини (маса тієї порції речовини яка називається молем).
Одиниця вимірювання: [?] = моль.
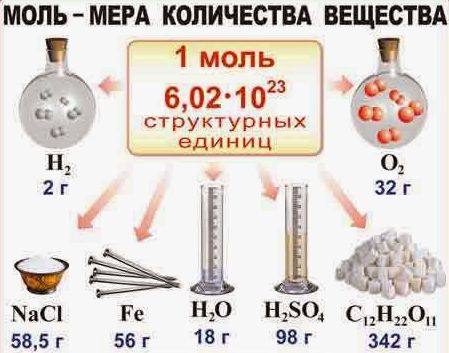
Моль (від лат. moles – маса) – це одиниця вимірювання кількості хімічно простої та хімічно однорідної речовини, яка дорівнює такій порції цієї речовини, в якій міститься стільки її структурних одиниць, скільки атомів міститься в 12 грамах вуглецю-12.
Задача. Скільки атомів міститься в 12 грамах вуглецю-12?
Дано СІ Аналіз
m(C612)=12г 12?10-3кг За визначенням N=m/m0 ,
N = ? де m0(C612)=12а.о.м.=12?1,66?10-27 (кг)
Розрахунки
N = (12?10-3кг)/(12?1,66?10-27кг) = 6,022?1023атомів.
Відповідь: в 12г вуглецю-12 міститься 6,022?1023 його атомів.
Висновок: В одному молі будь якої речовини міститься 6,022?1023 її структурних одиниць.
Таким чином, молем називають таку порцію хімічно простої та хімічно однорідної речовини, в якій міститься 6,022?1023 її структурних одиниць.
Постійна величина, яка дорівнює числу структурних одиниць в одному молі речовини, називають сталою Авогадро* (позн. NA):
NA = 6,022?1023 (1/моль).
*) Названо на честь одного з засновників сучасної молекулярної фізики, італійського вченого Амадео Авогадро (1776 – 1856).
Молярна маса речовини – це фізична величина, яка характеризує молярну масу даної хімічно простої речовини і яка дорівнює цій масі, тобто масі тієї порції речовини яка називається молем.
Позначається: M
Визначальне рівняння: M=m0NA
Одиниця вимірювання: [M] =кг/моль .
На практиці, молярну масу речовини зазвичай визначають не за визначальним рівнянням М=m0NA , а за формулою М=Мr (г/моль), де
Мr – відносна атомна (молекулярна) маса відповідної речовини.
Наприклад: М(Н2О)=18г/моль; М(А?)=27г/моль; М(Рb)=207г/моль; М(NaCl)=58,5г/моль; М(Н2SO4)=98г/моль; М(С12Н22О11)=342г/моль.
Не важко довести, що формула М=Мr (г/моль) є похідною від визначального рівняння М=m0NA . Дійсно:
M=m0NA=Mr?1,66?10-27(кг)?6,022?1023(1/моль)=Мr?10-3(кг/моль)=Мr(г/моль).
Таким чином, якщо взяти 18г Н2О , 98г Н2SО4 , 27г А? , 207г Рb і 342г С12Н22О11 , то в кожній з цих суттєво різних порціях (кучках) різних речовин буде однакова кількість їх структурних одиниць
Мал.9 Кількість речовин різна, а кількість молей і кількість структурних одиниць в них – однакова. Чому?
Оскільки в одному молі речовини міститься NA його структурних одиниць, то можна стверджувати, що в ? молях речовини, цих структурних одиниць буде в ? разів більше, тобто що N=?NA . При цьому не важко довести, що формули N=m/m0 і N=?NA є тотожними. Дійсно. Враховуючи що ?=m/M і М=m0NA , можна записати: N=?NA=(m/M)NA=(mNA)/(m0NA)=m/m0 .
З точки зору хімічної практики, вимірювати кількість речовини в молях надзвичайно зручно. Зручно головним чином тому, що хімічні взаємодії речовин відбуваються в певних вагових співвідношеннях, які пропорційні їх молярним масам. Тому в хімії кількість тієї чи іншої речовини зазвичай вимірюють в молях. Додайте до цього той малоприємний факт, що та фізична величина яка характеризує кількість речовини виміряну в молях називається “кількістю речовини” і ви зрозумієте чому, дехто вважає, що кількість речовини можна охарактеризувати лише величиною яка так і називається “кількість речовини”.
Таке твердження є абсолютно хибним. Хибним по перше тому, що визначити кількість молей в речовині можна лише в тому випадку, якщо мова йде про хімічно просту та хімічно однорідну речовину, тобто таку речовину яка складається з певних однакових структурних одиниць які можна представити у вигляді відповідної хімічної формули. По друге, визначити кількість речовини в молях не можливо без вимірювання маси відповідної речовини. По третє, стверджувати що в одному молі алюмінію (27г) і в одному молі свинцю (207г) міститься однакова кількість речовини, можна лише в сенсі однаковості числа атомів в цих фактично різних кількостях речовини. Бо якщо виходити з суті загально прийнятого визначення терміну речовина, то стверджувати що в 27г алюмінію стільки ж речовини як 207г свинцю, не менш абсурдно, аніж наполягати на тому, що в 1кг вишень стільки ж речовини як і в 500кг кавунів (кількість же структурних одиниць в обох кучках однакова).
————————————————————————100
—————————100————————————-кавунів
100 ———————яблук ———————————–500кг
вишень—————-15кг
1кг
Мал.10 Чи можна, на основі того, що в кожній кучці міститься однакова кількість структурних одиниць, стверджувати що кількість речовини в кожній кучці однакова?
Та якби там не було, а в науковій практиці, в залежності від ситуації та поставлених задач, кількість речовини в тому чи іншому фізичному об’єкті вимірюють в кілограмах, структурних одиницях або молях. Іншими словами, в науковій практиці, кількість речовини в тілі характеризують трьома фізичними величинами: масою, кількістю структурних одиниць та кількістю речовини. При цьому головною, загальною, універсальною та найбільш об’єктивною мірою кількості речовини є маса. Вона є такою по перше тому, що масою можна виміряти кількість будь якої речовини. А по друге, без визначення маси речовини не можливо визначити а ні кількість її структурних одиниць, а ні кількість молей в ній.
Таким чином:
———————————- характеризують вимірюють
кількість m кг
речовини N=m/m0 ст.од.
——————————————- ?=m/M моль
Завершуючи розмову про ті фізичні величини які характеризують кількість речовини в тілі, визначимо і ті з них, які певним чином характеризують кількість речовини в одиниці об’єму. До числа таких величин відносяться: густина (?); концентрація молекул (n0); молярна концентрація (с).
Густина – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки кілограм даної речовини знаходиться в одиниці її об’єму.
Позначається: ?
Визначальне рівняння: ? = m/V
Одиниця вимірювання: [?] = кг/м3 .
Концентрація молекул – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки молекул (структурних одиниць) даної речовини знаходиться в одиниці її об’єму.
Позначається: n0
Визначальне рівняння: n0 = N/V
Одиниця вимірювання: [n0] = 1/м3 .
Молярна концентрація – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки молей даної речовини знаходиться в одиниці її об’єму.
Позначається: с
Визначальне рівняння: с = ?/V
Одиниця вимірювання: [с] = моль/м3 .
Словник фізичних термінів.
Кількість структурних одиниць – це фізична величина, яка характеризує кількість речовини в тілі, виміряну в структурних одиницях цієї речовини.
Позначається: N
Визначальне рівняння: N=m/m0
Одиниця вимірювання: [N] =ст.од. (атоми, молекули, іони).
Кількість речовини – це фізична величина, яка характеризує кількість речовини в тілі, виміряну в молях.
Позначається: ?
Визначальне рівняння: ?= m/M
Одиниця вимірювання: [?] = моль.
Моль – це одиниця вимірювання кількості хімічно простої та хімічно однорідної речовини, яка дорівнює такій порції цієї речовини, в якій міститься стільки її структурних одиниць, скільки атомів міститься в 12г вуглецю-12 (тобто 6,022?1023 структурних одиниць) .
Стала Авогадро (NA=6,0221023 1/моль) – це постійна величина, яка показує скільки структурних одиниць (молекул) міститься в одному молі відповідної речовини.
Молярна маса – це фізична величина, яка характеризує молярну масу даної хімічно простої речовини і яка дорівнює цій масі, тобто масі тієї порції речовини яка називається молем.
Позначається: M
Визначальне рівняння: M=m0NA
Одиниця вимірювання: [M] =кг/моль .
Густина – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки кілограм даної речовини знаходиться в одиниці її об’єму.
Позначається: ?
Визначальне рівняння: ? = m/V
Одиниця вимірювання: [?] = кг/м3 .
Концентрація молекул – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки молекул (структурних одиниць) даної речовини знаходиться в одиниці її об’єму.
Позначається: n0
Визначальне рівняння: n0 = N/V
Одиниця вимірювання: [n0] = 1/м3 .
Контрольні запитання.
- Чи можна визначити кількість паперу: а) в структурних одиницях;
б) в молях; в) в кілограмах? Про що це говорить?
- Що мають на увазі хіміки, коли стверджують, що в 18г води, 98г сірчаної кислоти і в 342г цукру, міститься однакова кількість речовини?
- Чому різні речовини в кількості один моль мають різні маси?
- Чому в хімії, кількість речовини зазвичай вимірюють в молях?
- Доведіть що формули М = m0NA і M = Mr (г/моль) є тотожними.
- Які величини характеризують кількість речовини в одиниці об’єму?
Вправа 2.
- Визначити масу однієї молекули, молярну масу, кількість молей і кількість молекул в 200г : а) Н2О; б) CuSO4; в) AgNO3; г) Ca(OH)2 .
- Відомо, що за нормальних умов, один моль будь якого газу займає об’єм 22,4 літра (закон Авогадро). Визначити концентрацію молекул за цих умов.
- За 5 діб випарувалось 60г води. Скільки молекул вилітало при цьому за одну секунду.
- Який об’єм одного моля алюмінію (густина алюмінію 2,7г/м3) ?
- Де більше атомів, в склянці води чи склянці ртуті? (густина ртуті 13,6г/м3) ?
- Знаючи число Авогадро визначте приблизний об’єм та діаметр атома золота (густина золота 19,3г/м3).
- Кухонна сіль має кубічну кристалічну структуру в вузлах якої розташовані іони натрію та хлору. Знаючи густину солі (2200кг/м3) визначте відстані між центрами найближчих іонів.
- §7. Температура, як міра нагрітості тіла.
Слово “температура” в перекладі з латинської означає “суміш”. Така назва обумовлена фактом того, що колись вчені вважали буцімто температура тіла залежить від того, в яких пропорціях в цьому тілі змішані відповідна речовина та особлива теплова матерія яку називали теплородом. Згодом з’ясувалося, що ніякого теплороду не існує і від ідеї суміші теплороду з речовиною відмовились. А от слово “температура” залишилось, і сьогодні, як і сотні років тому характеризує ступінь нагрітості тіла. Втім, температура, це та фізична величина, яка має що найменше чотири різні, загально прийняті наукові визначення. При цьому вчені так і не дійшли згоди відносно того, а яке ж з цих визначень є найбільш правильним.
Вивчаючи фізику, ми стикались з ситуацією коли одним і тим же терміном, зокрема словом “маса”, позначали чотири фактично різні фізичні величини: маса – міра інерції; маса – міра гравітації; маса – міра енергії; маса – міра кількості речовини. Стикались також з ситуацією, коли навпаки, один і той же параметр фізичного об’єкту, а саме кількість речовини в ньому, характеризують трьома фактично різними фізичними величинами – масою, кількістю структурних одиниць та кількістю речовини. Наразі ж мова йде про те, що одна і та ж фізична величина, яка позначається одним і тим же словом, і яка характеризує одну і ту ж властивість фізичного об’єкту, в різних обставинах та в різних розділах фізики, визначається по різному. І цією величиною є температура.
З точки зору повсякденної практики безумовно найзручнішим є наступне наукове визначення температури. Температура – це фізична величина, яка характеризує ступінь нагрітості тіла, виміряну термометром за температурною шкалою Цельсія.
Позначається: t
Визначальне рівняння: нема , (нема тому, що у відповідності з даним визначенням, температура є абсолютно автономною (незалежною від інших) величиною)
Одиниця вимірювання: [t] = °C , градус Цельсія.
Градус Цельсія (°С) – це одиниця вимірювання температури, яка дорівнює одній сотій інтервалу температур між точкою плавлення та точкою кипіння чистої води, визначеними при нормальному атмосферному тиску.
Аналізуючи визначення терміну температура, доречно зауважити, що температуру тіла визначають не за суб’єктивними відчуттями людини, а за показаннями спеціального приладу який називається термометром. А якщо ви думаєте, що температуру тіла можна визначити за своїми відчуттями, то проведіть наступний простий експеримент. Візьміть сталеву ложку і шматок пінопласту, та приклавши їх до своїх щік, спробуйте оцінити ступінь нагрітості цих тіл. Скоріш за все, ваші відчуття скажуть що ложка є холодною, а пінопласт – теплим. І це при тому, що температура цих тіл є абсолютно однаковою. Звичайно за умови, що пінопласт і ложка знаходились в одному і тому ж місці і що температура цього місця була суттєво меншою за температуру вашого тіла.
Термометр – це прилад, за допомогою якого вимірюють температуру. Основним вимірювальним елементом будь якого термометра є чутливе до зміни температури термометричне тіло. Принцип дії термометра грунтується на тому, що певний параметр термометричного тіла, певним визначеним чином залежить від температури. Наприклад, в процесі зміни температури, можуть змінюватись лінійні розміри термометричного тіла, його об’єм, форма, пружність, електропровідність, тощо. Власне за величиною цих змін і визначають відповідну температуру.
Важливою складовою процесу вимірювання температури є температурна шкала , тобто та система відліку температури в якій задано початок відліку (нулева точка), одиниця вимірювання та еталонний метод цього вимірювання. З побутової точки зору найбільш зручною та розповсюдженою температурною шкалою є шкала Цельсія. Цю шкалу запровадив в 1742 році шведський вчений Андерс Цельсій (1701–1744). В температурній шкалі Цельсія за початок відліку температур прийнято температуру плавлення води (льоду); за одиницю вимірювання – градус Цельсія; за еталонний метод вимірювання – вимірювання температури ртутним термометром.
Будова сучасного побутового термометра загально відома. Його основною деталлю є висока скляна колбочка, частково заповнена певною рідиною (зазвичай ртуттю або забарвленим спиртом). Напевно ви здогадуєтесь і про те, яким чином градуюють термометр?! Правильно. Його спочатку опускають в суміш води і льоду і відповідний рівень термометричної рідини позначають 0°С (мал.11а). Потім термометр опускають в окріп і наявний рівень термометричної рідини позначають 100°С (мал.11б). Після цього, відстань між отриманими точками ділять на сто рівних чистин і термометр готовий до застосування.
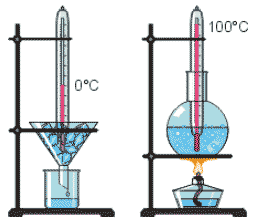

Мал.11 При градуюванні термометра, відстань між його показаннями при температурі плавлення льоду (а) і температурі кипіння води (б), ділять на сто рівних частин.
Якщо виходити з того, що теплове розширення термометричного тіла є рівномірним, то вище описаний спосіб градуювання термометра не викликає жодних заперечень. Однак, чи можемо ми бути впевненими в тому, що теплове розширення ртуті, спирту та інших матеріалів дійсно є рівномірним? Виявляється, не можемо. Дослідження показують, що теплове розширення подавляючої більшості тіл, складним чином залежить від температури, і що в загальному випадку ця залежність не є лінійною.
Скажімо, якщо взяти ртутний та спиртовий термометри і вище описаним способом проградуювати їх, то в процесі вимірювання температури з’ясується, що в одних і тих же температурних умовах ці термометри будуть показувати суттєво різні температури. Наприклад в ситуації коли ртутний термометр буде показувати 50°С, спиртовий покаже лише 43°С (мал.11г). Або, якщо наприклад, в якості термометричних тіл взяти ртуть, залізо, мідь, скло та повітря, виготовити з них відповідні термометри і вище описаним способом проградуювати їх, то неодмінно з’ясується, що за одних і тих же температурних умов, показання різних термометрів будуть суттєво різними. Скажімо, якщо повітряний термометр буде показувати 300°С то ртутний зафіксує 314°С, залізний 373°С, мідний 329°С, а скляний 353°С.
В такій ситуації неминуче виникає запитання: “А який з цих термометрів показує правильну температуру? І чи є серед цих показань бодай одне безумовно правильне?” відповісти на ці запитання можна лише втому випадку, якщо створити такий термометр, в якому певний параметр термометричного тіла гарантовано лінійно залежатиме від температури. І такий еталонний термометр дійсно існує. Його називають газовим термометром.
В 1802 році французький фізик Гей-Люсак (1778-1850) експериментально встановив, що при постійному тиску певної маси газу (m=const; p=const), всі гази розширюються однаково і що при цьому виконується співвідношення Vt = V0(1+?t) ,
де Vt – об’єм газу при температурі t°C;
V0 – об’єм газу при температурі 0°С ;
? =1/273 – температурний коефіцієнт об’ємного розширення газу.
По суті це означало, що при постійному тиску певної маси газу, його об’єм лінійним чином залежить від температури і що тому термометр в якому термометричним тілом є газ, можна вважати еталонним?
V
2V0
V0
| | | | |
-273°C 0°C 273°C t(°C)
Мал.12 В процесі ізобаричного (m=const; p=const) нагрівання (охолодження) газу, його об’єм лінійним чином збільшується (зменшується).
Дослідження, проведені з застосуванням еталонних газових термометрів показали, що в більш-менш широких температурних інтервалах, подавляюча більшість твердих та рідких матеріалів, розширюються не рівномірно (не лінійно). Однак, якщо мова йде про побутово важливий інтервал температур (від -30°С до +150°С), то в цьому інтервалі ртуть розширюється майже лінійно. Тому в температурному інтервалі від – 30°С до +150°С ртутні термометри вважаються одними з найкращих.
Крім всього іншого, закон Гей-Люсака вказував на те, що в Природі існує нижня межа температур і що числове значення цієї межі -273°С. Детальні дослідження та точні вимірювання показали, що гранично низька температура дійсно існує і що її величина дійсно становить -273°С (точніше -273,15°С). Цю гранично низьку температуру прийнято називати абсолютним нулем.
Обираючи в якості точки відліку температур, температуру плавлення льоду, ми керувались міркуваннями практичної доцільності та зручності. Але, чесно кажучи, за такого підходу, в якості нулевої точки можна вибрати будь яку іншу сталу температуру, наприклад температуру плавлення свинцю, золота, міді чи скажімо суміші води, солі та нашатирю. Тепер же, коли з’ясувалось що в Природі існує певна, гранично низька температура (-273°С), чи не буде розумним саме цю температуру обрати за об’єктивну точку відліку температур? Таке цілком логічне рішення було прийнято. При цьому відповідну температурну шкалу назвали абсолютною шкалою температур або шкалою Кельвіна (на честь англійського фізика Уільяма Томсона (лорда Кельвіна) який в 1848 році і запропонував абсолютну шкалу температур).
В абсолютній шкалі температур, за початок відліку прийнято температуру абсолютного нуля, за одиницю вимірювання – кельвін, а за еталонний метод вимірювання – вимірювання за допомогою еталонного газового термометра. При цьому, визначення температури набуває вигляду:
Температура – це фізична величина, яка характеризує ступінь нагрітості тіла виміряну еталонним газовим термометром за абсолютною шкалою температур.
Позначається: Т
Визначальне рівняння: нема
Одиниця вимірювання: Т = К , кельвін.
Кельвін (К) – це одиниця вимірювання температури, яка дорівнює
1/273,16 частині інтервалу температур між температурою абсолютного нуля
(-273,15°С) та температурою потрійної точки води (0,01°С).
На перший погляд офіційні визначення тих температурних одиниць які називаються кельвіном та градусом Цельсія є абсолютно різними. Однак суть цих різних визначень полягає в тому, що у відповідності з ними, кельвін (К) та градус Цельсія(°С) є чисельно рівними одиницями: К=°С. Якщо ж говорити про ту різницю яка безумовно існує між температурою виміряною в градусах Цельсія (t) та температурою виміряною в кельвінах (Т), то вона полягає в тому, що в першому випадку за початок відліку температур (за 0°С) прийнято температуру плавлення льоду, а в другому (за 0К) – температуру абсолютного нуля. І не важко збагнути, що між температурою виміряної в кельвінах (Т) і температурою виміряною в градусах Цельсія (t) існує просте співвідношення: Т = t + 273 або t =T – 273. При цьому, потрібно зауважити: якщо мова йде про різницю температур, то ця різниця визначена в градусах Цельсія (?t) і в кельвінах (?Т) є чисельно рівною: ?t=?T.

Мал.13 Чим схожі і чим відрізняються температури виміряні за шкалою Цельсія та за шкалою Кельвіна?
На завершення додамо, що в науковій практиці бузовою шкалою вимірювання температур є шкала Кельвіна (абсолютна шкала температур). В побутовій же практиці, температуру зазвичай вимірюють за шкалою Цельсія. Втім, в деяких країнах, зокрема США, температуру часто вимірюють за шкалою Фаренгейта. Ця шкала була запроваджена в 1724 році німецьким вченим Габріелем Фаренгейтом (1686-1736). Шкала Фаренгейта побудована на трьох базових точках:
0°F – температура суміші льоду, солі та нашатирю ( – 17,8°С)
32°F – температура плавлення льоду (0°С)
98°F – температура людського тіла (36,6°С).
За шкалою Фаренгейта температурі кипіння води, відповідає +212°F , а температурі абсолютного нуля -459°F
Словник фізичних термінів.
Температура – це фізична величина, яка характеризує ступінь нагрітості тіла, виміряну термометром за температурною шкалою Цельсія.
Позначається: t
Визначальне рівняння: нема
Одиниця вимірювання: [t] = °C , градус Цельсія.
Температура – це фізична величина, яка характеризує ступінь нагрітості тіла виміряну еталонним газовим термометром за абсолютною шкалою температур.
Позначається: Т
Визначальне рівняння: нема
Одиниця вимірювання: Т = К , кельвін.
Градус Цельсія °С (кельвін К) – це одиниця вимірювання температури, яка дорівнює одній сотій інтервалу температур між точкою плавлення та точкою кипіння чистої води, визначеними при нормальному атмосферному тиску.
Абсолютна шкала температур (шкала Кельвіна) – це така температурна шкала, в якій за початок відліку температур прийнято температуру абсолютного нуля, за одиницю вимірювання – кельвін, а за еталонний метод вимірювання – вимірювання за допомогою еталонного газового термометра.
Контрольні запитання.
- Слово “температура” в перекладі з латинської означає “суміш”. Чому величина яка характеризує ступінь нагрітості тіла, отримала таку назву?
- Як ви думаєте, чому сталева ложка, температура якої 20°С на дотик здається холодною, а такої ж температури пінопласт – теплим?
- Що називають термометричним тілом?
- Чому термометри проградуйовані однаковим способом, але виготовлені на основі різних термометричних тіл, можуть показувати суттєво різні температури?
- Чим схожі і чим відрізняються шкала Цельсія та шкала Кельвіна?
- Чому t ? Т, а ?t = ?Т ?
§8. Температура, як міра середньої кінетичної енергії молекул.
Визначення, температура – це фізична величина, яка характеризує ступінь нагрітості тіла виміряну термометром, має два суттєві недоліки. По перше, воно не пояснює ні фізичної суті того що називають нагрітістю тіла, ні фізичної суті того що називається температурою. Це визначення лише констатує факт того, що певні параметри термометричного тіла, певним чином залежать від ступеню нагрітості цього тіла (від його температури) і на цій підставі, визначає спосіб вимірювання цієї нагрітості.
По друге, дане визначення вводить температуру як абсолютно автономну величину, яка жодним чином не пов’язана з іншими величинами. Сучасна ж наука стоїть на тому, що Природа – це єдиний цілісний організм, в якому все взаємопов’язано та взаємообумовлено. Тому, якщо ми прагнемо об’єктивно відобразити устрій цього цілісного організму, то маємо спиратись на відповідну систему взаємопов’язаних фізичних величин.
Крім цього. Починаючи вивчення молекулярної фізики, ми домовились про те, що загальні властивості речовин та ті теплові процеси які відбуваються з ними, будемо пояснювати виходячи з трьох базових тверджень:
- всі речовини складаються з молекул;
- молекули в речовині безперервно та безладно рухаються;
- на невеликих відстанях, молекули взаємодіють між собою.
А це означає, що в молекулярній фізиці, визначення тієї величини яка називається температурою, потрібно пов’язати з фактом того, що речовини складаються з молекул які рухаються та взаємодіють між собою. І не важко збагнути, що температура (нагрітість тіла) певним чином пов’язана з інтенсивністю хаотичного руху молекул. На цей зв’язок з усією очевидністю вказує той факт, що в процесі збільшення температури, інтенсивність дифузії, осмосу, броунівського руху та інших подібних явищ, збільшується і навпаки.
Аналізуючи величезну сукупність явищ та експериментальних фактів, вчені дійшли висновку: температура, це не просто міра нагрітості тіла, а величина, яка характеризує середню кінетичну енергію теплового (хаотичного) руху молекул. При цьому, теоретичні та експериментальні дослідження довели, що між температурою речовини виміряну в кельвінах (Т) та середньою кінетичною енергією молекул цієї речовини (Ек) виміряну в джоулях, існує співвідношення: Т = Ек/(3/2)k , де
Eк =m0vc2/2 – середня кінетична енергія теплового руху однієї молекули речовини;
vc – середня квадратична швидкість молекули: vc=[(v12+v22+…+vn2)/n]1/2 ;
k = 1,38?10-23 Дж/К – постійна величина, яка називається сталою Больцмана (названа на честь одного з творців сучасної молекулярно кінетичної теорії, австрійського фізика Людвіга Больцмана (1844-1906)).
Стала Больцмана (k = 1,38?10-23Дж/К) – це постійна величина, яка показує, на скільки джоулів зміниться середня кінетична енергія однієї молекули речовини, при зміні температури цієї речовини на 3/2 кельвіна (на 1,5°С). Іншими словами, якщо будь яку речовину нагріти на 1,5К (на 1,5°С), то середня кінетична енергія кожної молекули цієї речовини збільшиться на 1,38?10-23Дж.
По суті, стала Больцмана є тим коефіцієнтом, який відображає той кількісний зв’язок що існує між двома незалежними одиницями вимірювання енергії: джоулем та кельвіном. А цей зв’язок полягає в наступному:
1,5К = 1,38?10-23Дж , або 1К = 0,92?10-23Дж.
Таким чином, в молекулярній фізиці прийнято наступне визначення температури. Температура – це фізична величина, яка характеризує середню кінетичну енергію теплового (хаотичного) руху молекул речовини, виміряну не в джоулях а в кельвінах.
Позначається: Т
Визначальне рівняння: Т = Ек/(3/2)k
Одиниця вимірювання: [Т] = К , кельвін.
Прийняте в молекулярній фізиці визначення температури, має ряд безумовних переваг. По перше, воно розкриває фізичну суть температури і вказує на те, що в процесі нагрівання тіла, кінетична енергія його молекул збільшується, а в процесі охолодження – зменшується. По друге, розкриває фізичну суть абсолютного нуля: абсолютний нуль – це температура при якій припиняється тепловий рух молекул речовини. По третє, визначає температуру не як певну автономну величину, а як величину яка тісно пов’язана з іншими, раніше введеними величинами. В четвертих, дозволяє визначати середню кінетичну енергію молекул не шляхом вимірювання їх мас (m0) та середньої квадратичної швидкості (vc), а шляхом вимірювання температури речовини (Т): Ек = (3/2)kT .
На завершення зауважимо, що температура характеризує середню кінетичну енергію хаотичного руху молекул. А це означає, при одній і тій же температурі, в будь якій речовині містяться молекули з різними кінетичними енергіями. Умовно кажучи, в будь якій речовині, при одній і тій же температурі наявні як “холодні” так і “гарячі” молекули.
Словник фізичних термінів.
Температура (в молекулярній фізицї) – це фізична величина, яка характеризує середню кінетичну енергію теплового (хаотичного) руху молекул речовини, виміряну не в джоулях а в кельвінах.
Позначається: Т
Визначальне рівняння: Т = Ек/(3/2)k
Одиниця вимірювання: [Т] = К , кельвін.
Стала Больцмана (k = 1,38?10-23Дж/К) – це постійна величина, яка показує, на скільки джоулів зміниться середня кінетична енергія однієї молекули речовини, при зміні температури цієї речовини на 3/2 кельвіна.
Абсолютний нуль – це температура при якій припиняється тепловий рух молекул речовини.
Контрольні запитання.
- Які недоліки визначення: температура – міра нагрітості тіла?
- Які переваги визначення: температура – міра середньої кінетичної енергії молекул речовини?
- Які явища вказують на те, що температура речовини пов’язана з інтенсивністю хаотичного руху її молекул?
- На основі молекулярно кінетичної теорії поясніть, чому температура речовини не може бути меншою за абсолютний нуль.
- Який фізичний зміст сталої Больцмана?
- Про що говорить твердження: температура є сірою середньої кінетичної енергії молекул речовини?
Вправа 2.
- Температура речовини становить 293К, 310К, 200К, 500К. Виразіть цю температуру в градусах Цельсія.
- Воду нагріли від 20°С до 48°С. На скільки змінилась температура води в процесі нагрівання? Відповідь дати в градусах Цельсія і в кельвінах.
- Визначте середню кінетичну енергію молекул Н2 та О2 при температурах 20°С і 200°С.
- Знаючи, що маса молекули кисню в 16 разі в більша за масу молекули водню, порівняйте середні квадратичні швидкості цих молекул при однакових температурах відповідних речовин.
- Визначте середню квадратичну швидкість молекул водню (Н2), азоту (N2) вуглекислого газу (СО2) при температурі 20°С. Порівняйте цю швидкість з швидкістю кулі (500м/с).
- Визначте загальну кінетичну енергію одного моля гелію.
§9. Закон розподілу молекул за швидкостями.
Факт того, що молекули рухаються хаотично, по суті означає, що в будь який момент часу різні молекули речовини мають різні швидкості і що значення цих швидкостей можуть суттєво відрізнятись від середніх величин. При цьому виникає питання: “Чи існує певна закономірність розподілу молекул за їх швидкостями? І чи можна сказати, скільки молекул в тій чи іншій ситуації рухається з певною швидкістю?”
Якщо виходити з того, що молекули, це ідеально круглі пружні кульки, то поведінку кожної з цих кульок, в принципі, можна описати на основі законів ньютонівської механіки. А знаючи поведінку кожної окремої молекули, можна спробувати визначити певні закономірності цієї поведінки. Втім, абсолютно очевидно, що така програма дій є безперспективною і нездійсненною. Адже мова йде про математичне описання системи, в якій кожна з безкінечно величезної кількості молекул, на протязі кожної секунди мільйони разів взаємодіє з своїми сусідами, і де кожна з цих взаємодій описується щонайменше шістьма незалежними рівняннями. Додайте до цього той факт, що насправді, молекули – це не пружні кульки, а надскладні квантово- механічні системи і ви зрозумієте, що описати поведінку кожної окремо взятої молекули не можливо. Не можливо не лише технічно, а й теоретично.
Розібратись в закономірностях поведінки молекул, можна лише на основі статистичного методу наукових досліджень. Суть цього методу полягає в тому, що поведінку та властивості складної, багаточисельної системи, описують на основі законів ньютонівської механіки та статистично усереднених параметрів окремих елементів цієї системи.
По суті, теоретичною основою статистичного методу наукових досліджень є ідея про те, що в будь якій реальній ситуації, малоймовірна подія не може відбуватись настільки часто щоб суттєво вплинути на загальний, найбільш ймовірний стан системи. Наприклад, в принципі можливим є те, що всі ті молекули газу які знаходяться всередині закритої посудини, в певний момент часу почнуть рухатись в одному напрямку і дружно вдаривши відповідну стінку, змусять посудину стрибнути у відповідному напрямку. Стрибнути в прямому, буквальному сенсі цього слова. Така подія можлива, але малоймовірна. Навряд чи розумно очікувати того, що 1023 молекул, без будь яких вагомих причин, почнуть рухатись в одному напрямку, і що цей упорядкований рух буде тривати настільки довго, що посудина дійсно перестрибне в інше місце. Ви можете скільки завгодно очікувати такої події, але вона не відбудеться. Не відбудеться не тому, що ця подія принципово не можлива, а тому що вона надзвичайно малоймовірна. Або, наприклад, ви можете скільки завгодно очікувати того, що всі молекули газу зберуться в одній частині посудини, тоді як інша її частина залишиться пустою. Така ситуація є можливою але малоймовірною.
В статистичній фізиці не заперечується можливість тих чи інших малоймовірних подій. В ній лише стверджується, що малоймовірні події не можуть відбуватись настільки часто, щоб суттєво вплинути на загальний, найбільш імовірний стан системи. А для газу, найбільш імовірним є такий стан при якому концентрація його молекул в будь якій частині посудини буде практично однаковою і при якому кількість молекул що рухаються в одному напрямку, практично дорівнює кількості молекул що рухаються в протилежному напрямку.
В фізику статистичні методи наукових досліджень ввів видатний англійський вчений Джеймс Максвел (1831-1879). Саме Максвел заклав основи тієї частини фізичної науки яку називають статистичною фізикою. Статистична фізика – це розділ теоретичної фізики, в якому вивчаються загальні, статистично усереднені закономірності тих систем які складаються з величезної кількості мікрочастинок і методологічною основою якого є статистичні методи наукових досліджень.
Характерною та малоприємною особливістю статистичної фізики є широке застосування вищої математики і теорії імовірностей. Не маючи достатньо глибоких знань а ні в царині вищої математики, а ні в царині теорії імовірностей, ми утримаємось від спроб теоретично дослідити статистичні закономірності поведінки молекул. Ми просто констатуємо те, що теоретично довів Максвел і що прийнято називати законом розподілу молекул за швидкостями або законом Максвела. В цьому законі стверджується: При будь якій температурі, молекули газу можуть мати різні швидкості, при цьому характер розподілу цих швидкостей описується формулою
?N = ?v4?N(m0/2?kT)3/2e(-mvv/2kT)v2 .
Ясно, що дану формулу нема сенсу а ні поглиблено аналізувати, а ні запам’ятовувати. Ви просто маєте знати, що така формула існує і що вона математично складна. Втім, не з’ясовуючи подробиць фізичної суті формули Максвела зауважимо, що результатом її застосування є графік, який називається кривою нормального розподілу молекул за швидкостями або кривою Максвела. Загальний вигляд цієї кривої представлено на
мал.14

Мал.14 Загальний вигляд кривої нормального розподілу молекул за швидкостями (кривої Максвела).
Фізичний зміст кривої Максвела полягає в наступному. Якщо в заданому масштабі, площа тієї фігури що обмежена кривою Максвела і віссю швидкостей, дорівнює загальній кількості молекул наявного газу (N), то площа тієї фігури яка обмежена вертикаллю ?v та відповідним фрагментом кривої Максвела, дорівнює числу тих молекул (?N), швидкості яких знаходиться в інтервалі ?v.
Відразу ж зауважимо, що нема сенсу говорити про число молекул, швидкість яких в точності дорівнює 328,0000000000м/с. Можливо, що в даний момент часу, саме з такою швидкістю не рухається жодна молекула. Якщо і є сенс говорити про кількість молекул що рухаються з швидкістю v, то тільки в розумінні того числа молекул, швидкість яких знаходиться в межах певного інтервалу наближених до v швидкостей. Наприклад, швидкостей з інтервалу від 0 до 10м/с; від 290 до 295м/с; від 501 до 502м/с і т.д.
Теоретичні дослідження Максвела вказували на те, що серед всього різноманіття швидкостей, можна виділити три характерні швидкості:
1) найбільш імовірна швидкість молекул (vi), тобто та швидкість яку має найбільша кількість молекул і яка відповідає піку кривої Максвела;
2) середня арифметична швидкість молекул: vap=(v1+v2+…+vn)/n
3) середня квадратична швидкість молекул: vкв=[(v12+v22+…+vn2)/n]1/2 .
При цьому, за розрахунками Максвела ці швидкості, мають визначатись за формулами:
vi = (2kT/m0)1/2 ? 1,41(kT/m0)1/2 ;
vap = (8kT/?m0)1/2 ? 1,60(kT/m0)1/2 ;
vкв = (3kT/m0)1/2 ? 1,73(kT/m0)1/2 .
Не важко бачити, що параметри кривої Максвела та тих конкретних швидкостей які описуються цією кривою, визначальним чином залежать від двох величин: абсолютної температури речовини (Т) та мас (m0) тих молекул з яких ця речовина складається. Ілюструючи одну з цих залежностей, на мал.15 представлено чотири криві, які характеризують нормальний розподіл молекул неону (Nе) за їх швидкостями для чотирьох різних температур.
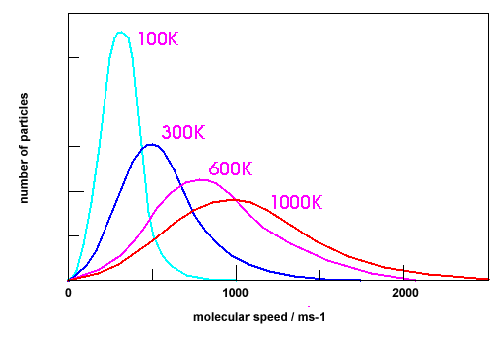
Мал.15 Криві розподілу молекул неоне (Nе) за їх швидкостями для різних температур.
Аналізуючи представлені на мал.15 криві, можна зробити декілька узагальнень. 1). Якщо кількість наявних в системі молекул є незмінною, то для будь яких значень температур, площі тих фігур які обмежені кривою Максвела та віссю швидкостей, є однаковими. 2). По мірі збільшення температури, числові значення vi , vар , vкв – збільшуються. 3). По мірі збільшення температури, відносна кількість тих молекул (?N/N) швидкості яких vi , vар , vкв – зменшується.
Потрібно зауважити, що в реальності швидкість будь якої конкретної молекули змінюється не передбачувано та випадково. Однак результатом величезної кількості цих випадкових змін є певна закономірність яку називають статистичною. Закони, що відображають такого роду закономірності, називаються статистичними.
Загалом, за характером тих передбачень які дає той чи інший закон та за способом описання подій, фізичні закони поділяються на динамічні та статистичні. Динамічними, називають такі закони, що відображають ті закономірності природи які дозволяють зробити однозначно точні передбачення. Статистичними, називають такі закони що відображають певні статистично усереднені закономірності природи і передбачення яких мають ймовірнісний характер. Наприклад, закони ньютонівської механіка (закони Ньютона, закон всесвітнього тяжіння, закон збереження енергії, закон збереження імпульсу, закон Гука, тощо), це закони динамічні. Натомість , закон Максвела – це закон статистичний. Статистичний по перше тому, що є відображенням певних, статистично усереднених закономірностей. А по друге тому, що його передбачення мають ймовірнісний характер.
Відразу ж зауважимо, що статистичні закони не є “гіршими” чи скажімо, менш точними за закони динамічні. Адже з факту того, що закон Максвела не дозволяє точно передбачити поведінку конкретно взятої молекули, зовсім не випливає, що цей закон є не точним. Не випливає бодай тому, що закон Максвела описує не поведінку окремо взятої молекули, а загальну поведінку системи величезної кількості цих молекул. При цьому, ті передбачення які дає статистичний закон Максвела, жодним чином не є менш загальними, менш об’єктивними чи менш точними за ті, що дають закони ньютонівської механіки, або будь які інші закони фізики. Адже закон Максвела є справедливим не лише для всього об’єму газу, а й для будь якої частини цього об’єму (звичайно за умови, що число молекул в цій частині є достатньо великим). Цей закон справедливий не лише для певного сорту газу, а й для будь якого іншого сорту. Він справедливий для будь якої температури і для будь якого тиску газу. Цей закон виконується навіть в тому випадку, коли початковий стан системи як завгодно сильно відрізняється від її статистично усередненого стану. Бо яким би не був цей початковий стан, а через певний час система неминуче прийде до максвелівського розподілу швидкостей між її молекулами.
Більше того, закон Максвела справедливий не лише для газів, а й для речовин в будь якому агрегатному стані. Адже в твердих і рідких тілах молекули також рухаються хаотично. І якщо хаотичний рух молекул твердого тіла чимось і відрізняється від хаотичного руху молекул газу, то тільки тим, що відбувається в межах певного фрагменту відповідного тіла.
Максвелівський закон розподілу молекул за їх швидкостями і та крива яка описує цей розподіл, є надзвичайно важливою складовою не лише фізики, а й всієї сучасної науки. Достатньо сказати, що практично в будь якій природній багаточисельній системі, відносно випадкові події описуються статистичною кривою подібною до кривої Максвела. Це звичайно не означає, що розподіл темпераменту, зросту, тривалості життя чи, скажімо, кольору очей серед людей, описується законом Максвела. Подібний розподіл взагалі не можливо представити у вигляді певної, достовірної математичної формули. Адже якщо навіть розподіл швидкостей між молекулами описується надскладною формулою ?N = ?v4?N(m0/2?kT)3/2e(-mvv/2kT)v2 , то що можна сказати про закон розподілу тривалості життя, якщо ця тривалість залежить не від двох, а від мільярдів обставин? Але от що дивовижно. Якщо ми дійсно дослідимо розподіл тривалості життя серед багатьох мільйонів людей і результати цих досліджень представимо у вигляді відповідної узагальнюючої статистичної кривої, то неодмінно з’ясується, що ця крива буде схожою на криву Максвела.
Контрольні запитання.
- Чи можна точно описати кінематичну поведінку окремої молекули газу? Чому?
- Поясніть фізичний зміст кривої Максвела.
- Яку швидкість молекул називають найбільш імовірною; середньою арифметичною; середньою квадратичною?
- Яка швидкість молекул є більшою, найбільш імовірна чи середньо квадратична? У скільки разів?
- На мал.15 зображено чотири криві Максвела для однієї і тієї ж маси газу. Який параметр цих кривих залишається незмінним?
- Чим відрізняються динамічні та статистичні закони? Чи є статистичні закони менш точними, менш загальними та менш об’єктивними?
- §10. Про деякі передбачення молекулярно-кінетичної теорії та про, те як вони перевіряються на практиці.
Напевно, найважливішою властивістю будь якої наукової теорії є її здатність робити точні, кількісні передбачення. Власне, наукова теорія стає теорією лише після того, коли її теоретичні передбачення отримують належне експериментальне підтвердження.
Які ж передбачення можна зробити на основі гіпотези про те, що всі тіла складаються з молекул які хаотично рухаються і певним чином взаємодіють між собою? Про одне з таких передбачень ми вже згадували. В 1905 році, тоді ще нікому невідомий молодий німецький фізик Альберт Ейнштейн створив теорію броунівського руху, тобто теорію яка кількісно пояснювала закономірності поведінки броунівських частинок. Пояснювала виходячи з того, що рух цих видимих частинок, це результат хаотичного руху невидимих молекул навколишнього середовища.
Ейнштейнівська теорія броунівського руху була прямим наслідком молекулярно-кінетичної теорії і мала одну, але надзвичайно важливу перевагу – її передбачення можна було відносно легко перевірити. Адже на відміну від молекул, броунівські частинки видимі і тому їх поведінку можна відносно легко проконтролювати. Тому не випадково, що вже в 1908 році французький фізик Жан Перен експериментально перевірив теорію броунівського руху і довів, що ця теорія правильна. А це означало, що молекули дійсно існують, що вони дійсно хаотично рухаються та певним чином взаємодіють між собою.
Сьогодні ми не будемо детально говорити про теорію броунівського руху, про ті передбачення які дає ця теорія та про ті експерименти що підтверджують ці передбачення. Не будемо, головним чином тому, що у нас нема а ні часу, а ні вагомої потреби, детально вивчати теорію одного конкретного явища. Ми просто констатуємо той факт, що експериментальне підтвердження ейнштейнівської теорії броунівського руху, стало першим безумовним доказом того, що молекули дійсно існують і що молекулярно-кінетична теорія є правильною.
Сьогодні ми зосередимо свою увагу на тих передбаченнях, що є прямими наслідками молекулярно-кінетичної теорії і які стосуються параметрів хаотичного руху самих молекул. От, наприклад, в молекулярно-кінетичній теорії стверджується, що температура є мірою середньої кінетичної енергії хаотичного (теплового) руху молекул і що між температурою та цією енергією існує співвідношення Т = Ек/(3/2)k , де Ек = m0v2/2 ; k=1,3810-23Дж/К. Виходячи з цього, можна зробити два очевидних передбачення.
Передбачення 1. При одній і тій же температурі (Т1=Т2) більш легкі молекули (m01 ? m02) рухаються швидше (v1 ?v2). При цьому виконується співвідношення v1/v2 = (m02/m01)1/2. Дійсно. Якщо Т1=Т2 то Ек1 = Ек2 , або m01v12/2 = m02v22/2. Звідси v1/v2 = (m02/m01)1/2 . Наприклад в повітрі, середня квадратична швидкість молекул водню (m0 = 2а.о.м.) за будь якої температури має бути в 4 рази більшою за середню квадратичну швидкість молекул кисню (m0 = 32а.о.м.): v(H2)/v(O2) = [m0(O2)/m0(H2)]1/2 = (32/2)1/2 = 4.
Передбачення 2. Середня квадратична швидкість молекул будь якої речовини визначається за формулою v=(3kT/m0)1/2. Дійсно. Оскільки m0v2/2=Ek=(3/2)kT , то
v=(3kT/m0)1/2.
Наприклад, середня квадратична швидкість молекул срібла (m0=108а.о.м. = 108·1,66·10-27кг) має становити: v(Ag)= … =583м/с.
Далі. Прямим наслідком молекулярно – кінетичної теорії є сформульований Максвелом закон розподілу молекул за їх швидкостями. В цьому законі стверджується, що при одній і тій же температурі, однакові молекули мають різні швидкості, і що розподіл цих швидкостей описується відповідною кривою Максвела. Крім цього, важливим наслідком теоретичних досліджень Максвела були формули, які дозволяли визначати певні характерні швидкості молекул, зокрема їх найімовірнішу швидкість (vi), середню арифметичну швидкість (vap) та середню квадратичну швидкість (v): vi=(2kT/m0)1/2 ; vap=(8kT/?m0)1/2 ; v=(3kT/m0) . Наприклад, для срібла з температурою 1200?С : vi=476м/с , vap=537м/с , v=583м/с.
Передбачення 3. При заданій температурі однакові молекули мають різні швидкості, характер розподілу яких описується відповідною кривою Максвела. При цьому найімовірніша (vi), середня арифметична (vap) та середня квадратична (v) швидкості молекул визначаються за формулами: vi=(2kT/m0)1/2; vap=(8kT/?m0)1/2 ; v=(3kT/m0).
Таким чином, якщо виходити з того, що тіла складаються з молекул які рухаються і певним чином взаємодіють між собою, то можна довести, що при одній і тій же температурі, молекули різних мас мають різні середні швидкості, і що величини цих мас та швидкостей зв’язані певними співвідношеннями. Що при одній і тій же температурі, швидкості однакових молекул можуть бути різними і що характер розподілу цих швидкостей, описується законом Максвела та відповідною кривою Максвела. Що найімовірніша, середня арифметична та середня квадратична швидкості, в кожному конкретному випадку мають свою, наперед визначену величину.
Тепер, коли передбачення зроблені, справа за їх експериментальною перевіркою. Першу таку перевірку здійснив в 1920 році німецький фізик Отто Штерн (1888 – 1969). Експериментальна установка Штерна (мал.16) складається з двох жорстко з’єднаних циліндрів (зовнішнього В та внутрішнього А) які мають спільну вісь обертання і в середині яких створено глибокий вакуум. Внутрішній циліндр (А) має вузьку вертикальну щілину. А вздовж осі обертання установки, натягнута дротина виготовлена з тугоплавкого металу і покрита тонким шаром відносно легкоплавкого срібла (tпл=960?С)

Мал.16 Загальна схема дослідів Штерна. ( коли система не обертається, атоми срібла потрапляють в точку 1(В), а коли обертається – в точку 2(В?).
Принцип дії приладу полягає в наступному. Через тугоплавку металеву дротину пропускають електричний струм, під дією якого вона нагрівається до 1200?С. При цьому атоми срібла інтенсивно випаровуються і розлітаються у всіх напрямках. Подавляюча більшість цих атомів осідає на внутрішній поверхні циліндру А. однак ті з них які потрапляють в щілину цього циліндру долітають до циліндру В і осідають на ньому.
Дослід Штерна проводиться в два етапи. На першому (мал.16а) – установка не обертається. При цьому, атоми срібла, пролітаючи через щілину потрапляють в точку 1(В) і осідають в ній. На другому етапі (мал.16б) -установка обертається з певною частотою (з певною кутовою швидкістю ?=2??) і тому ті атоми які пролітають через щілину, потрапляють не в точку 1(В), а в точку 2(В?). це відбувається тому, що за той час поки атоми срібла летять від внутрішнього циліндру до зовнішнього, система повертається на певний кут. Знаючи радіуси циліндрів () частоту обертання системи (?) та вимірявши відстань між точками 1 і 2 (), можна визначити швидкість польоту атомів. Дійсно.
Задача. В досліді Штерна, відстань між точками 1 і 2 становить ?s=1,6см. З якою швидкістю рухаються атоми срібла, якщо відомо, що система обертається з частотою 40об/с, а радіуси внутрішнього (r) та зовнішнього (R) циліндрів відповідно дорівнюють 5см і 20см? Визначте відносну похибку досліду, якщо відомо, що середня кінетична енергія атомів срібла відповідає температурі 1200?С.
Дано: Аналіз:
?s = 1,6см 0,016м
? = 40Гц –
r = 5см 0,05м малюнок
R = 20см 0,20м (дивись мал.16)
t = 1200?C 1473К
v =?
? =? Оскільки атоми срібла рухаються в вакуумі, то на всій ділянці руху їх швидкість залишається незмінною. Величину цієї швидкості можна визначити за формулою v = (R – r)/t , де t – той час за який атоми пролітають відстань R – r . Цей час можна визначити із наступних міркувань. Оскільки за той час поки атоми пролітають відстань R – r , точка 1 проходить шлях ?s , то швидкість цієї точки можна визначити за формулою v1=?s/t. З іншого боку, точка 1 обертається з лінійною швидкістю v1=?R=2??R. Тому 2??R=?s/t , звідси t=?s/2??R.
Таким чином, можна записати: v=(R – r)/t = (R-r)2??R/?s.
Розрахунки: v = ….= 471м/с.
Якщо виходити з того, що точка 2 це точка в яку потрапляють ті атоми срібла швидкість яких дорівнює найбільш імовірній швидкості (vi) і якщо теоретичне значення цієї найімовірнішої швидкості прийняти за точне значення швидкості атомів срібла, то відносну похибку досліду можна визначити за формулою ? =(vi-v)100%/vi , vi=(2kT/m0)1/2 ; T=1473К, vi=476м/с.
Отже: ?=(476-471)100%/476=1%
Висновок. Результати дослідів Штерна, в межах допустимої похибки, співпадають з передбаченнями молекулярно-кінетичної теорії. А це означає, що відповідна теорія є правильною.
Потрібно зауважити, що в тій частині дослідів Штерна де система оберталась, атоми срібла потрапляли не тільки в точку 2, а й певні околиці цієї точки. При цьому атоми розподілялись таким чином, що їх концентрація в тій чи іншій точці відповідала максвелівському розподілу молекул за їх швидкостями. А це означало, що при одній і тій же температурі різні атоми мають різні швидкості і що характер розподілу цих швидкостей, співпадає з передбаченнями теорії.
В подальшому, передбачення молекулярно-кінетичної теорії, і не лише ті які згадувались в даному параграфі, неодноразово провірялись та перепровірялись. При цьому кожного разу експериментальні факти доводили, що молекулярно-кінетична теорія є безумовно правильною.
Контрольні запитання.
- За виконання якої умови, наукова гіпотеза стає відповідною теорією?
- Чим теорія броунівського руху вигідно відрізнялась від молекулярно-кінетичної теорії?
- Чому експериментальне підтвердження теорії броунівського руху, автоматично стало підтвердженням молекулярно-кінетичної теорії?
- Яку будову має експериментальна установка Штерна?
- Який принцип дії цієї установки?
- Які передбачення молекулярно-кінетичної теорії підтвердили досліди Штерна?
- На мал.16 зображено розподіл атомів срібла в околицях точок В (мал.а) і В? (мал.б). Поясніть цей розподіл.
- §11. Загальні відомості про тверді, рідкі та газоподібні речовини.
Твердження про те, що певні об’єкти матеріальні, по суті означає, що ці об’єкти реально існують і так чи інакше проявляють себе, тобто є такими, факт існування факт існування яких можна довести експериментально. Іншими словами: матеріальними (матерією) називають такі об’єкти які реально існують і так чи інакше проявляють себе. Все різноманіття матеріальних об’єктів можна розділити на дві групи: речовини та поля.
Речовинами називають такі матеріальні об’єкти, які складаються з тих чи інших частинок і мають масу спокою. Речовинні об’єкти мають величезну кількість властивостей, які описуються відповідною кількістю фізичних величин. Хімічно прості речовинні об’єкти умовно розділяють на тверді, рідкі та газоподібні.
Полями називають такі матеріальні об’єкти, які не складаються з тих чи інших частинок і не мають маси спокою. Поле має лише одну властивість – здатність певним чином діяти на певні фізичні об’єкти. Скажімо, гравітаційні поля – діють на маси (тобто на ті фізичні об’єкти які мають масу), електричні поля – діють на електричні заряди, магнітні поля – діють на заряди що рухаються. Втім, поля не є предметом вивчення молекулярної фізики. Тому про параметри, властивості та прояви цих об’єктів ми поговоримо в тому розділі фізики який називається “електродинамікою”.
Коли ми стверджуємо, що лід, залізо та пінопласт – тверді, вода, ртуть та олія – рідкі, а водяний пар, повітря та вуглекислий газ – газоподібні, то це означає, що існують певні класифікаційні ознаки, керуючись якими можна чітко визначити, до якої класифікаційної групи відноситься той чи інший об’єкт. І не важко збагнути, що цими ознаками є не густина, не електропровідність, не хімічний склад, не колір, не смак і навіть не твердість чи м’якість, а об’єм (V) та форма (Ф).
Дійсно. Коли ми стверджуємо, що лід, залізо і пінопласт є твердими, то маємо на увазі факт того, що ці абсолютно різні за твердістю, густиною, електропровідністю та іншими ознаками тіла, мають певну сталу форму (Ф=const) і певний сталий об’єм (V=const). Коли ми стверджуємо, що вода, ртуть та олія рідкі, то маємо на увазі, що ці абсолютно різні речовини мають певний сталий об’єм (V=const) але не мають певної сталої форми (Ф?const). Якщо ж мова йде про газоподібні речовини, то їх визначальною ознакою є те, що вони не мають ні певного сталого об’єму, ні певної сталої форми (V?const; Ф?const). Не мають в тому сенсі, що займають увесь наданий їм об’єм і приймають форму тієї посудини в якій вони знаходяться.
Звичайно, поділ речовин на тверді, рідкі та газоподібні за класифікаційними ознаками “об’єм” і “форма” не є бездоганним. Скажімо, заперечуючи проти того, що тверді тіла мають певний об’єм і певну форму, завжди можна сказати, що об’єм і форма твердого тіла певним чином залежать від температури. Або, що під дією зовнішніх сил, тверді тіла, в тій чи іншій мірі змінюють як свій об’єм так і свою форму. Ще менш бездоганним є твердження про те, що рідини не мають певної форми. Адже за відсутності зовнішніх силових впливів, будь яка рідина набуває форму кулі. Щоправда, ті сили які прагнуть надати рідині притаманну їй кулясту форму, надзвичайно слабкими. І тому, під дією інших силових чинників, зокрема сили тяжіння, рідина приймає форму тієї посудини в якій вона знаходиться. Крім цього, особливо прискіпливі критики можуть дорікнути ще й тим, що такої фізичної величини як “форма” не існує, і що тому форму не можна вважати об’єктивним класифікаційним критерієм.
Та якими б вагомими не були недоліки вище наведеного класифікаційного поділу, а правда життя полягає в тому, що на сьогоднішній день сучасна наука нічого більш путнього запропонувати не може.
Щоправда, об’єм та форма є так би мовити зовнішніми ознаками класифікаційного поділу хімічно простих речовин на тверді, рідкі та газоподібні. Молекулярна ж фізика стоїть на тому, що в ній, загальні властивості твердих, рідких та газоподібних речовин, в тому числі і ті які визначаються наявністю чи відсутністю певної форми та об’єму, пояснюються виходячи з трьох базових тверджень:
- речовини складаються з молекул;
- молекули рухаються;
- молекули взаємодіють.
А що такі пояснення існують є очевидним.
Дійсно. Оскільки молекули рухаються, то вони мають певну енергію руху, яку прийнято називати кінетичною Ек. Оскільки молекули взаємодіють, то вони мають певну енергію взаємодії, яку прийнято називати потенціальною Еп. І не важко збагнути, що енергія взаємодії молекул прагне об’єднати ці молекули в єдине ціле. Натомість молекула руху, навпаки – прагне розірвати зв’язки між молекулами і розкидати їх.
Ясно, що в такій ситуації агрегатний стан речовини та її загальні фізичні властивості, визначальним чином залежать від того, який енергетичний (а відповідно й силовий) фактор є сильнішим. Скажімо, якщо тверді тіла мають певну сталу форму і певний сталий об’єм, то напевно це пояснюється тим, що середня потенціальна енергія молекул твердого тіла значно більша за їх середню кінетичну енергію (Еп ? Ек). Факт же того, що газоподібні речовини займають увесь наданий їм об’єм, очевидно означає, що середня потенціальна енергія молекул газоподібної речовини значно менша за їх середню кінетичну енергію (Еп ? Ек). Якщо ж мова йде про рідини, то їх молекули, з одного боку тримаються купи (V=const), а з іншого – ця купа є надзвичайно хиткою (Ф?const). І не важко збагнути, що таку ситуацію можна пояснити лише тим, що в рідинах, енергія взаємодії молекул якщо і перевищує енергію їх руху, то лише мінімально (Еп ? Ек).
Таким чином, визначаючи ті речовинні об’єкти які називаються твердими, рідкими та газоподібними, можна сказати наступне.
Твердими називають такі речовинні об’єкти, які мають певну сталу форму і певний сталий об’єм, і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію. Іншими словами, для твердих речовин: Ф=const ; V=const ; Еп ? Ек .
Рідинами називають такі речовинні об’єкти, які мають певний сталий об’єм але не мають певної сталої форми, і в яких середня, потенціальна енергія молекул мінімально більша за їх середню кінетичну енергію. Іншими словами, для рідин: Ф?const ;
V=const ; Еп ? Ек .
Газоподібними називають такі речовинні об’єкти, які не мають а ні певної сталої форми, а ні певного сталого об’єму, і в яких, середня потенціальна енергія молекул значно менша за їх середню кінетичну енергію. Іншими словами, для газоподібних речовин: Ф?const ; V?const ; Еп ? Ек .
Потрібно зауважити, що коли ми говоримо про потенціальну, а особливо про кінетичну енергію молекул, то маємо розуміти, що фактично мова йде про певні усереднені значення цих енергій. Адже сам факт хаотичного руху молекул, безумовно вказує на те, що величина кінетичної енергії будь якої з них, постійно змінюється і що цю величину можна охарактеризувати лише певним усередненим значенням. Це значення визначають за формулою Ек=m0v2/2 , де m0 – маса відповідної молекули;
v=(v12+v22+…+vn2)1/2/n – середня квадратична швидкість молекули.
Теоретичні та експериментальні дослідження показують, що середня кінетична енергія молекул речовини пропорційна абсолютній температурі (Т) цієї речовини і зв’язана з нею співвідношенням Ек=(3/2)kT, де k=1,38·10-23 Дж/К. А це означає, що вимірявши температуру речовини можна визначити величину середньої кінетичної енергії її молекул. Якщо ж говорити про величину середньої потенціальної енергії молекул речовини, то в загальному випадку визначати цю енергію ми не вміємо: Еп=?. Тому, коли ми стверджуємо, що в твердих тілах потенціальна енергія молекул значно більша за їх кінетичну енергію (Еп ? Ек), то кількісно оцінити величину цього “значно” ми не можемо. Ми можемо говорити лише про те, що механічні властивості твердого тіла, певним чином залежать від того, на скільки середня потенціальна енергія його молекул більша за їх середню кінетичну енергію. І якщо залізо міцне, то це напевно тому, що для нього Еп ?? Ек . Натомість, якщо пінопласт не міцний, то напевно тому, що для нього
Еп ? Ек .
Таким чином, співвідношення між кінетичною та потенціальною енергіями молекул, визначальним чином впливає не лише агрегатний стан речовини, а й на її механічні властивості в межах одного і того ж агрегатного стану. Скажімо, механічні властивості твердого заліза при 20?С, при 800?С і при 1400?С є суттєво різними. І ця різниця значною мірою визначається тим, що в процесі нагрівання, кінетична енергія атомів заліза неухильно збільшується, тоді як величина їх потенціальної енергії залишається практично незмінною. Ясно, що в такій ситуації співвідношення між кінетичною та потенціальною енергіями атомів певним чином змінюється, а відповідно змінюються і механічні властивості заліза. Коли ж температура заліза досягає температури плавлення (1530?С) кінетична енергія його атомів досягає такої критичної величини, при якій зв’язки між відповідними атомами починають руйнуватися і залізо з твердого стану переходить до якісно нового стану, який називається рідким.
Говорячи про те, що хімічно прості речовини поділяються на тверді рідкі та газоподібні, потрібно мати на увазі, що цей поділ є досить умовним. Умовним по перше тому, що в процесі деяких фазових переходів, наприклад в процесі плавлення або в процесі кипіння, одна і та ж речовина, за одних і тих же умов може знаходитись в двох, а іноді і трьох агрегатних станах одночасно. По друге, перебуваючи в тому чи іншому агрегатному стані, речовина може мати певні ознаки суміжних станів. Наприклад тверді тіла, поділяються на кристалічні та аморфні. При цьому аморфні тіла мають певні ознаки рідин. Настільки певні, що в деяких наукових джерелах, аморфні тіла відносять до розряду рідин. Або, наприклад, газоподібні речовини поділяються на гази та пари. При цьому пар можна розглядати як певну перехідну фазу між рідиною та власне газом. Або, скажімо, ті рідини які називаються рідкими кристалами, поєднують в собі явні ознаки рідин з певними ознаками кристалічних тіл.
Не будемо забувати і про те, що ми говоримо про певний класифікаційний поділ хімічно простих речовин. В Природі ж існують і такі надскладні речовинні об’єкти як живі організми. І ці об’єкти не є ні твердими, ні рідкими, ні газоподібними. Пам’ятаємо і про те, що Природа, це єдиний цілісний організм, в якому все взаємопов’язано та взаємообумовлено. І в цьому єдиному, цілісному організмі, будь який класифікаційний поділ є досить умовним.
Та як би там не було, а матеріальні об’єкти Природи розділяють на речовини та поля. При цьому, хімічно прості речовини поділяють на тверді, рідкі та газоподібні. Цей поділ можна представити у вигляді наступної узагальнюючої схеми.

Словник фізичних термінів.
Твердими називають такі речовинні об’єкти, які мають певну сталу форму і певний сталий об’єм, і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію. Іншими словами, для твердих речовин:
Ф=const ; V=const ; Еп ?Ек .
Рідинами називають такі речовинні об’єкти, які мають певний сталий об’єм але не мають певної сталої форми, і в яких середня, потенціальна енергія молекул мінімально більша за їх середню кінетичну енергію. Іншими словами, для рідин:
Ф?const ; V=const ; Еп ? Ек .
Газоподібними називають такі речовинні об’єкти, які не мають а ні певної сталої форми, а ні певного сталого об’єму, і в яких, середня потенціальна енергія молекул значно менша за їх середню кінетичну енергію. Іншими словами, для газоподібних речовин: Ф?const ; V?const ; Еп ? Ек .
Контрольні запитання.
- Що означає твердження: матерія – це те, що реально існує і так чи інакше проявляє себе?
- Чому густину не можна вважати тим критерієм, який дозволяє розділити речовинні об’єкти на тверді та рідкі?
- Чому ми стверджуємо, що в твердих тілах, енергія взаємодії молекул набагато більша за енергію їх руху.
- Чому ми стверджуємо, що в рідинах, енергія взаємодії молекул мінімально більша за енергію їх руху?
- Чому в процесі нагрівання, міцність заліза поступово зменшується?
- Як змінюється кінетична і потенціальна енергія молекул в процесі: а) нагрівання; б) охолодження; в) плавлення; г) пароутворення.