
Тема 2.2. Теплові явища.
§4. Про внутрішню енергію тіла. Теплообмін. Види теплообміну.
§5. Кількість теплоти. Рівняння теплового балансу.
§6. Нагрівання–охолодження. Питома теплоємність речовини.
§7. Загальні відомості про тверді тіла. Плавлення–кристалізація.
§8. Пароутворення–конденсація. Питома теплота пароутворення.
§9. Горіння–фотосинтез. Питома теплота згорання.
§10. Розв’язування задач. Тема: Закон збереження енергії в механічних і теплових процесах.
§11. Теплові двигуни.
Тема 2.2. Теплові явища.
Нагадаємо, молекулярна фізика – це розділ фізики, в якому вивчаються загальні властивості твердих, рідких і газоподібних речовин та ті теплові процеси які відбуваються з ними. З більш менш детальними основами молекулярної фізики ви ознайомитесь в десятому класі. Наразі ж, стисло поговоримо про ту частину молекулярної фізики яка пояснює теплові явища (процеси).
Теплові явища є невід’ємною складовою нашого повсякденного життя. Очевидними наслідками цих явищ є найрізноманітніші вітри, буревії, урагани, дощі, тумани, снігопади, потоки струмків, річок, океанічних течій, одним словом всього того, що прийнято називати кругообігом води та повітря в природі. Результатом тих теплових процесів які відбуваються в надрах Землі є землетруси, виверження вулканів, утворення гірських масивів, повільні переміщення материків. Результатом певних теплових процесів є робота теплових двигунів, холодильників, кондиціонерів, систем опалювання та утеплення будинків, тощо.
Якщо ж говорити про найпростіші теплові явища, то ними є нагрівання, охолодження, пароутворення, конденсація, плавлення, кристалізація, сублімація, десублімація, горіння, теплопровідність, конвекція, променевий теплообмін, тощо. Власне стислому описанню, дослідженню та поясненню цих простих явищ і присвячена дана тема. А теоретичною основою наших пояснень будуть ті знання які ви отримали в процесі вивчення механіки, та три базові твердження, які називаються основними положеннями (твердженнями) молекулярно-кінетичної теорії:
- Всі речовини складаються з молекул.
- Молекули в речовині безперервно та безладно (хаотично) рухаються.
- На невеликих відстанях (~10–9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
.
§4. Про внутрішню енергію тіла, теплообмін та види теплообміну.
Назва «внутрішня енергія тіла» вказує на те, що мова йде про ту енергію яка зосереджена всередині (внутрі) даного тіла. А оскілки будь яке тіло складається з певної кількості молекул, кожна з яких має певний запас як кінетичної (Ек=m0v2/2) так і потенціальної (Еп=?) енергії, то можна стверджувати, що внутрішня енергія тіла дорівнює загальній сумі кінетичних та потенціальних енергій всіх молекул даного тіла. Іншими словами:
Внутрішня енергія – це та енергія яка зосереджена всередині даного тіла і яка дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла.
Позначається: U
Визначальне рівняння: U = ∑Ек + ∑Еп
Одиниця вимірювання: [U] = Дж.

Мал.12. Внутрішня енергія тіла дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла.
Говорячи про внутрішню енергію тіла та про її потенціальну і кінетичну складові, потрібно пам’ятати, що мова йде про певну відносну величину значення якої залежить від рівня деталізації внутрішнього устрою тіла. Скажімо якщо виходити з того, що тіло складається з молекул, то його внутрішня енергія визначається як сума кінетичних і потенціальних енергій всіх молекул цього тіла. Якщо ж враховувати факт того, що молекули складаються з атомів, атоми – з ядра і електронів, атомні ядра – з протонів та нейтронів, то визначаючи внутрішню енергію тіла потрібно враховувати кінетичні та потенціальні енергії його атомів, атомних ядер, електронів, протонів, нейтронів, а зрештою і ту енергію згустками якої є самі протони, нейтрони та електрони.
Та як би там не було, а в молекулярній фізиці прийнято вважати, що внутрішня енергія тіла дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла, і що її визначальне рівняння U = ∑Ек + ∑Еп .
Внутрішню енергію тіла можна змінювати двома базовим способами: 1) шляхом виконання певної роботи; 2) шляхом теплообміну. Наприклад, в процесі тертя долонь одна об одну, ці долоні нагріваються. А це означає, що в процесі виконання механічної роботи, механічна енергія долонь перетворюється на їх внутрішню енергію. Або наприклад, в процесі проходження електричного струму, відповідний провідник неминуче нагрівається. А це означає, що в процесі виконання певної електричної роботи, певна частина енергії електричного струму незворотним чином перетворюється у внутрішню енергію провідника.
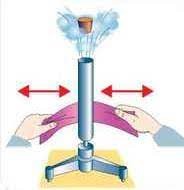
Мал.13. Внутрішню енергію тіла можна змінювати: а) шляхом виконання певної роботи; б) шляхом теплообміну.
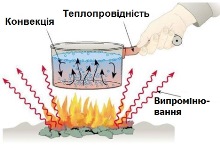
Що ж стосується теплообміну, то про нього можна сказати наступне. Теплообмін, це такий незворотній тепловий процес, при якому теплова енергія передається від більш нагрітого тіла до менш нагрітого, або від більш нагрітої частини тіла до менш нагрітої, і який не супроводжується виконанням механічної роботи. Існує три різновидності теплообміну: теплопровідність, конвекція та променевий теплообмін.

Мал.14. Розрізняють три види теплообміну: теплопровідність, конвекція та променевий теплообмін.
Теплопровідність, це такий теплообмін, при якому обмін тепловою енергією відбувається в процесі взаємодії мікрочастинок речовини і який не супроводжується переносом самої речовини. Наприклад, якщо мідний стержень нагрівати з одного краю, то ця нагрітість поступово пошириться на увесь стержень. Пошириться тому, що джерело теплової енергії змушує атоми міді коливатися інтенсивніше, а ті в свою чергу змушують інтенсивніше коливатись сусідні атоми і т.д. Ситуація нагадує таку, коли в ланцюгу пружно пов’язаних кульок, примушують коливатись одну з них, і це коливання поступово розповсюджується на увесь ланцюг. Втім, теплопровідність це надзвичайно складний процес, який лише віддалено нагадує взаємодію пружно з’єднаних кульок.
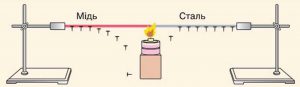
Мал.15. При теплопровідності обмін тепловою енергією відбувається в процесі взаємодії мікрочастинок речовини і не супроводжується переносом самої речовини.
Теплопровідність матеріалу оцінюють параметром який називається коефіцієнтом теплопровідності. Фізична суть та визначальне рівняння цього коефіцієнту досить складні. Тому на практиці теплопровідні властивості матеріалу, часто виражають в одиницях теплопровідності води. Наприклад, якщо в такій оцінювальній шкалі, теплопровідність алюмінію 370, а повітря 0,04, то це означає що теплопровідність алюмінію в 370 разів більша, а води в 1/0,04=25 разів менша за теплопровідність води.
Таблиця Відносні теплопровідності деяких речовин. (в одиницях теплопровідності води).
| Речовина | k | Речовина | k |
| вода | 1 | цегла | 1,05 |
| срібло | 755 | скло | 0,98 |
| мідь | 677 | папір | 0,23 |
| золото | 516 | береза | 0,27 |
| алюміній | 370 | сосна | 0,18 |
| вольфрам | 234 | пробкове дерево | 0,07 |
| залізо | 118 | вовняна тканина | 0,09 |
| лід | 3,5 | повітря | 0,04 |
| фарфор | 1,7 | вакуум | 0,0000 |
Теплопровідність, це надзвичайно складний процес, хід якого залежить від багатьох обставин: розмірів, маси та форми молекул, характеру зв’язків між ними, відстані між молекулами, наявності в речовині мікро дефектів, домішок, сторонніх включень, тощо. Скажімо висока теплопровідність металів, обумовлена рухливістю і щільністю розташування їх атомів, а також фактом того, що ці атоми постійно обмінюються колективізованими та надзвичайно рухливими електронами. Низька теплопровідність матеріалів органічного походження (деревина, папір, вовна, тощо) пояснюється фактом того, що ці матеріали мають рихлу структуру і складаються з величезних, неповоротких та переплетених макромолекул, які надзвичайно складно «розгойдати».
Якщо ж говорити про наднизьку теплопровідність повітря та інших газів, то вона пояснюється тим, що молекули газоподібних речовин знаходяться на відносно великих відстанях і тому в процесі хаотичного руху повільно передають теплову інформацію. Умовно кажучи, якщо пружні кульки знаходяться в щільному контакті та утворюють довгий ланцюг, то той ударний імпульс який ви надаєте першій кульці ланцюга, практично миттєво передається його останній кульці. Якщо ж ті ж кульки будуть розташовані на відносно великих відстанях, то передача ударного імпульсу від кульки до кульки буде відбуватись повільно. А враховуючи факт того, що реальний рух молекул – кульок є криволінійно хаотичним, не важко зрозуміти, чому в газах передача теплової енергії відбувається надзвичайно повільно.
Факт надзвичайно низької теплопровідності повітря по суті означає, що якби його нагрівання відбувалося лише за рахунок теплопровідності, то увімкнувши батарею опалення у жовтні, ми б нагріли кімнату лише у березні. Однак ви знаєте, що система опалювання нагріває повітря кімнати в сотні, а то й тисячі разів швидше. Цю швидкість нагрівання забезпечує той вид теплообміну який називається конвекцією.
Конвекція, це такий теплообмін, при якому обмін тепловою енергією відбувається в процесі перемішування різнонагрітих частин рідини або газу. Фізична суть конвекції полягає в наступному. Якщо посудину з водою поставити на полум’я, то її нижній приповерхневий шар швидко нагрівається і відповідно розширюється. А це означає, що нагріта вода під дією сили Архімеда піднімається вгору, а її місце займає більш холодна вода. При цьому гарячі і холодні шари води перемішуються, що сприяє швидкому нагріванні всієї маси рідини.
Оскільки рушійною силою конвекційного теплообміну є направлена вгору сила Архімеда, то цей теплообмін буде ефективно нагрівати рідину або газ лише в тому випадку якщо джерело енергії знаходиться в нижніх шарах відповідного середовища. Саме тому батареї системи опалювання розташовують як найнижче.
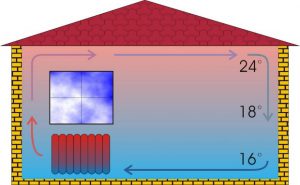
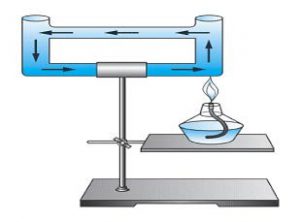
Мал.16. При конвекції обмін тепловою енергією відбувається в процесі перемішування різнонагрітих частин рідини або газу.
Конвекційний теплообмін є основним способом нагрівання великих мас рідин та газів. Результатом конвекційних процесів є не лише швидке нагрівання повітря в квартирах та шкільних приміщеннях і не тільки швидке нагрівання води в каструлях та чайниках, а й потужні вітри, потужні океанські течії, тощо.
Передача теплоти як шляхом теплопровідності так і шляхом конвекції, передбачає наявність певного речовинного середовища, яке і забезпечує відповідний теплообмін. А це означає, що ані теплопровідність, ані конвекція не можуть забезпечити передачу теплоти через безповітряний простір. При цьому виникає питання: а яким чином величезна кількість теплової енергії від Сонця передається на Землю? Відповідь на це запитання дає ще одна різновидність теплообміну яка називається променевим теплообміном.
Променевий теплообмін, це такий теплообмін, при якому тіла обмінюються тепловою енергією шляхом випромінювання та поглинання електромагнітних хвиль (фотонів електромагнітного випромінювання).
Сьогодні ми не готові до серйозної розмови про фізичну суть та спосіб розповсюдження електромагнітних хвиль. Сьогодні ми просто констатуємо той факт, що інтенсивний тепловий рух частинок речовини породжує електромагнітні хвилі, які здатні поширюватися в безповітряному просторі (вакуумі), та передавати енергію від одного тіла до іншого. Зауважимо також, що різновидностями електромагнітних хвиль є видиме світло, інфрачервоне, ультрафіолетове, рентгенівське та гама випромінювання, і що такі хвилі випромінюють практично всі нагріті тіла, будь то Сонце, батарея системи опалювання чи організм людини. Просто параметри тих електромагнітних хвиль які випромінюються різнонагрітими тілами є різними і тому відповідно різними є наші відчуття.
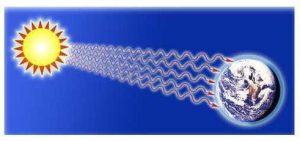
Мал.17. При променевому теплообміні тіла обмінюються енергією шляхом випромінювання та поглинання електромагнітних хвиль.
Дослідження показують, що тіла можуть поглинати, відбивати або пропускати електромагнітні хвилі. І що при поглинанні хвиль, внутрішня енергія тіла збільшується, а при відбиванні та пропусканні – залишається практично незмінною. Наприклад, якщо в потік сонячного світла внести шматок чорної тканини, дзеркало та прозоре скло, то неодмінно з’ясується, що тканина швидко та суттєво нагріється, а нагрітість дзеркала і скла залишиться практично незмінною. І це закономірно. Адже чорна тканина тому і чорна, що практично повністю поглинає енергію того видимого світла що на неї потрапляє. Якщо ж говорити про дзеркальну та прозору поверхні, то перша практично повністю відбиває світло, а друга – безперешкодно пропускає його. При цьому, енергетичний результат обох процесів однаковий – тіло не поглинає світлову енергію і тому кількість його внутрішньої енергії залишається незмінною.
Увесь спектр сучасних знань про теплопровідність, конвекцію та променевий теплообмін застосовують при облаштуванні ефективних систем опалювання, ефективних теплоізоляційних систем, ефективних водо та газо нагрівних приладів, тощо. Прикладами такого застосування з сучасні термоси.
Термос, це прилад, який забезпечує ефективну теплоізоляцію тієї речовини яка в ньому знаходиться. Основним теплоізоляційним елементом термосу (мал.18) є спеціальна скляна або металева посудина. Особливість цієї посудини в тому, що вона має подвійні стінки, між якими створено безповітряний простір (вакуум). Крім цього, стінки цієї посудини є дзеркальними, тобто такими, що відбивають електромагнітні хвилі.
Принцип дії термосу очевидно простий. Той безповітряний простір що існує між подвійними стінками термосу, протидіє теплопровідному та конвекційному теплообміну з навколишнім середовищем. А дзеркальні поверхні стінок, забезпечують захист від променевих втрат.
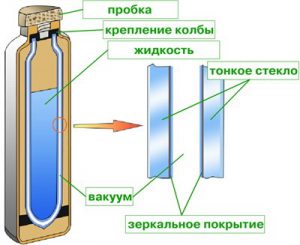
Мал.18. Загальний устрій термосу.
Контрольні запитання.
- Що називають внутрішньою енергією тіла?
- Якими шляхами можна змінювати внутрішню енергію тіла?
- Що називають теплообміном?
- Поясніть суть теплопровідності.
- Чому метали мають високу теплопровідність, а деревина – низьку?
- Чому теплопровідність газів є надзвичайно низькою?
- На прикладі системи опалювання поясніть суть конвекції.
- Яким чином енергія Сонці передається на Землю?
- Як ви думаєте, чому в потоці сонячного світла, чорні тіла нагріваються на багато сильніше аніж білі?
- Поясніть будову та принцип дії термосу.
Вправа 4.
- Два мідні бруски мають однакову температуру але різну масу. Чи однаковою буде внутрішня енергія цих брусків? Чому?
- З балону випустили частину повітря. Чи змінилась внутрішня енергія того повітря що залишилось в балоні?
- В одну склянку налили холодну воду, а в іншу – окріп. В якій склянці вода має більшу внутрішню енергію?
- Який з видів теплообміну (теплопровідність, конвекція чи випромінювання) супроводжується переносом речовини?
- Одяг якого кольору варто носити взимку?; влітку?
- Улітку лід зберігають під шаром тирси. Чому?
- Чому нагріті деталі у воді охолоджуються швидше, ніж у повітрі?
- Якщо головку сірника терти об коробку, сірник загорається. Поясніть чому?
- Поясніть чому при стисканні газу, його температура збільшується, а при розширенні – зменшується?
- Температура одного кілограму льоду і одного кілограму води однакова (0°С). Порівняйте внутрішні енергії цих тіл.
.
§5. Кількість теплоти. Рівняння теплового балансу.
В загальному випадку, теоретично визначати внутрішню енергію довільно взятого тіла ми не вміємо. Не вміємо головним чином тому, що тієї універсальної формули, яка б дозволяла визначати потенціальну енергію молекул речовини не існує (Еп = ?). А оскільки Еп = ? то U = ∑Ек + ∑Еп = ?
Однак на практиці, нас завжди цікавить не внутрішня енергія тіла, а те, на скільки вона змінюється в результаті того чи іншого теплового процесу. Іншими словами, на практиці нас цікавить не U, а ∆U.
Наприклад, нас не цікавить та загальна кількість внутрішньої енергії яка зосереджена в певній кількості води, пару, заліза чи вугілля. Нас цікавить, скільки енергії ми отримаємо при згоранні певної кількості вугілля; скільки енергії потрібно для того, щоб нагріти дану кількість води на задану кількість градусів Цельсія; скільки енергії ми отримаємо при перетворенні пару в рідину; скільки енергії потрібно для того, щоб розплавити певну кількість заліза; і т.д. Іншими словами, практичне значення має не внутрішня енергія тіла (U), а те на скільки вона змінюється в результаті того чи іншого теплового процесу. Цю зміну внутрішньої енергії тіла (∆U = Uк – Uп) називають кількістю теплоти.
Кількість теплоти – це фізична величина, яка показує на скільки джоулів змінюється внутрішня енергія тіла в результаті того чи іншого теплового процесу.
Позначається: Q
Визначальне рівняння: Q = ∆U
Одиниця вимірювання: [Q] = Дж, джоуль.
Оскільки в загальному випадку, теоретично визначати внутрішню енергію тіла ми не вміємо, то відповідно не вміємо теоретично визначати і кількість тієї теплоти що виділяється або поглинається при тому чи іншому тепловому процесі (оскільки U=?, то Q = ΔU = ?).
В подібних ситуаціях, на допомогу теорії завжди приходить експеримент. Про те як експериментальні дослідження допомагають визначати ту кількість теплоти яка виділяється чи поглинається при тому чи іншому тепловому процесі, ми поговоримо в наступних параграфах. Наразі ж зауважимо, що при всьому різноманітті тих процесів які відбуваються при теплообміні, виконується закон який називається рівнянням теплового балансу.
Рівняння теплового балансу – це закон, в якому стверджується: при теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої (енерго ізольованої) системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи. Іншими словами: ∑Qвтр = ∑Qотр.
Наприклад, якщо нагріте тіло опустити в посудину з холодною водою, то тіло втратить певну кількість теплової енергії, а вода і посудина аналогічну кількість енергії отримають. А якщо в результаті точних вимірювань з’ясується, що та загальна кількість тієї теплоти яку отримала вода і посудина дещо менша за ту кількість теплоти яку втратило нагріте тіло, то це означатиме лише те, що відповідна система є не замкнутою, і що розв’язуючи задачу ми чогось не врахували. Наприклад того, що частина енергії нагрітого тіла пішла на випаровування рідини.
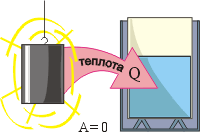
Мал.19. При теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи.
Не важко збагнути, що рівняння теплового балансу ∑Qвтр = ∑Qотр, є частковим випадком більш загального закону Природи – закону збереження енергії. Нагадаємо, в законі збереження енергії стверджується: при будь яких процесах, що відбуваються в замкнутій (енергоізольованій) системі, загальна кількість енергії цієї системи залишається незмінною, тобто зберігається. Іншими словами:∑Едо = ∑Епісля.
На відміну від закону збереження енергії який є справедливим для всього різноманіття природних явищ та для будь яких комбінацій цих явищ, рівняння теплового балансу в точності виконується лише при теплообміні, тобто такому тепловому процесі при якому обмін тепловою енергією відбувається без виконання механічної роботи. Адже якщо наприклад, в процесі нагрівання газ розширюється (мал.20б), то надана йому теплота буде витраченою не лише на нагрівання газу, а й на виконання ним певної механічної роботи (на розширення газу).
а)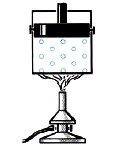 б)
б)
Мал.20. Рівняння теплового балансу в точності виконується лише при теплообміні, тобто такому тепловому процесі який відбувається без виконання механічної роботи.
Прилад за допомогою якого вимірюють кількість тієї теплоти що виділяється або поглинається в результаті того чи іншого теплового процесу називають калориметром (від лат. calor – теплота і грец. metreo – вимірюю). Сучасні калориметри мають достатньо складну будову. Однак принциповий устрій та принцип дії калориметра є досить простим і полягає в наступному.
В максимально енергоізольованій посудині (мал.21) міститься відома кількість відомої рідини, наприклад води. В цю рідину опускають об’єкт теплового дослідження. При цьому, та теплова енергія яка виділяється або поглинається цим об’єктом, передається рідині. Знаючи масу рідини (m), її теплоємність (с) і те на скільки збільшилась або зменшилась температура рідини (∆t) в процесі теплообміну, визначають величину відповідної енергії (теплоти): Q = cm∆t. Ясно, що при подібних розрахунках потрібно враховувати і ту енергію яку отримують або віддають інші елементи системи, зокрема тіло калориметра, термометр, тощо.
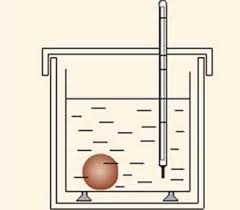
Мал.21. Схема загального устрою калориметра.
Говорячи про внутрішню енергію тіла загалом (U = ∑Ек+∑Еп) та про кількість наявної в ньому потенціальної енергії (∑Еп) зокрема, потрібно мати на увазі, що складність потенціальної енергії полягає не лише у відсутності тієї універсальної формули за якою ця енергія визначається, а й у прихованості проявів цієї енергії. При цьому часто буває так, що за одних обставин потенціальна енергія жодним чином не проявляє себе, а за інших – виникаючи ніби нізвідки, ця енергія стає очевидно наявною.
Наприклад пояснюючи загальні властивості твердих, рідких і газоподібних тіл, та виходячи з того, що енергія взаємодії молекул прагне об’єднати ці молекули в єдине ціле, а енергія руху прагне розірвати зв’язки між молекулами і розкидати їх, ми зробили висновок про те, що в твердих тілах потенціальна енергія молекул значно більша за їх середню кінетичну енергію Еп > Ек, а в газоподібних тілах – навпаки Еп < Ек.
На перший погляд даний висновок є очевидно правильним. Однак не будемо поспішати. Адже якщо мова йде про потенціальну енергію, то відносно неї навіть очевидно правильні висновки можуть виявитися хибними і навпаки. Ілюструючи дане твердження розв’яжемо наступну задачу.
Задача 1. Лід, вода і водяний пар мають температуру 0ºС. В якому з цих станів потенціальна енергія молекул Н2О є найбільшою, а в якому найменшою?
. 0ºС 0ºС 0ºС
Рішення. Оскільки температура льоду, води і пару однакова (tл = tв = tп = 0ºС), то загальна кінетична енергія молекул Н2О в льоді, воді і пару, є однаковою ∑Екл = ∑Екв = ∑Екп. З іншого боку, для того щоб при температурі 0ºС лід перетворився на воду, необхідно до наявної в ньому внутрішньої енергії (Uл = ∑Ек + ∑Еп) додати ту енергію яка йде на плавлення льоду Qпл. А це означає, що у відповідності з законом збереження енергії, внутрішня енергія води Uв більша за внутрішню енергію льоду Uв = Uл + Qпл, і тому загальна потенціальна енергія молекул води більша за загальну потенціальну енергію молекул льоду: ∑Епв > ∑Епл.
Аналогічним чином можна стверджувати. Для того, щоб при температурі 0°С воду перетворити на пар, до наявної у воді внутрішньої енергії, потрібно додати ту енергію яка йде на пароутворення Qпар. А це означає, що у відповідності з законом збереження енергії, внутрішня енергія пару Uп більша за внутрішню енергію води Uп = Uв + Qпар, і тому, загальна потенціальна енергія молекул пару більша за загальну потенціальну енергію молекул води: ∑Епп > ∑Епв.
Відповідь: при температурі 0ºС потенціальна енергія молекул пару є найбільшою, а молекул льоду – найменшою: Епл < Епв < Епп.
Загальний висновок. Об’єктивно оцінюючи величину потенціальної енергії молекул, потрібно керуватися не логікою суб’єктивних міркувань, а законом збереження енергії. А це означає, що відповідаючи на запитання «в якому стані системи, енергії більше?», потрібно запитати «а що треба зробити (добавити енергію чи відібрати її), щоб перейти від одного стану системи до іншого?».
Таким чином, говорячи про потенціальну енергію молекул, потрібно мати на увазі, що ця енергія є відносною величиною. Наприклад, коли ми стверджуємо, що потенціальна енергія молекул газу є мізерно малою, то це зовсім не означає що вона дійсно мізерно мала. Більше того, це навіть не означає, що потенціальна енергія молекул газу дійсно менша за їх кінетичну енергію.
Твердження про те, що потенціальна енергія молекул газу є мізерно малою, означає лише те, що на рівні тих процесів які відбуваються в газі, вплив потенціальної енергії молекул на ці процеси є несуттєвим. Несуттєвим тому, що левова частина потенціальної енергії молекул газу прихована на рівні внутрішньо молекулярних взаємодій які на рівні міжмолекулярних взаємодій практично не проявляє себе.
Ситуація нагадує таку, коли перебуваючи на рівні третього поверху, ви проводите експерименти з тими пружними кульками які рухаються гладенькою підлогою цього поверху. Аналізуючи кінематичну поведінку кульок, ви робите висновок, що ця поведінка не залежить від факту того, що відносно рівнів першого та другого поверхів, кожна кулька має певний запас потенціальної енергії.
Та от в підлозі з’являється отвір, потрапляючи в який кульки опиняються на рівні підлоги другого поверху. При цьому неминуче з’ясовується, що та прихована потенціальна енергія, яка на рівні третього поверху жодним чином не проявляла себе, на рівні другого поверху, перетворюється на відповідну кількість кінетичної енергії та відповідним чином впливає на кінематичну поведінку кульок.

Мал.22. Потенціальна енергія є відносною величиною.
Зважаючи на вище сказане, не дивуйтесь тому, що в процесі конденсації виділяється величезна кількість теплової енергії. Просто в процесі конденсації молекули речовини «падають» з більш високого енергетичного рівня (поверху) на більш низький. При цьому та прихована потенціальна енергія яка на рівні поверху «газ» практично не проявляла себе, на рівні більш низького поверху «рідина» перетворюється на відповідну кількість кінетичної енергії (теплоти).
Задача 2. Для того щоб при температурі плавлення розплавити 1кг льоду потрібно 3,35·105Дж енергії. На скільки при цьому збільшується загальна потенціальна енергія молекул води? На скільки збільшується потенціальна енергія однієї молекули Н2О, якщо в 18г води міститься 6,02·1023 молекул?
Дано:
m = 1кг
t = const
Qпл = 3,35·105Дж
m1 = 18г = 0,018кг
N1 = 6,02·1023 молекул
∑Еп = ? Еп1 = ?
Рішення. Оскільки в процесі плавлення температура речовини залишається незмінною, то кінетична енергія її молекул теж не змінюється. А це означає, що вся надана речовині теплова енергія Qпл повністю йде на збільшення потенціальної енергії її молекул. Іншими словами ∑Еп = Qпл = 3,35·105Дж.
Якщо потенціальна енергія N молекул збільшилася на ∑Еп = 3,35·105Дж, то енергія однієї молекули збільшується на Еп1 = ∑Еп/N, де N – кількість молекул в 1кг води. А оскільки в 18г води 6,02·1023 молекул, то в 1000г цих молекул буде N = (m/m1)N1 = 1000г/18г)∙ 6,02·1023 = 335·1023молекул.
Таким чином Еп1 = ∑Еп/N = 3,35·105Дж/335·1023 = 3,35·105Дж/3,35·1021 = 1∙105–21 = 1∙10–16Дж.
Відповідь: ∑Еп = 3,35·105Дж; Еп1 = 1∙10–16Дж.
Контрольні запитання.
- Чому ми не вміємо теоретично визначати величину внутрішньої енергії тіла?
- Чому практичне значення має не внутрішня енергія тіла, а те наскільки вона змінюється в результаті того чи іншого теплового процесу?
- Що називають кількістю теплоти?
- Чи можна теоретично визначити кількість тієї теплоти, що виділяється або поглинається при тому чи іншому тепловому процесі? Чому?
- Що стверджується в рівнянні теплового балансу?
- Що стверджується в законі збереження енергії?
- Який закон, рівняння теплового балансу чи закон збереження енергії є більш загальним? Чому?
- Поясніть загальний устрій та принцип дії калориметра.
- В чому проявляється відносність потенціальної енергії молекул?
Вправа 5.
- В одну склянку налито холодну воду, а в другу – стільки ж гарячої води. Чи однакова внутрішня енергія води в цих склянках?
- В одній посудині знаходиться вода, у другій – лід. Маси води і льоду однакові. Вода чи лід має більший запас внутрішньої енергії? Чому?
- Як і чому змінюється внутрішня енергія продуктів покладених до холодильника?
- Як і чому змінюється внутрішня енергія газу при його: а) стисненні; б) розширенні?
- Кусок цукру розтерли на порошок. Чи змінилась при цьому внутрішня енергія цукру? Чому?
- Чому після шторму вода у морі стає теплішою?
- Для того щоб при температурі кипіння випарувати 1кг води потрібно 2,26·106Дж енергії. На скільки при цьому збільшується загальна потенціальна енергія молекул води?
- Для того щоб при температурі кипіння випарувати 1кг води потрібно 2,26·106Дж енергії. На скільки при цьому збільшується потенціальна енергія однієї молекули Н2О, якщо в 18г води міститься 6,02·1023 молекул?
- Для того щоб при температурі плавлення розплавити 1кг алюмінію потрібно 3,8·105Дж енергії. На скільки при цьому збільшується загальна потенціальна енергія молекул та однієї молекули Аℓ, якщо в 27г алюмінію міститься 6,02·1023 молекул?
.
§6. Нагрівання – охолодження. Питома теплоємність речовини.
До числа найпоширеніших теплових явищ відносяться нагрівання та охолодження. Характеризуючи процес нагрівання, можна сказати наступне:
- Нагрівання відбувається з поглинанням енергії (теплоти). А це означає, що в процесі нагрівання внутрішня енергія відповідної речовини збільшується (Qн→U↑);
- Нагрівання супроводжується підвищенням температури речовини. А це означає, що в процесі нагрівання відповідно збільшується середня кінетична енергія молекул речовини (якщо Т↑, то Ек↑);
- Нагрівання не супроводжується зміною агрегатного стану речовини. А це означає, що в процесі нагрівання, величина тієї потенціальної енергії яка характеризує міжмолекулярні взаємодії на енергетичному рівні наявного агрегатного стану залишається практично незмінною (Еп ≈ const).
Узагальнюючи вище сказане можна дати наступне визначення. Нагрівання, це такий тепловий процес який відбувається з поглинанням енергії, супроводжується підвищенням температури речовини і не супроводжується зміною її агрегатного стану. При нагріванні, надана речовині теплова енергія йде на збільшення кінетичної енергії її молекул (Qн → Eк↑), при цьому потенціальна енергія цих молекул залишається практично незмінною (Еп ≈ const).
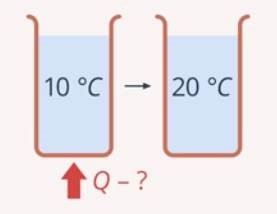
Мал.23. Нагрівання: 1) теплота поглинається; 2) температура збільшується; 3) агрегатний стан не змінюється.
Оскільки процес охолодження відбувається з виділенням енергії, супроводжується зниженням температури речовини і не супроводжується зміною її агрегатного стану, то можна дати наступне визначення. Охолодження, це такий тепловий процес, який відбувається з виділенням енергії, супроводжується зниженням температури речовини і не супроводжується зміною її агрегатного стану. При охолодженні, виділення енергії відбувається за рахунок зменшення кінетичної енергії молекул речовини (Qох ← Eк↓), при цьому потенціальна енергія цих молекул залишається практично незмінною (Еп ≈ const).
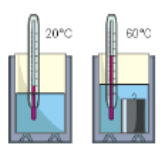
Очевидно, що кількість тієї теплоти яку потрібно витратити на те, щоб певне тіло нагріти на певну кількість градусів Цельсія, залежить від: 1) маси тіла (m); 2) різниці між початковою та кінцевою температурами тіла (Δt); 3) теплових властивостей самого тіла. Цю залежність можна записати у вигляді Qн = с∙m∙∆t, де с – питома теплоємність речовини.
Питома теплоємність речовини – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб один кілограм відповідної речовини нагріти на один градус Цельсія.
Позначається: с
Визначальне рівняння: с = Qн/m∆t
Одиниця вимірювання: [с] = Дж/кг·°C, джоуль на кілограм-градус Цельсію.
Питому теплоємність речовини визначають експериментально і записують у відповідну таблицю. Наприклад таку.
Питомі теплоємності деяких речовин.
| Речовина | с (Дж/кг°С) | Речовина | с (Дж/кг°С) |
| Тверді речовини | |||
| алюміній | 880 | платина | 125 |
| залізо, сталь | 460 | свинець | 120 |
| золото | 125 | срібло | 250 |
| лід | 2090 | скло | 840 |
| мідь, латунь | 380 | цегла | 750 |
| оливо | 250 | цинк | 400 |
| пісок | 970 | чавун | 550 |
| Рідини | |||
| вода | 4187 | ртуть | 130 |
| гас | 2140 | спирт | 2430 |
| залізо | 830 | нафта | 2100 |
| Гази ( р = const ) | |||
| азот | 1000 | гелій | 5200 |
| аміак | 2100 | кисень | 920 |
| водень | 14300 | повітря | 1000 |
| водяний пар | 2200 | вуглекислий газ | 830 |
Дослідження показують, що величина тієї кількості теплоти яку отримує тіло при його нагріванні (Qн), в точності дорівнює тій кількості теплоти яку воно віддає при аналогічному охолодженні Qох = Qн = сm∆t. Втім, потрібно мати на увазі, що мова йде про взаємно протилежні процеси, які характеризуються протилежними знаками. Адже при нагріванні різниця між кінцевою і початковою температурами речовини (∆t = tк – tп) має знак «+», а при охолодженні – знак «–». Тому на практиці визначаючи ту кількість теплоти яка виділяється або поглинається при нагріванні – охолодженні, та застосовуючи універсальну формулу Qох = Qн = сm∆t, величину ∆t завжди визначають як різницю між більшим значенням температури t2 та її меншим значенням t1.
Не важко бачити, що серед всього різноманіття речовин, питома теплоємність води (с = 4187Дж/кг°С) є практично найбільшою. Даний факт має надзвичайно важливе клімат утворююче значення. Це значення полягає в наступному. Питома теплоємність твердої поверхні Землі, приблизно в чотири рази менша за питому теплоємність води. Крім цього сонячне світло не здатне проникати в надра непрозорих поверхонь. В такій ситуації поверхневий шар континентальної землі, швидко нагрівається вдень і відповідно швидко охолоджується вночі. А це означає, що тверда поверхня Землі сприяє так званому різко континентальному клімату, який характеризується великими перепадами денних і нічних, зимових і літніх температур.
Натомість вода має велику питому теплоємність. Крім цього, сонячне світло глибоко проникає в товщу води, та сприяє нагріванню її величезних мас. В такій ситуації води світового океану виконують роль надпотужного теплового акумулятора, який робить клімат Землі більш м’яким та більш придатним для життя.
Нагріваючись вдень, вода акумулює в собі величезну кількість теплової енергії, яку віддає вночі. Потужні океанічні течії, нагріту в екваторіальних частинах планети воду, переносять в холодні частини планети та роблять їх більш теплими. Натомість холодні води приполярних областей переміщуються в жаркі екваторіальні області та робить їх менш жаркими.
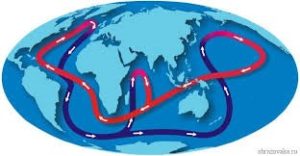
Мал.24. Потужні океанічні течії, завдяки великі теплоємності води, значною мірою пом’якшують клімат на Землі.
Наочним прикладом клімат утворюючої ролі води є невеликі місцеві вітри, які називаються бризами. Бриз (фр. brise – легкий вітер) – місцеві вітри невеликої інтенсивності, які спостерігаються на узбережжях морів та інших великих водойм, і які мають добову періодичність.
Пояснюючи причини появи та періодичності бризів, можна сказати наступне. Вдень повітря над сушею відносно швидко нагрівається і піднімається вгору, а йому на зміну приходить більш холодне повітря з моря. При цьому починає дути денний (морський) бриз, приповерхневий напрям якого з моря на сушу і який знижує денну температуру повітря на узбережжі. Після заходу сонця суша охолоджується швидше ніж вода. При цьому починає дути нічний (береговий) бриз, приповерхневий напрям якого з суші на море і який підвищує нічну температуру узбережжя.
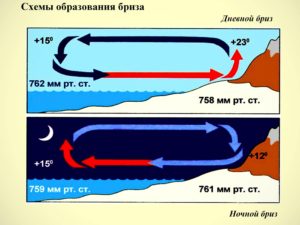
Мал.25. Висока теплоємність води та відносно низька теплоємність суходолу, сприяють утворенню бризів.
Задача 1. Яка маса залізної деталі, якщо на її нагрівання від 20°С до 120°С витратили 17кДж теплоти?
Дано:
залізо
t1 =20°C
t2 =120°C
Qн =17кДж = 17000Дж
m = ?
Рішення. Оскільки Qн = сm∆t, то m = Qн/cΔt, де с=460Дж/кг°С (таблична величина).
Розрахунки: m = 17000Дж / 460(Дж/кг°С)100°С = 0,37кг.
Відповідь: m=0,37кг.
Задача 2. Для нагрівання металу масою 100г на 20°С, потрібно 920Дж енергії. Визначіть питому теплоємність металу. Який це метал?
Дано:
m = 100г = 0,1кг
Δt = 20°C
Qн = 920Дж
с = ?
Рішення. Оскільки Qн = сm∆t, то с = Qн/m∆t = 920Дж/0,1кг∙20°С = 460Дж/кг∙°С
Оскільки кожен метал характеризується своєю теплоємністю, величина якої записується у відповідну таблицю, то за цією таблицею можна визначити не лише теплоємність відомого металу, а й навпаки – за відомою теплоємністю, визначити назву металу. В нашому випадку (с = 460Дж/кг∙°С цим металом є сталь (залізо).
Задача 3. В результаті охолодження мідного паяльника до температури 20ºС виділилося 30,4кДж енергії. До якої температури було нагріто паяльник, якщо його маса 200г?
Дано:
мідь
t1 = 20ºС
Q = 30,4кДж = 30400Дж
m = 200г = 0,2кг
t2 = ?
Рішення. Оскільки Qох = сm∆t, то ∆t=Qн/cm, де с=380Дж/кг°С (таблична величина). ∆t = 30400Дж / 380(Дж/кг·ºС)0,2кг = 400ºС.
Оскільки ∆t = t2 – t1, то t2 = t1 + ∆t =20ºC+400ºC= 420ºС.
Відповідь: t2 = 420ºС.
Задача 4. Ударна частина молота масою 5т вільно падає з висоти 2,5м на залізну деталь масою 50кг, скільки ударів зробив молот, якщо деталь нагрілася на 40ºС? На нагрівання деталі витрачається 30% енергії молота.
Загальні зауваження. Нагадаємо, рішення тих задач в яких фігурує параметр ККД, практично завжди починається з визначального рівняння цієї величини, тобто з формули η = Акор/Азаг. При цьому в подальшому, на основі аналізу умов конкретної задачі визначаються з тим, яка робота є корисною Акор=.., а яка загальною (затраченою) Азаг=… Результати цього аналізу записують у формулу η = Акор/Азаг, з якої і визначають потрібну величину.
Дано:
m1 = 5 = 5·103кг
h1 = 2,5м
m2 = 50кг
∆t2 = 40ºC
η = 30% = 0,3
n = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною роботою є та енергія яка йде на нагрівання деталі, тобто Акор = Qн = с2m2∆t2, де с2 = 460Дж/кгºС. Загальною роботою є помножена на кількість ударів потенціальна енергія піднятого молота, тобто Азаг = n∙m1gh1, де g = 10м/с2. Таким чином η = с2m2∆t2 / nm1gh1, звідси n = с2m2∆t2 / ηm1gh1.
Розрахунки: n = 460·50·40 / 0,3·5·103·10·2,5 = 46·4/3·2,5 = 25 ударів.
[n] = [(Дж/кгºС)∙кг∙°С] / [(кг∙(м/с2)∙м] = Дж / Дж = – (удари).
Відповідь: n = 25 ударів.
Контрольні запитання.
- Що можна сказати про процес нагрівання речовини?
- Що можна сказати про процес охолодження речовини?
- Від чого залежить та кількість теплоти яка виділяється в процесі охолодження?
- Що називають питомою теплоємністю речовини?
- Як визначають питому теплоємність речовини?
- Відомо, що питома теплоємність води 4200Дж/кг°С. Що це означає?
- Звідки береться та енергія яка виділяється в процесі охолодження тіла?
- Поясніть механізм утворення бризів.
- Коли вітрильним судам зручніше заходити до гавані – вдень чи вночі? Чому?
Вправа 6.
- Перед гарячою штамповкою латунну болванку масою 15кг нагріли від 15°С до 750°С. Яка кількість теплоти для цього потрібна?
- Для нагрівання 110г алюмінію на 90ºС потрібно 9,1Дж енергії. Визначити питому теплоємність алюмінію.
- На скільки градусів підвищиться температура 4кг води, при наданні їй 168кДж теплоти?
- На скільки градусів нагріється кусок алюмінію масою 2кг, якщо йому передати таку ж кількість теплоти, яка йде на нагрівання 880г води від 0 до 100ºС?
- Щоб охолодити мідну деталь температура якої 100°С, її занурили у 420г води з температурою 15°С. При цьому вода нагрілась до 18°С. Визначте масу деталі.
- На нагрівання цеглини масою 4кг на 63ºС витрачено таку ж кількість теплоти, як і для нагрівання 4кг води на 13,2ºС. Визначте питому теплоємність цегли.
- На скільки нагріється шматок міді при його падінні з висоти 100, якщо на його нагрівання йде 50% наявної енергії?
- В латунний калориметр масою 128г, який містить 240г води при температурі 8,5ºС, опустили нагрітий до 100ºС металевий циліндр масою 146г. Внаслідок теплообміну встановилась температура 10ºС. Визначити питому теплоємність металу циліндра.
.
§7. Загальні відомості про тверді тіла. Плавлення – кристалізація.
Нагадаємо, твердими називають такі речовинні об’єкти (тіла), які мають певний сталий об’єм та певну сталу форму і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію, тобто: V = const; Ф = const; Еп ˃ Ек. Все різноманіття хімічно простих твердих тіл, можна розділити на дві класифікаційні групи: тіла кристалічні та тіла аморфні. Наприклад лід – тіло кристалічне, а скло – аморфне.
Кристалічними називають такі тверді речовини (тіла), атоми і молекули яких розташовані в певному періодичному порядку, який називається кристалічною структурою речовини. Переважна більшість хімічно простих твердих речовин є кристалічними. Кристалічні всі метали, всі солі, всі луги та майже всі ті речовини які називаються мінералами, коштовним та не коштовним камінням, тощо. Кристалічним є лід, цукор, алмаз, граніт, графіт, пісок та безліч інших вам відомих і невідомих твердих речовин.
Упорядкована періодичність в розташуванні частинок, це визначальна ознака будь якої кристалічної речовини. Але як на практиці визначити, існує ця періодичність чи ні? Чи нема інших, більш явних ознак кристалічності тієї чи іншої речовини? А такі ознаки дійсно існують. Головна з них полягає в тому, що кристалічні тіла мають певну температуру плавлення, тобто таку температуру при якій відбувається перехід речовини від безумовно твердого стану до безумовно рідкого, і яка в процесі цього переходу залишається незмінною.

Мал.26. В процесі плавлення температура речовини залишається незмінною.
Наприклад, температура плавлення льоду (кристалічної води) 0ºС. Це означає, що при температурі меншій за 0ºС, вода знаходиться в безумовно твердому стані, а при температурі більшій за 0ºС – в безумовно рідкому. Що ж стосується стану води при температурі 0ºС, то його можна охарактеризувати як стан теплової рівноваги між твердою та рідкою фазами води. Це означає, що при цій температурі вода може бути як твердою так і рідкою, і що в залежності від того отримує вона енергію чи втрачає, вода або плавиться або кристалізується.
Плавлення, це такий тепловий процес який відбувається з поглинанням енергії, супроводжується переходом речовини з твердого (кристалічного) стану в рідкий і не супроводжується зміною температури речовини. При плавленні, надана речовині теплова енергія йде на збільшення потенціальної енергії її молекул (Qпл → Eп↑), при цьому кінетична енергія цих молекул залишається незмінною (Ек = const).
Зворотний до плавлення процес, тобто процес переходу речовини з рідкого стану в твердий кристалічний стан, називається кристалізацією. Кристалізація однієї і тієї ж речовини відбувається при тій же температурі що і її плавлення (температурі плавлення), але за умови, що речовина втрачає енергію (енергія виділяється).
Кристалізація, це такий тепловий процес який відбувається з виділенням енергії, супроводжується переходом речовини з рідкого стану в твердий (кристалічний) і не супроводжується зміною температури речовини. При кристалізації виділення енергії відбувається за рахунок зменшення потенціальної енергії молекул речовини (Qкр ← Eп↓), при цьому кінетична енергія цих молекул залишається незмінною (Ек = const).
Те, що кристалічні тіла мають певну температуру плавлення, і що в процесі плавлення ця температура залишається незмінною, є цілком закономірним результатом того внутрішнього порядку який існує в цих тілах. Дійсно. В процесі нагрівання, середня кінетична енергія молекул речовини неухильно зростає. Коли ж величина цієї енергії, стає співрозмірною з величиною тієї потенціальної енергії яка утримує молекули в вузлах кристалічної структури, зв’язки між молекулами починають руйнуватись. А оскільки в кристалі молекули розташовані в певному порядку, то і руйнація відповідної кристалічної структури відбувається упорядковано-послідовно. Спочатку в рідину перетворюється зовнішній шар кристалу, потім – наступний, наступний і т.д. Аналогічним чином відбувається і процес кристалізації: упорядковано-послідовно, шар за шаром, частинки речовини об’єднується у відповідну кристалічну структуру.
Не важко збагнути, що кількість тієї теплоти яку потрібно витратити на те щоб при певній постійній температурі (температурі плавлення) розплавити певне тіло, залежить від: 1) маси тіла (m); 2) теплових властивостей тіла. Цю залежність можна записати у вигляді Qпл = λm, де λ – питома теплота плавлення. При цьому дослідження показують, що величина тієї кількості теплоти яку отримує тіло при його плавлені (Qпл), в точності дорівнює тій кількості теплоти яку воно віддає при кристалізації Qкр = Qпл = λm.
Питома теплота плавлення – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб розплавити один кілограм відповідної речовини, за умови що вона вже знаходиться при температурі плавлення.
Позначається: λ, (лямбда)
Визначальне рівняння: λ = Qпл/m
Одиниця вимірювання: [λ] = Дж/кг, джоуль на кілограм.
Питому теплоту плавлення визначають експериментально і записують у відповідну таблицю. Наприклад таку.
Температура плавлення та питома теплота плавлення деяких речовин.
| Речовина | tпл (ºC) | λ (Дж/кг) | Речовина | tпл (ºC) | λ(Дж/кг) |
| алюміній | 659 | 3,8·105 | олово | 232 | 0,58·105 |
| вода, лід | 0 | 3,35·105 | ртуть | –39 | 0,13·105 |
| вольфрам | 3422 | 0,26·105 | свинець | 327 | 0,25·105 |
| залізо | 1530 | 2,5·105 | срібло | 960 | 0,88·105 |
| золото | 1063 | 0,66·105 | спирт | –98 | 1,05·105 |
| мідь | 1083 | 1,8·105 | кисень | –218 | 1,38·105 |
Оцінюючи величину тієї кількості енергії яку необхідно витратити на те, щоб 1кг льоду що вже знаходиться при температурі 0ºС перетворити на воду аналогічної температури і яка дорівнює 335000Дж, достатньо сказати, що кінетична енергія смертельної для людини кулі не перевищує 300Дж.
Розмова про тверді тіла буде неповною, якщо не згадати про ті з них, які називають аморфними. Аморфними називають такі тверді речовини (Еп ˃ Ек; V = const; Ф = const), структурні одиниці яких розташовані без певного, періодично повторюваного порядку. Основна наочна відмінність аморфних та кристалічних тіл полягає в тому, що для аморфних тіл не існує тієї чітко визначеної температурної межі, яка розділяє їх тверду та рідку фази.
Наприклад, якщо взяти звичайне скло і поступово нагрівати його, то починаючи приблизно з 400ºС скло почне поступово розм’ягчуватися та перетворюватися на все менш і менш в’язку рідину. При цьому ніхто не зможе з впевненістю сказати, на якому етапі нагрівання, скло перестало бути твердим і стало рідким. Не зможе тому, що аморфні тіла не мають певної температури плавлення. Аморфні тіла не плавляться, а розм’ягчуються, не кристалізуються, а тверднуть.
Про те, що зазвичай тверде і крихке скло може бути м’яким, пластичним і несхожим ні на тверде ні на рідке, добре знають майстри склодуви, які з цього самого ні твердого ні рідкого скла виготовляють як побутові так і мистецькі вироби.

Мал.27. В певному, достатньо широкому інтервалі температур, скло є ні твердим ні рідким, одним словом – аморфним.
Аморфні тіла не є такими багаточисельними як тіла кристалічні. До числа аморфних, відносять різноманітні види скла, різноманітні смоли, різноманітні полімерні матеріали, бурштин, каніфоль, сургуч, цукровий льодяник.
Варто зауважити, що одна і та ж хімічна речовина може бути як кристалічною так і аморфною. Наприклад кварцовий пісок і кварцове скло, це кристалічна і аморфна різновидності однієї і тієї ж хімічної речовини – кварцу (SiO2). При цьому і в кристалічному кварці (SiO2) і в аморфному кварцовому склі (SiO2) кожен атом кремнію зв’язаний з чотирма атомами кисню, а кожен атом кисню – з двома атомами кремнію. Різниця лише в тому, що в кристалічному кварці, ці атоми розташовані з певною, строго визначеною періодичністю (мал.28а), а в аморфному кварцовому склі, така періодичність відсутня (мал.28б). Тому, характеризуючи розташування частинок аморфної речовини, доречно говорити не про хаотичність цього розташування, а про відсутність певного періодичного порядку в ньому.
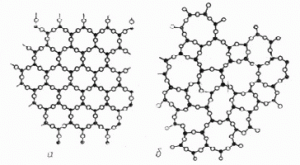
Мал.28. Схема розташування атомів кремнію (•) та атомів кисню (º) в структурі а) кристалічного кварцу, б) аморфного кварцового скла.
Те що в процесі нагрівання аморфні тіла не плавляться, а поступово розм’ягчуються, це прямий наслідок відсутності періодичного порядку в розташуванні їх частинок. Адже при неупорядкованому розташуванні частинок, ті зв’язки що існують між ними не є рівноміцними. При цьому, як найміцніші так і найслабші зв’язки хаотично розкидані по всьому об’єму аморфного тіла. Ясно, що в процесі нагрівання, спочатку руйнуються найбільш слабкі зв’язки, потім – менш слабкі і т.д. А це означає, що в процесі нагрівання, тверде аморфне тіло буде перетворюватись на відповідну рідину не при певній строго визначеній температурі, а в певному температурному інтервалі, межі якого є розмитими та досить умовними. Аморфні тіла по суті не мають ані певної температури плавлення (Тпл), ані певної теплоти плавлення (Qпл), ані певної питомої теплоти плавлення (λ).
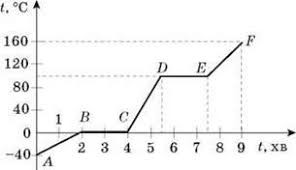
Задача 1. Опишіть ті теплові процеси які відбуваються на кожній ділянці представленого на малюнку графіку зміни температури свинцю. Як змінюється внутрішня енергія свинцю на цих ділянках?
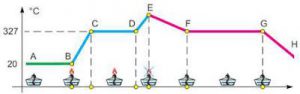
Рішення. На основі аналізу заданого графіку, можна сказати наступне.
Ділянка АВ: тіло не отримує енергію, при цьому t = 20ºC = const; U = const.
Ділянка ВС: тіло отримує енергію і нагрівається, при цьому t↑; U↑.
Ділянка СD: тіло отримує енергію і плавиться, при цьому t = 327ºС =const; U↑.
Ділянка DE: тіло отримує енергію і нагрівається, при цьому t↑; U↑.
Ділянка EF: тіло втрачає енергію і охолоджується, при цьому t↓; U↓.
Ділянка FG: тіло втрачає енергію і кристалізується, при цьому t = const; U↓.
Ділянка GH: тіло втрачає енергію і охолоджується, при цьому t↓; U↓.
Задача 2. Яка кількість теплоти потрібна для плавлення 100г олова взятого при температурі 32°С?
Загальні зауваження. Одна з особливостей задач на теплові процеси полягає в тому, що в них часто фігурує велика кількість тих величин значення яких потрібно визначати за відповідними таблицями. Скажімо в умовах нашої задачі за назвою матеріалу (олово) та за відповідними таблицями потрібно визначити температуру його плавлення, питому теплоту плавлення та питому теплоємність.
Дано:
олово
m=100г = 0,1кг
t0 = 32°C
Q = ?
Рішення. Оскільки температура плавлення олова 232°С, то ясно, що олово спочатку потрібно нагріти до температури плавлення (Qн = cmΔt), а потім власне розплавити (Qпл = λm). При цьому загальна кількість витраченої теплоти має визначатися за формулою Q = cmΔt + λm, де с = 250Дж/кг°С; λ = 0,58·105Дж/кг; Δt = t – t0 = 232°C – 32°C = 200°C.
Розрахунки: Q = 250Дж/(кг°С)·0,1кг·200°С + 58·103Дж/кг·0,1кг =
= 5000Дж + 5800Дж = 10800Дж.
Відповідь: Q = 10800Дж= 10,8кДж.
Задача 3. Мідна деталь, охолоджуючись від температури 500°С до 0°С, розтопила 200г льоду температура якого 0°С. Яка маса деталі, якщо вся енергія виділена нею при охолодженні, йде на плавлення льоду?
Дано:
мідь (1), лід (2)
Δt1 = 500°С – 0° = 500°С
m2 = 200
Qох1 = Qпл2
m1 = ?
Рішення. Оскільки та енергія яка виділяється в процесі охолодження деталі (Qох1 = c1m1Δt1, де с1 = 380Дж/кг°С), повністю йде на плавлення льоду (Qпл2 = λ2m2, де λ2 = 3,35·105Дж/кг), то можна записати c1m1Δt1 = λ2m2, звідси m1 = λ2m2 / c1Δt1.
Розрахунки: m1 = λ2m2 / c1Δt1 = 3,35·105(Дж/кг)∙0,2кг / 380(Дж/кг°С)∙500°С = 0,35кг = 350г.
Відповідь: m1 = 350г.
Контрольні запитання.
- Які речовини називаються кристалічними?
- Які речовини називають аморфними?
- За якою ознакою на практиці визначають кристалічна чи аморфна дана речовина?
- В якому агрегатному стані знаходиться речовина при температурі плавлення?
- Що можна сказати про процес плавлення?
- Що називають питомою теплотою плавлення?
- Питома теплота плавлення льоду 3,35·105Дж/кг. Що це означає?
- Що можна сказати про процес кристалізації?
- Звідки береться та енергія яка виділяється в процесі кристалізації?
- Чому аморфні тіла не плавляться, а поступово розм’ягчуються?
Вправа 7.
- Опишіть ті теплові процеси які відбуваються на кожній ділянці представленого на малюнку графіку.
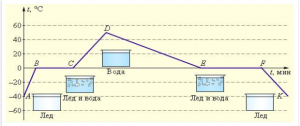
- На малюнку зображено графік зміни температури нафталіну.
а) Яка температура плавлення нафталіну?
б) Як змінюється внутрішня енергія нафталіну на ділянці ВС?
в) Порівняйте внутрішню енергію нафталіну в точках В і С.
- Яка кількість теплоти виділяється при кристалізації 5кг води, початкова температура якої 0°С?
- Яка кількість теплоти потрібна для плавлення 100г свинцю, початкова температура якого 27ºС?
- Яка кількість теплоти знадобиться для того, щоб 2кг льоду з температурою –20°С перетворити на воду з температурою 60°С?
- Для плавлення 200г певної речовини витратили 5кДж енергії. Визначте питиму теплоту плавлення цієї речовини. Яка це речовина?
- Порівняйте величину тієї енергії яка йде на плавлення 1кг льоду, з кінетичною енергією смертельної для людини кулі, маса якої 7г, а швидкість 300м/с. Зробіть висновок.
- Залізна заготовка, охолоджуючись від температури 800°С до 0°С, розтопила 1,5кг льоду температура якого 0°С. Яка маса заготовки, якщо вся енергія виділена нею, пішла на плавлення льоду?
- Для того щоб при температурі плавлення розплавити 1кг заліза потрібно 2,5·105Дж енергії. На скільки при цьому збільшується загальна потенціальна енергія молекул заліза та однієї молекули Fe, якщо в 56г заліза міститься 6,02·1023 молекул?
.
§8. Пароутворення – конденсація. Питома теплота пароутворення.
Пароутворення, це такий тепловий процес, який відбувається з поглинанням енергії та супроводжується переходом речовини з рідкого стану в газоподібний. При пароутворенні, надана речовині теплова енергія йде на збільшення потенціальної енергії її молекул (Qпар → Eп↑), при цьому, за умови незмінності тієї температури при якій відбувається пароутворення, кінетична енергія молекул залишається незмінною (Ек = const).
Зворотний до пароутворення процес, тобто процес переходу речовини з газоподібного стану в рідкий, називається конденсацією. Конденсація, це такий тепловий процес, який відбувається з виділенням енергії та супроводжується переходом речовини з газоподібного стану в рідкий. При конденсації виділення енергії відбувається за рахунок зменшення потенціальної енергії молекул речовини (Qконд ← Eп↓), при цьому кінетична енергія цих молекул залишається незмінною (Ек = const).
Можливо ви вважали, що пароутворення може відбуватися і без надання рідині певної додаткової енергії. Адже здається очевидним, що наявна в склянці вода, маючи кімнатну температуру, повільно випаровується і без її додаткового нагрівання. Втім це враження є помилковим. Помилковим бодай тому, що навіть в умовах теплової рівноваги з навколишнім середовищем, температура тієї води що випаровується завжди дещо менша за температуру цього середовища. А це означає, що навколишнє середовище постійно підігріває воду та сприяє її випаровуванню.
Розрізняють дві різновидності пароутворення: випаровування та кипіння. Випаровування, це таке пароутворення, яке відбувається при будь якій температурі рідини і при якому перехід речовини з рідкого стану в газоподібний здійснюється лише з вільної поверхні рідини. Інтенсивність випаровування залежить від сорту рідини та її температури: з підвищенням температури, інтенсивність випаровування збільшується і навпаки.
Мал.29. Інтенсивність випаровування залежить від сорту рідини та її температури.
Дослідження показують, що в процесі випаровування температура рідини знижується, а в процесі конденсації – підвищується. І це закономірно. Адже температура характеризує середню кінетичну енергію теплового руху молекул. А це означає, що при одній і тій же температурі, в будь якій речовині зустрічаються молекули, кінетична енергія яких як значно більша так і значно менша за середню величину.
Ясно, що в процесі випаровування, рідину покидають найбільш енергійні (найбільш «гарячі») молекули. При цьому загальний енергетичний рівень тих молекул які залишаються в рідині стає відповідно меншим. А отже меншою стає і температура рідини.
З іншого боку, при конденсації, ті молекули пару які «падають» в рідину, в процесі падіння отримують певну кількість додаткової енергії, а отже стають відповідно більш «гарячими». Це аналогічно тому, як підняте над землею нерухоме («холодне») тіло, в процесі падіння збільшує свою кінетичну енергію і падає на землю відповідно більш «гарячим».
Випаровування, це відносно спокійний вид пароутворення при якому утворення пару відбувається лише з вільної поверхні рідини, тобто з тієї поверхні яка контактує з навколишнім газоподібним середовищем. Однак утворення пару може відбуватись і в усьому об’ємі рідини. Це інтенсивне пароутворення називають кипінням.
Кипіння – це таке інтенсивне пароутворення, яке відбувається при певній постійній температурі (температурі кипіння) і при якому утворення пару відбувається в усьому об’ємі рідини. Візуальною ознакою кипіння є утворення наповнених паром бульбашок.
Коли ми стверджуємо, що кипіння відбувається при певній постійній температурі, то маємо на увазі, що величина цієї температури не залежить ні від тривалості процесу кипіння, ні від його інтенсивності. Скажімо, якщо ви збільшите інтенсивність того вогню що підтримує процес кипіння води, то це не призведе до підвищення температури кипіння. Просто інтенсивність процесу кипіння стане більшою.
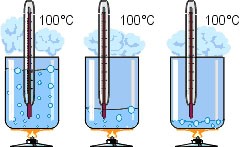
Мал.30. Температура кипіння практично не залежить ні від тривалості процесу кипіння, ні від інтенсивності цього процесу.
З іншого боку, твердження про те, що кипіння відбувається при певній постійній температурі, зовсім не означає що ця температура є абсолютно незмінною. Адже кипіння відбувається при тій температурі, при якій тиск насиченого пару рідини (тиск того пару що знаходиться всередині бульбашок) дорівнює зовнішньому тиску на її поверхню. А це означає, що зменшуючи зовнішній тиск, ми створюємо умови за яких кипіння відбувається при меншій температурі. І навпаки, збільшуючи зовнішній тиск, ми створюємо умови, за яких кипіння відбувається при більш високій температурі.
Тому, коли ми стверджуємо, що вода кипить при температурі 100ºС, то маємо на увазі, що це кипіння відбувається за нормального атмосферного тиску. Якщо ж тиск над поверхнею води змінювати, то відповідно змінюватиметься і температура її кипіння. Наприклад, під тиском 2атм вода кипить при температурі 120ºС, під тиском 20атм – при температурі 211ºС, а під тиском 0,5атм – при температурі 80ºС.
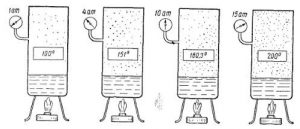
Мал.31. Температура кипіння певним чином залежить від величини зовнішнього тиску.
На практиці, кількість тієї теплоти що поглинається в процесі пароутворення (Qпар), або виділяється в процесі конденсації (Qконд), визначають за формулою: Qпар = Qконд = r∙m, де m – маса випаруваної (сконденсованої) рідини; r – питома теплота пароутворення речовини.
Питома теплота пароутворення, це фізична величина, яка характеризує теплові властивості даної речовини і яка показує, скільки енергії потрібно для того, щоб при певній постійній температурі (зазвичай температурі кипіння) випарувати один кілограм відповідної речовини.
Позначається: r
Визначальне рівняння: r = Qпар/m
Одиниця вимірювання: [r] = Дж/кг, джоуль на кілограм.
Питома теплота пароутворення кожної конкретної речовини визначається експериментально. А результати цих експериментів записуються у відповідну таблицю. Наприклад таку.
Температура кипіння та питома теплота пароутворення деяких речовин.
| Речовина | tкип (ºС) | r (Дж/кг) | Речовина | tкип (ºС) | r (Дж/кг) |
| аміак | –33,4 | 13,7·105 | ртуть | 357 | 2,85·105 |
| ацетон | 56,2 | 5,2·105 | спирт | 78 | 8,57·105 |
| бензин | 150 | 3,0·105 | фреон-12 | –29,8 | 16,8·105 |
| вода | 100 | 22,6·105 | ефір етиловий | 35 | 3,52·105 |
| залізо | 3050 | 0,6·105 |
Задача 1. На основі аналізу графіку зміни температури речовини, охарактеризуйте тепловий процес на кожній ділянці та визначте кількість спожитої речовиною теплоти на кожній та її загальну кількість. Маса речовини 500г.
Рішення. Із аналізу графіку ясно, що при t = 0°C = const відбувається плавлення речовини, а при t = 100°C = const, її кипіння. А це означає, що відповідною речовиною є вода.
На основі аналізу графіку та факту того, що маса речовини (лід, вода, пар) є відомою (m = 0,5кг), можна стверджувати.
Ділянка АВ: відбувається нагрівання льоду, при цьому QAB = cmΔt, де c = 2090Дж/кг°С, Δt = 40°С, отже QAB = 2090(Дж/кг°С)∙0,5кг∙40°С = 41800Дж = 41,8кДж.
Ділянка ВС: відбувається плавлення льоду, при цьому QBС = λm, де λ = 3,35∙105 Дж/кг, отже QBС = 3,35∙105(Дж/кг)∙0,5кг = 1,675∙105Дж = 167,5кДж.
Ділянка CD: відбувається нагрівання води, при цьому QCD = cmΔt, де c = 4200Дж/кг°С, Δt = 100°С, отже QCD = 4200(Дж/кг°С)∙0,5кг∙100°С = 210∙103Дж = 210кДж.
Ділянка DE: відбувається кипіння води, при цьому QDE = r∙m, де r = 2,26∙106 Дж/кг, отже QDE = 2,26∙106(Дж/кг)∙0,5кг = 1,13∙106Дж = 1130кДж.
Ділянка EF: відбувається нагрівання пару, при цьому QEF = cmΔt, де c = 2200Дж/кг°С, Δt = 60°С, отже QEF = 2200(Дж/кг°С)∙0,5кг∙60°С = 66000Дж = 66кДж.
Таким чином, загальна кількість спожитої речовиною теплоти дорівнює:
Q = QAB + QBC + QCD + QDE + QEF = 41,8кДж + 167,5кДж + 210кДж + 1130кДж + 66кДж = 1615кДж.
Задача 2. Скільки теплоти потрібно для того щоб 2кг льоду, взятого при температурі –20º перетворити на воду з температурою 60ºС?
Дано:
лід (1), вода (2),
m1 = m2 = 2кг
t1 = –20ºС
t2 = 60ºС
Q = ?
Рішення. Для того щоб лід з температурою –20ºС перетворити на воду з температурою 60ºС потрібно:
1) нагріти лід до температури плавлення: Qн = c1m1∆t1, де с1 = 2090Дж/кгºС; ∆t1 = 20ºС, отже Qн = 2090(Дж/кгºС)∙2кг∙20°С = 83600Дж = 83,6кДж ≈ 84кДж;
2) розплавити лід: Qпл = λm1, де λ = 3,35·105Дж/кг, отже Qпл = 3,35·105(Дж/кг)∙ 2кг = 6,7·105Дж = 670кДж;
3) нагріти воду до 60°С: Qн = c2m2∆t2, де с2 = 4200Дж/кгºС, ∆t2 = 60ºС, отже Qн = 4200(Дж/кгºС)∙2кг∙60°С = 504000Дж = 504кДж;
Таким чином загальна кількість спожитої речовиною теплоти дорівнює
Q = 84кДж + 670кДж + 504кДж = 1258кДж ≈ 1260кДж
Відповідь: Q = 1260кДж.
Задача 3. У посудину з водою, взятою при температурі 0°С, впустили 1кг пари при 100°С. Через певний час у посудині встановилася температура 20°С. Скільки води було в посудині? Втратами енергії на нагрівання посудини знехтувати.
Дано:
вода (1), пар (2)
t1 = 0°C
m2 = 1кг
t2 = 100°C
tk = 20°C
m1 = ?
Рішення. В умовах даної задачі, тим об’єктом який отримує енергію є вода масою m1. Тим же об’єктом який втрачає енергію є пар масою m2. При цьому пар втрачає енергію двічі: при конденсації та при охолодженні до температури 20°С. Зважаючи на ці обставини, рівняння теплового балансу ∑Qотр = ∑Qвтр набуває вигляду c1m1Δt1 = r2m2 + c2m2Δt2, де Δt1 = 80°С, Δt2 = 20°С. Звідси
m1 = (r2m2 + c2m2Δt2) / c1Δt1, де с1 = с2 = 4200Дж/кг°С, r2 = 22,6·105Дж/кг.
Розрахунки: m1 = (22,6·105·1 + 4200·1·80)/4200·20 = 31кг
Відповідь: m1 = 31кг.
Контрольні запитання.
- Дайте загальну характеристику процесу пароутворення.
- Дайте загальну характеристику процесу конденсації.
- Чим випаровування відрізняється від кипіння?
- Чи залежить температура кипіння води від інтенсивності того полум’я яке спричиняє це кипіння? Від тривалості процесу кипіння?
- Від чого залежить температура кипіння?
- Чи може вода закипіти при 20°С? Що для цього потрібно зробити?
- Чому в процесі випаровування температура рідини знижується?
- Чому в процесі конденсації температура рідини підвищується
- Питома теплота пароутворення води 22,6·105Дж/кг. Що це означає?
- За яких умов температура води і навколишнього середовища буде однаковою?
Вправа 8.
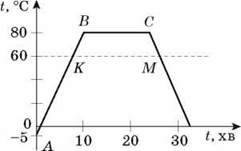
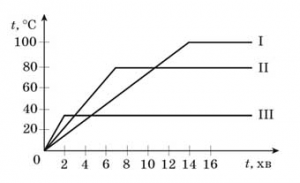
- На малюнку представлені графіки нагрівання трьох рідин. Що це за рідини?
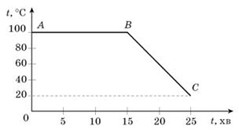
2. За заданим графіком визначити ту кількість теплоти яка виділяється при конденсації та охолодженню речовини. Маса речовини 200г.
3. Що і на скільки має більшу внутрішню енергію: кілограм вода при температурі 100°С чи кілограм водяного пару при тій же температурі?
4. Яка кількість теплоти потрібна для перетворення в пару 100г: а) води; б) спирту; в) заліза, за умови що вони вже знаходяться при температурі кипіння?
5. Яку кількість теплоти витрачено на нагріванні 10кг води від 20ºС до 100ºС з наступним утворенням 400г пари?
6. Яка кількість теплоти виділиться в процесі конденсації 2кг водяної пари при температурі 100º та охолодженні утвореної при цьому води до 20ºС?
7. Порівняйте величину тієї енергії що йде на випаровування 1кг води, з кінетичною енергією смертельної для людини кулі, маса якої 7г, а швидкість 300м/с. Зробіть висновок.
8. Скільки енергії знадобиться для того, щоб 3кг льоду з температурою –20°С перетворити на пару з температурою 200°С?
9. У калориметр з льодом масою 100г і температурою 0°С впущено пару при температурі 100°С. Скільки води виявиться в калориметрі безпосередньо після того, як увесь лід розтане?
.
§9. Горіння – фотосинтез. Питома теплота згорання.
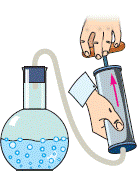
Нагрівання – охолодження, пароутворення – конденсація, плавлення – кристалізація, це відносно прості теплові процеси, які не супроводжуються хімічними перетвореннями речовини. Натомість горіння, це такий тепловий процес, який є результатом хімічної взаємодії палива з окиснювачем (зазвичай киснем О2) і який супроводжується утворенням нових хімічних речовин (продуктів згорання) та виділенням великої кількості теплової енергії.
Переконатися в тому, що для процесу горіння потрібне не лише паливо, а і його окиснювач (вільний кисень О2), зовсім не складно. Для цього достатньо джерело вогню, наприклад свічку, накрити посудиною яка обмежить доступ повітря, а отже і наявного в ньому вільного кисню, до цього джерела (мал.32). При цьому ви неодмінно з’ясуєте, що через невеликий проміжок часу полум’я згасне. Згасне тому, що для процесу горіння потрібне не лише паливо, а і вільний кисень.
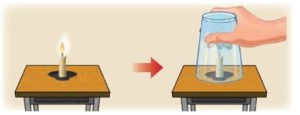
Мал.32. Для процесу горіння потрібне не лише паливо, а і вільний кисень (О2).
Горіння це досить складний процес, який представляє собою сукупність великої кількості екзотермічних, ланцюгових хімічних реакцій, протіканню яких сприяє низка суто фізичних явищ, як-то нагрівання, випаровування, дифузія, конвекційний теплообмін, тощо. Однак, якщо говорити про фізичну суть горіння, то вона досить проста. І ця суть полягає в тому, що в процесі горіння потенціальна енергія хімічних зв’язків, або хімічно взаємодіючих речовин, перетворюється в кінетичну енергію продуктів згорання (Еп → Ек). Адже те, що ми називаємо полум’ям, по суті представляє собою сукупність величезної кількості молекул які мають надзвичайно велику кінетичну енергію та є продуктами згорання палива.
В широкому сенсі терміном «горіння» позначають будь яку інтенсивну окислювально відновну реакцію, результатом якої є виділення великої кількості теплоти. Наприклад за звичайних температур водень горить у кисні: 2Н2 + О2 → 2Н2О + Q, натрій горить у хлорі: 2Na + Cℓ2 → 2NaCℓ + Q; залізний порошок, горить у кисні: 3Fe + 2O2 → Fe3O4 + Q; а вода горить у фторі: 2Н2О + 2F2 → 4HF + O2 + Q.
Однак в побутовій та науково-технічній практиці горінням називають такий інтенсивний тепловий процес, при якому паливо (деревина, вугілля, торф, нафта, бензин, природний газ, тощо) у поєднанні з киснем перетворюються на розжарені продукти згорання. Наприклад:
горіння метану: СН4 + 2О2 → СО2 + 2Н2О + Qгор;
горіння пропану: С3Н8 + 5О2 → 3СО2 + 4Н2О + Qгор;
горіння етану: 2С2Н6 + 7О2 → 4СО2 + 6Н2О + Qгор, тощо.
Власне повільне, контрольоване горіння відбувається і в організмі людини та інших живих істот. Адже джерелом нашої з вами життєвої енергії, є та енергія яка виділяється в процесі того поступового, контрольованого згорання вуглеводнів і жирів яке відбувається в нашому організмі. Узагальнюючу формулу такого згорання зазвичай представляють у вигляді С6Н12О6 + 6О2 → 6СО2 + 6Н2О + Q, де С6Н12О6 – хімічна формула глюкози.
Та як би там не було, а горіння, це такий тепловий процес, при якому потенціальна енергія хімічних зв’язків, або хімічно взаємодіючих речовин, перетворюється в кінетичну енергію продуктів згорання (Еп → Ек).



Мал.33. В процесі горіння потенціальна енергія хімічних зв’язків, або хімічно взаємодіючих речовин, перетворюється в кінетичну енергію продуктів згорання.
На практиці кількість тієї теплоти, що виділяється в процесі горіння, визначають за формулою: Qгор = qm, де m – маса палива, q – питома теплота згорання палива.
Питома теплота згорання – це фізична величина, яка характеризує теплові властивості даного виду палива і яка показує скільки енергії виділиться в процесі повного згорання одного кілограма цього палива.
Позначається: q
Визначальне рівняння: q = Qгор/m
Одиниця вимірювання: [q] = Дж/кг, джоуль на кілограм.
Питома теплота згорання кожного виду палива визначається експериментально і записується у відповідну таблицю, наприклад таку.
| Речовина | q (Дж/кг) | Речовина | q (Дж/кг) |
| Тверде паливо | |||
| буре вугілля | 9,3·106 | кам’яне вугілля марки АⅠ | 20·106 |
| деревне вугілля | 30·106 | кам’яне вугілля марки АⅡ | 30·106 |
| дрова сухі | 8,5·106 | порох | 3·106 |
| Рідке паливо | |||
| бензин, нафта | 46·106 | мазут | 40·106 |
| дизельне паливо | 42·106 | спирт | 27·106 |
| гас | 43·106 | ||
| Газоподібне паливо (для 1м3 за нормального тиску) | |||
| коксовий газ | 16·106 | ацетилен | 48·106 |
| природний газ | 40·106 | водень | 120·106 |
Потрібно зауважити, що та кількість теплоти яка виділяється в процесі горіння, практично не залежить від режиму цього горінні. Наприклад шматок деревини, в одних умовах може згоріти за дві хвилини, в інших – за тридцять хвилин, а в третіх (в процесі гниття) – за десять років. При цьому кількість тієї теплоти що виділяються в процесі відповідних згорань буде практично однаковою. Звичайно за умови що згорання буде повним.
Напевно ви звернули увагу на те, що природні явища симетричні. Симетричні в тому сенсі, що кожному природному процесу можна поставити у відповідність певний зворотній процес. Нагрівання – охолодження, плавлення – кристалізація, пароутворення – конденсація, ось лише деякі приклади симетричності природних явищ. А от горіння. Чи існує процес зворотній до нього? Виявляється, існує. І цей процес називають фотосинтезом (від грец. photos – світло; synthesis – з’єднувати, створювати).
Фотосинтез, це складний багатоступеневий фотохімічний процес, суть якого полягає в тому, що в клітинах рослин та деяких бактерій, під дією енергії сонячного світла, із води та вуглекислого газу синтезуються енергоємні молекули простих вуглеводнів, зокрема глюкози. Фізичну суть фотосинтезу можна представити у вигляді наступної узагальнюючої формули: 6СО2 + 6Н2О + Е☼ → С6Н12О6 + 6О2.
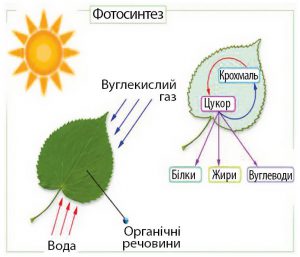
Мал.34. В процесі фотосинтезу енергія Сонця трансформується в енергію хімічних сполук.
Не важко бачити, що в процесі фотосинтезу синтезуються не лише енергоємні молекули вуглеводнів, а й виділяються необхідні для життя та горіння молекули кисню. І потрібно сказати, що увесь той молекулярний кисень (О2) який міститься в атмосфері Землі, то продукт фотосинтезу. Адже за відсутності фотосинтезу, атмосфера Землі дуже швидко втратила б увесь наявний в ній вільний кисень. Бо кисень, це надзвичайно активний хімічний елемент, який утворює стійкі хімічні сполуки з переважною більшістю інших хімічних елементів.
Не дивлячись на те, що фотосинтез це надзвичайно складний фізико-хімічно-біологічний процес, його фізична суть дуже проста: в процесі фотосинтезу, кінетична енергія електромагнітних хвиль (фотонів світла) перетворюється на потенціальну енергію хімічних зв’язків продуктів фотосинтезу: Ек → Еп. При цьому, в результаті фотосинтезу утворюються два компоненти: енергоємні молекули глюкози (С6Н12О6) та молекули хімічно активного окиснювача – кисню (О2).
Таким чином, в процесі фотосинтезу кінетична енергія фотонів світла перетворюється на потенціальну енергію молекул палива та окиснювача (Q☼ = Ек → Еп). В процесі ж горіння, відбувається зворотне перетворення. Перетворення потенціальної енергії молекул системи паливо – окиснювач в кінетичну енергію продуктів згорання, тобто в ту енергію яку прийнято називати енергією горіння (Еп → Ек = Qгор).
Ви можете запитати: «А яке відношення до фотосинтезу має вугілля, нафта, торф, природний газ, горючі сланці, тощо?». Втім, напевно ви чули, що колись всі ці горючі матеріали були деревами, кущами, папоротниками, травою та іншою рослинністю. А це означає, що та енергія яка акумульована у вугіллі, нафті, природному газі та інших подібних матеріалах, по суті є законсервованою енергією фотосинтезу.
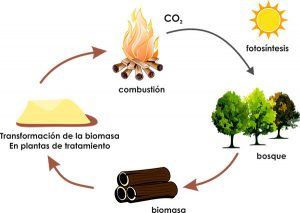
Мал.35. Енергія природних горючих матеріалі, то законсервована енергія фотосинтезу.
Задача 1. При повному згоранні 0,5кг палива виділяється 10МДж теплоти. Яка питома теплоємність палива? Що це за паливо?
Дано:
m = 0,5кг
Qгор= 10МДж = 10·106Дж
q = ?
Рішення. Оскільки Qгор = qm, то q = Qгор/m = 10·106Дж/0,5кг = 20·106Дж/кг.
Знаючи питому теплоту згорання палива, за відповідною таблицею визначаємо сорт палива: кам’яне вугілля марки А-1.
Відповідь: q = 20·106Дж/кг; кам’яне вугілля марки А-1.
Задача 2. На спиртівці нагріли 175г води від 15 до 75ºС. Початкова маса спиртівки і спирту дорівнювала 163г, а після закінчення нагрівання 157г. Визначити ККД нагрівальної системи.
Дано:
вода (1), спирт (2)
m1 = 175г = 0,175кг
∆t1 = 75–15 = 60ºС
∆m2 = 163–157 = 6г = 0,006кг
η = ?
Рішення. За визначенням η = Акор/Азаг. Із аналізу умови задачі ясно: Акор= Qн1 = c1m1∆t1, де с1 = 4200Дж/кг·ºС; Aзаг= Qгор2 = q2∆m2, де q2 = 27·106Дж/кг. Таким чином: η = c1m1∆t1 / q2∆m2.
Розрахунки: η = 4200(Дж/кгºС)·0,175кг·60°С / 27·106(Дж/кг)·0,006кг = 44,1∙103Дж / 162∙103Дж = 0,27 = 27%.
Відповідь: η = 27%
Задача 3. Скільки потрібно спалити спирту, аби 2кг льоду взятого при температурі 0°С розплавити і отриману воду нагріти до 80°С. ККД спиртівки 40%.
Дано:
m1 = 2кг
t1 = 0°C
t2 = 80°C
η = 40% = 0,4
m3 = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною є та робота (енергія) яка йде на плавлення льоду та нагрівання отриманої води до температури 80°С, тобто Акор=Qпл+Qн = λ1m1+c1m1Δt1. Загальною ж (затраченою) є та енергія (робота) яку отримують при згоранні спирту, тобто Азаг= Qгор = qm3.
Таким чином, в умовах нашої задачі η = (λ1m1+c1m1Δt1) / qm3. Звідси випливає m3 = (λ1m1+c1m1Δt1) / qη, де λ1 = 3,35·105Дж/кг; с1 = 4200Дж/кг°С; q = 27·106Дж/кг.
Розрахунки: m3 = (3,35·105·2 + 4200·2·80)/27·106·0,4 =
= (3,35·2·105 + 4,2·2·0,8∙105)/27·4·105 = 13,4/108 = 0,124кг = 124г.
Відповідь: m3 = 124г.
Контрольні запитання.
- Чим горіння відрізняється від інших простих теплових процесів?
- Яка фізична суть процесу горіння?
- Що представляє собою полум’я?
- Що називають питомою теплотою згорання?
- Що означає твердження: теплові процеси є симетричними?
- Звідки береться та енергія яка виділяється в процесі згорання деревини?
- Яка фізична суть фотосинтезу?
- Чому без фотосинтезу атмосфера Землі швидко втратила б увесь наявний в ній кисень?
- Який зв’язок між тією енергією яка виділяється при згоранні вугілля, та фотосинтезом?
Вправа 9.
- Яка кількість теплоти виділиться при повному згоранні 100г спирту?
- При повному згоранні 0,5кг палива виділилось 21МДж теплоти. Що це за паливо?
- Скільки води, взятої при температурі 14°С, можна нагріти до 50°С, спаливши 30г гасу? Вважати, що вся виділення при горінні енергія йде на нагрівання води.
- Скільки дров треба спалити, щоб отримати таку саму кількість теплоти, як і від спалювання 1,5кг бензину?
- Яку кількість гасу потрібно спалити щоб 50л води нагріти від 20ºС до кипіння? ККД процесу 35%?
- Скільки води можна нагріти в алюмінієвій каструлі масою 1кг від 20ºС до кипіння, спалюючи 100г гасу в установці з ККД 40%?
- У мідній посудині масою 0,5кг нагрівають 2л води, взятої при температурі 10ºС. До якої температури можна нагріти воду за рахунок спалювання 50г спирту (ККД процесу 50%)
- Визначити ККД двигуна автомобіля, який маючи середню потужність 70кВт витрачає 17кг бензину за годину.
.
§10. Розв’язування задач. Тема: закон збереження енергії в теплових та механічних процесах.
Побутує думка ніби рішення задачі фізики полягає в тому, щоб серед незліченого різноманіття правильних формул вибрати потрібне розрахункове рівняння, тобто ту формулу підставивши в яку задані величини, можна визначити невідому величину. Така думка є абсолютно хибною. Хибною бодай тому, що в фізиці кожна задача індивідуальна. А це означає, що кожна з сотень, тисяч і мільйонів задач має своє розрахункове рівняння. І запам’ятовувати, зазубрювати чи заучувати різноманіття подібних рівнянь нема ані можливості ані сенсу.
Рішення задачі фізики полягає не в тому, щоб із незліченного різноманіття правильних формул вибрати потрібну, а в тому щоб на основі аналізу умови конкретної задачі та певного обмеженого набору базових формул (базових законів та визначальних рівнянь фізичних величин), шляхом логічних міркувань та математичних дій вивести потрібне розрахункове рівняння.
Наприклад розв’язуючи задачі на застосування закону збереження енергії в механічних та теплових процесах ви маєте знати: 1. Для тих процесів які називаються теплообміном (Амех = 0), закон збереження енергії (∑Едо = ∑Епісля) набуває вигляду рівняння теплового балансу ∑Qвтр = ∑Qотр. 2. За наявності тих чи інших втрат, аналогом закону збереження енергії є параметр який називається ККД (η = Акор/Азаг). 3. Енергетичні параметри механічних процесів характеризують: механічна робота Амех = F·s, кінетична енергія Ек=mv2/2, потенціальна енергія сили тяжіння Еп=mgh, механічна потужність N = A/t. 4. Енергетичні параметри теплових процесів характеризують: Qн = с∙m∙∆t; Qпл = λ∙m; Qпар = r∙m; Qгор = q∙m, де c, λ, r, q – табличні величини.
Таким чином, якщо вам потрібна шпаргалка в якій будуть записані ті базові формули на основі яких ви маєте розв’язувати задачі по темі «закон збереження енергії в механічних та теплових процесах», то ось ця шпаргалка:
в загальному випадку ∑Едо = ∑Епісля;
якщо Амех = 0, то ∑Qвтр = ∑Qотр;
за наявності енергетичних втрат η = Акор/Азаг;
механічні процеси: Амех = F·s, Ек = mv2/2, Еп = mgh, N = A/t;
теплові процеси: Qн = с∙m∙∆t; Qпл = λ∙m; Qпар = r∙m; Qгор = q∙m, де c, λ, r, q – табличні величини.
Звісно, за необхідності ви маєте застосовувати й інші формули, наприклад визначальне рівняння густини ρ = m/V, визначальне рівняння швидкості v = s/t, тощо.
Задача 1. Яка кількість теплоти виділиться підчас гальмування автомобіля, якщо його гальмівний шлях становить 12,5м, а сила гальмування 2,4кН?
Дано:
s = 12,5м
F = 2,4кН = 2400Н
Q = ?
Рішення. Будемо виходити з того, що в процесі гальмування та механічна робота (енергія) яку виконала гальмівна сила F на шляху s, і яка дорівнює Амех= F·s, у відповідності з законом збереження енергії ∑Едо = ∑Епісля повністю перетворюється в теплоту Q. А це означає, що Q = Амех= F·s = 2400Н·12,5м = 30000Дж = 30кДж.
Відповідь: Q = 30кДж.
Задача 2. На скільки градусів нагріється шматок міді при його падінні з висоти 150м, якщо ККД процесу 60%.
Дано:
мідь
h = 150
η = 60% = 0,6
Δt = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі корисною є та енергія яка йде на нагріванні міді, тобто Акор = Qн = с∙m∙∆t, де с = 380Дж/кг°С (таблична величина), ∆t = ?, m – маса міді. Загальною (затраченою) є та потенціальна енергія яку мало тіло на висоті h, тобто Азаг = Еп = mgh, де g = 10м/с2, m – маса міді.
Таким чином η = Акор/Азаг = с∙m∙∆t/mgh = с∙∆t/gh = η, звідси ∆t = ηgh/с.
Розрахунки. ∆t = ηgh/с = 0,6∙10(м/с2)∙150м/380(Дж/кг°С) = 900(м2/с2)∙кг°С / 380(Дж=Н∙м=кг∙м2/с2) = 2,4°С.
Відповідь: ∆t = 2,4°С.
Задача 3. Дві однакові мідні кулі дістали однакову енергію, внаслідок чого перша куля залишаючись нерухомою нагрілась на 40ºС, натомість друга не нагріваючись набула певної швидкості. Визначити цю швидкість.
Дано:
m1 = m2
E1 = E2
v1 = 0м/с
∆t1 = 30ºC
Qн2 = 0Дж
v2 = ?
Рішення. Оскільки за умовою задачі E1 = E2 та враховуючи, що вся надана першій кулі енергія пішла на її нагрівання, тобто Е1 = с1m1∆t1, де с1= с(міді) = 380Дж/кгºС, а надана другій кулі енергія пішла на збільшення її кінетичної енергії, тобто Е2 = m2v22/2, можна записати с1m1∆t1 = m2v22/2, звідси
v22 = 2с1m1∆t1/m2 = 2с1Δt1, звідси v2 = √2с1∆t1.
Розрахунки: v2 = √(2·380(Дж/кгºС)·30ºС = √22800(м2/с2) = 151м/с.
Відповідь: v2 = 151м/с.
Задача 4. Потужність двигуна автомобіля 50кВт. Який ККД цього двигуна якщо при швидкості 100км/год він споживає 11кг бензину на 100км шляху?
Дано:
N = 50кВт = 50·103Вт
v = 100км/год
s = 100км
бензин
m = 11кг
η = ?
Рішення. За визначенням η = Акор/Азаг. Оскільки потужність двигуна N дорівнює відношенню виконаної двигуном корисної роботи Акор до того проміжку часу t за який ця робота була виконана N = Aкор/t, то Aкор = N·t. А оскільки v = s/t, то t = s/v = 100км/100(км/год) = 1год = 3600с.
Оскільки двигун працює за рахунок енергії згорання палива, то ясно, що Азаг= Qгор = qm, де q = q(бензин) =46·106Дж/кг.
Таким чином: η = N·t/qm.
Розрахунки: η = 50·103Вт·3,6·103с / 46·106 (Дж/кг)11кг = 0,36 = 36%.
Відповідь: η = 36%.
Задача 5. При пострілі, куля масою 9г вилітає із дула гвинтівки з швидкістю 800м/с. Визначте масу порохового заряду, якщо ККД пострілу 24%.
Дано:
m1 = 9г = 0,009кг
v1 = 800м/с
порох
η = 24% = 0,24
m2 = ?
Рішення. За визначенням η = Акор/Азаг. Із аналізу умови задачі ясно, що корисною є та робота яка йде на надання кулі певної кінетичної енергії, тобто Акор = m1v12/2. Загальною ж роботою є та енергія яка виділяється при згоранні пароху, тобто Азаг = qm2, де q = q(порох) = 3·106Дж/кг. Таким чином
η = m1v12/2qm2, звідси m2 = m1v12/2qη.
Розрахунки: m2 = 0,009кг(800м/с)2/(2· 3·106(Дж/кг)·0,24) =
= 5760Дж)/1,44·106(Дж/кг) = 4·10–3кг = 4г.
Відповідь: m2 = 4г.
Задача 6. На електроплитці нагріли 1,2л води від 10 до 100ºС. При цьому 3% води перетворилось на пар. Скільки часу тривало нагрівання, якщо потужність плитки 800Вт, а її ККД 65%?
Дано:
V1 = 1,2л = 1,2·10–3м3
∆t1 = 100ºC–10ºC = 90ºC
m2 = 0,03m1
N = 800Вт
η = 65% = 0,65
t = ?
Рішення. За визначенням η = Акор/Азаг. Із аналізу умови задачі ясно, що корисною роботою є та енергія яка йде на нагрівання та випаровування води, тобто Акор= Qн + Qпар = c1m1∆t1 + rm2, де m1 = ρ1V1 = 1·103(кг/м3)· 1,2·10–3м3 = 1,2кг; с1 = 4200Дж/кгºС; r = 3,35·105Дж/кг.
Загальною ж роботою є та енергія яка виділяється електроплиткою потужністю N. А оскільки N = Aзаг/t, то Aзаг= N·t. Таким чином:
η = (c1m1∆t1 + rm2)/N·t, звідси t = (c1m1∆t1 + rm2)/N·η.
Розрахунки: t = (4200·1,2·90 + 3,35·105·0,03·1,2)/800·65 = 896с = 15хв.
Відповідь: t = 15хв.
Вправа 10.
- Яка кількість теплоти виділиться при падінні вантажу масою 20кг з висоти 4м?
- 2. З якої висоти має впасти трьох кілограмова цеглина, щоб своєю кінетичною енергією нагріти літр води на 1ºС? Вважати, що вся енергія йде на нагрівання води.
- На скільки нагріється при штампуванні сталева деталь масою 1кг від удару молота масою 100кг, якщо швидкість молота в момент удару 20м/с, а на нагрівання деталі йде 50% його енергії?
- Порівняйте температуру води в підніжжі водоспаду з її температурою біля його вершини, якщо висота водоспаду 60м. Вважати, що вся енергія падаючої води йде на її нагрівання.
- На яку висоту можна було б підняти вантаж масою 1т, якби вдалося повністю використати ту енергію яка виділяється при перетворенні 1кг пару з температурою 100ºС у воду аналогічної температури?
- Потяг масою 2000т рухається з швидкістю 54км/год. Яка загальна кількість теплоти виділиться в процесі гальмування та зупинки потягу?.
- Свинцева куля летить зі швидкістю 300м/с. На скільки зміниться її температура при раптовій зупинці? Вважати що на нагрівання кулі йде 40% її енергії.
- Яку потужність розвиває двигун автомобіля, якщо при швидкості 60км/год він споживає 74г бензину. ККД двигуна 30%.
- Скільки спирту треба спалити, щоб скип’ятити 3кг води, взятої при температурі 20°С, в алюмінієвій каструлі масою 400г? ККД нагрівника 50%.
.
§11. Теплові двигуни.
Тепловий двигун, це прилад, який перетворює внутрішню енергію палива (теплоту) в механічну роботу (Q → Амех). За способом перетворення теплоти в механічну роботу, та за характерними конструктивними ознаками, теплові двигуни поділяють на поршневі, турбінні та реактивні. Не заглиблюючись в деталі загального устрою та принципу дії вище згаданих різновидностей теплових двигунів, можна сказати наступне.
Поршневими називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло, знаходячись в циліндрі двигуна, тисне на поршень та переміщує його. Поршневі двигуни поділяються на парові машини та двигуни внутрішнього згорання.
Паровими машинами, називають такі поршневі двигуни, в яких робочим тілом є нагрітий за межами циліндру пар. Парові машини були тими першими тепловими двигунами, які отримали широке практичне застосування. Однак, якщо говорити про теперішній час, то в ньому парові машини практично не застосовуються. Не застосовують тому, що їх ККД надзвичайно низький (5 – 7%)
Двигунами внутрішнього згорання називають такі поршневі двигуни, в яких робочим тілом є високотемпературний газ що утворюється в процесі згорання палива яке відбувається в середині робочого циліндру двигуна. Загальний устрій та етапи роботи типового двигуна внутрішнього згорання представлені на мал.36.
Повний робочий цикл представленого на малюнку двигуна здійснюється за чотири етапи (такти). На першому – відкривається вхідний клапан і циліндр заповнюється горючою сумішшю. На другому етапі, ця суміш стискається. На третьому – горюча суміш підпалюється, згорає і виконує корисну роботу. На четвертому етапі, відкривається випускний клапан і відпрацьовані продукти згорання виштовхуються за межі робочого циліндра.
Мал.36. Загальний устрій та етапи роботи типового двигуна внутрішнього згорання.
За низкою ознак двигуни внутрішнього згорання зазвичай поділяють на карбюраторні та дизельні. В карбюраторних (бензинових) двигунах, горюча суміш утворюється за межами робочого циліндра (в карбюраторі) і в потрібний момент запалюється електричною іскрою яку створює свічка запалювання. В дизельних двигунах нема карбюратора і нема свічки запалювання. Натомість є форсунка – прилад, який в момент гранично сильного стиснення повітря, впорскує в це розжарене повітря паливо яке самозаймається.
В побутовій практиці, ми майже завжди маємо справу з тими чи іншими різновидностями поршневих двигунів внутрішнього згорання. Адже саме такі двигуни стоять на наших автомобілях, мопедах, мотоциклах, моторних човнах, побутових електрогенераторах, тощо. Однак, якщо мова йде про більш потужні прилади, як то кораблі, підводні човни, літаки, генератори теплових електростанцій, тощо, то в них зазвичай застосовують так звані турбінні двигуни.
Турбінними двигунами називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне та відповідно стиснуте робоче тіло, направленим струменем спрямовується на спеціальне лопатчате колесо (турбіну), яке під дією цього струменю обертається. Сучасні турбінні двигуни мають достатньо складну будову. Однак принциповий устрій (мал.37) та принцип дії цих двигунів є гранично простими. І цей устрій та принцип дії мало чим відрізняється від устрою та принципу дії водяного колеса: потік води падає на лопатчате колесо і обертає його.
Мал.37. Що спільного між водяним колесом та турбінним двигуном?
Ще однією важливою різновидністю теплових двигунів є двигуни реактивні. Реактивними називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло з великою швидкістю вилітає назовню двигуна через так зване сопло. У своєму принциповому устрої реактивний двигун представляє собою камеру згорання, виходом якої є сопло, тобто певне звуження камери згорання, яке плавно переходить в характерне розширення (мал.38а). Така конструкція забезпечує вирішення двох задач: 1) створює умови за яких швидкість вильоту молекул робочого тіла є максимально великою; 2) створює умови за яких рух молекул робочого тіла є максимально упорядкованим (направленим вздовж осі сопла).
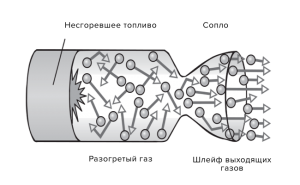
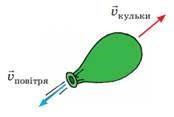
Мал.38. Ілюстрація загального устрою та принципу дії реактивного двигуна.
Як і будь який тепловий двигун, двигун реактивний перетворює внутрішню енергію палива в механічну роботу. А цією роботою є механічне переміщення самого двигуна, та того тіла з яким він жорстко з’єднаний, наприклад тіла космічної ракети. При цьому поступальний рух реактивного двигуна обумовлений тими ж силовими причинами що і рух гумової кульки з отвору якої витікає струмінь стиснутого повітря (мал.38б), або тіла гармати після вильоту з неї ядра, або рух човна з корми якого стрибає пірнальник. Просто з тіла реактивного двигуна вилітає не стиснуте повітря, не ядра, не кулі, не снаряди і не пірнальники, а молекули тієї речовини що згорає в двигуні.
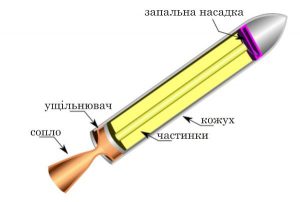
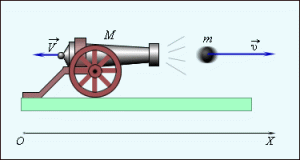
Мал.39. Що спільного між гарматою та реактивним двигуном?
Аналізуючи загальний устрій реактивних, турбінних та поршневих двигунів, важко віднайти бодай якісь конструктивні аналогії. Важко тому, що з точки зору технічних рішень, ці двигуни влаштовані по різному. І тим не менше, всі ці абсолютно не схожі двигуни, працюють за однією принциповою схемою.
З’ясовуючи суть цієї схеми, задамося питанням: «А які елементи теплового двигуна є найважливішими, тобто такими, без наявності яких не зможе працювати жоден тепловий двигун?» Відповідаючи на це запитання, ви неминуче прийдете до висновку, що найважливішими елементами теплового двигуна є не циліндри, не поршні, не колінчасті вали, не сопла і не турбінні колеса. Бо як би там не було, а всі ці деталі, це лише допоміжні технічні елементи які допомагають перетворити внутрішню енергію палива в механічну роботу. При цьому існують двигуни без поршнів, без циліндрів, без колінчастих валів, без сопел і без турбінних коліс.
А от без чого дійсно не може існувати будь який тепловий двигун, так це без сукупності трьох основних елементів: 1) нагрівника – джерела теплової енергії; 2) робочого тула – речовини, яка отримує від нагрівника теплову енергію та перетворює частину цієї енергії в механічну роботу; 3) холодильника – тієї «помийної ями» в яку викидається відпрацьоване робоче тіло, а разом з ним і та частина енергії, яка залишилась після виконання механічної роботи. І не важко збагнути що цією «помийною ямою» практично завжди є наше навколишнє середовище.
Таким чином, коли ми стверджуємо, що всі теплові двигуни працюють за єдиною принциповою схемою, то маємо на увазі факт того, що загальний принцип дії будь якого теплового двигуна полягає в наступному. 1. Нагрівник (джерело енергії) надає робочому тілу певну кількість теплоти (Q1). 2. Робоче тіло, частину цієї теплоти перетворює на механічну роботу (А), а решту (Q2 = Q1–А) – передає холодильнику, яким по суті є навколишнє середовище. Іншими словами принцип дії будь якого теплового двигуна можна представити у вигляді наступної схеми
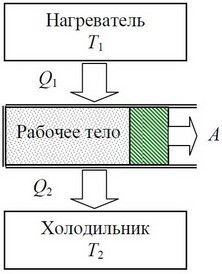
Мал.40. Принципова схема теплового двигуна.
Малоприємною особливістю навіть найсучасніших теплових двигунів, є факт того, що їх ККД є відносно низьким і усереднено дорівнює 33%. Це означає, що в процесі роботи теплового двигуна, приблизно 2/3 тієї теплової енергії яка міститься в його паливі, не перетворюючись в механічну роботу викидається за межі двигуна.
Втім, це зовсім не означає, що сучасні теплові двигуни є поганими чи не досконалими. Просто теплова енергія Q (енергія хаотичного руху молекул речовини) погано та неохоче перетворюється в механічну роботу Амех (енергію упорядкованого руху всіх молекул відповідного тіла).
Факт того, що енергетична ефективність теплових двигунів відносно низька, є прямим наслідком того закону який називається другим началом термодинаміки. А у відповідності з цим законом механічна робота легкої і повністю перетворюється на теплоту, а от теплота перетворюється на механічну роботу лише за певних умов і неповністю. Втім, про друге начало термодинаміки ми поговоримо в процесі вивчення основ того розділу фізики, який називається термодинамікою.

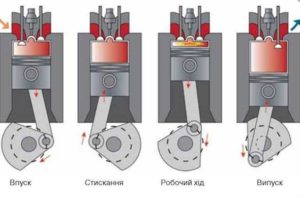
Мал.41. Механічна робота легкої і повністю перетворюється на теплоту, а от теплота перетворюється на механічну роботу лише за певних умов і неповністю (друге начало термодинаміки).
Задача 1. Двигун внутрішнього згорання потужністю 36кВт, за 1 годину роботи витрачає 10кг гасу. Визначити ККД двигуна.
Дано:
N = 36кВт = 36000Вт
t = 1год = 3600с
m = 10кг
η = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною є та механічна робота яку виконує двигун і мірою якої є його потужність N = Aмех/t, звідси Aкор = Aмех = Nt. Загальною роботою, є та теплова енергія яка виділяється в процесі згорання палива, тобто Азаг = Qгор = qm, де q(гасу) = 43·106Дж/кг.
Враховуючи вище сказане, можна записати η = Nt/qm.
Розрахунки: η = 36000(Дж/с)3600с/43·106(Дж/кг)∙10кг = 36·3,6·106/430·106 = 0,30 = 30%.
Відповідь: η = 30%.
Задача 2. Двигун внутрішнього згорання автомобіля має потужність 40кВт, а його ККД 33%, яку кількість бензину він споживає за годину роботи?
Дано:
N = 40кВт = 40000Вт
η = 33% = 0,33
t = 1год = 3600с
m = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною є та механічна робота яку виконує двигун і мірою якої є його потужність N = Aмех/t, звідси Aкор = Aмех =Nt. Загальною роботою, є та теплова енергія яка виділяється в процесі згорання палива, тобто Азаг = Qгор = qm, де q=46·106Дж/кг.
Враховуючи вище сказане, можна записати η = Nt/qm. Звідси m=Nt/qη.
Розрахунки: m = 40000(Дж/с)3600с/46·106(Дж/кг)0,33 = (4·36·106/15,2·106)кг = 9,5кг.
Відповідь: m = 9,5кг.
Задача 3. На скільки кілометрів шляху вистачить 6кг бензину для двигуна мотоцикла, який маючи ККД 28% при швидкості 72км/год розвиває потужність 9кВт?
Дано:
m = 6кг
η = 28% = 0,28
v = 72км/год = 20м/с
N = 9,5кВт = 9500Вт
s = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною є та механічна робота яку виконує двигун мотоцикла і мірою якої є його потужність N = Aмех/t, звідси Aкор = Aмех = N∙t. А враховуючи, що v = s/t, a отже t = s/v, можна записати Aкор = N∙s/v.
Загальною ж роботою, є та теплова енергія яка виділяється в процесі згорання палива, тобто Азаг = Qгор = qm, де q = 46·106Дж/кг.
Таким чином η = Акор/Азаг = N∙s/v∙q∙m. Звідси s = η∙ v∙q∙m/N.
Розрахунки. s = η∙ v∙q∙m/N = 0,28∙20(м/с)∙ 46·106(Дж/кг)∙6кг / 9500(Дж/с) = 0,16·106м = 160·103м = 160км .
Відповідь: s = 160км.
Контрольні запитання.
- Поясніть будову та принцип дії двигуна внутрішнього згорання.
- Чим схожі і чим відрізняються дизельні та карбюраторні двигуни?
- Поясніть загальний устрій та принцип дії турбінного двигуна.
- Чим схожі і чим відрізняються турбінний двигун та водяне колесо млина?
- Поясніть загальний устрій та принцип дії реактивного двигуна.
- За якою принциповою схемою працює будь який тепловий двигун?
- Що в принциповій схемі теплового двигуна називають нагрівником, робочим тілом та холодильником?
- Чи означає факт відносно низького ККД сучасних теплових двигунів, що ці двигуни є недосконалими?
Вправа 11.
- Двигун внутрішнього згорання виконав корисну роботу що дорівнює 2,3∙105кДж, і використав при цьому 2кг бензину. Визначіть ККД цього двигуна.
- Двигун трактора, розвиваючи потужність 60кВт, споживає 18кг дизельного палива за 1 годину. Визначити ККД цього двигуна.
- Визначити ККД теплового двигуна, який розвиває потужність 95кВт та витрачає за годину 25кг дизельного палива (q = 42·106Дж/кг)?
- Потужність одного з найбільших дизельних двигуні становить 42000кВт. Скільки дизельного палива споживає цей двигун за годину роботи, якщо його ККД 40%
- На скільки кілометрів шляху вистачить 10 бензину для двигуна автомобіля, який маючи ККД 30% при швидкості 72км/год розвиває потужність 30кВт?
- Визначити потужність двигуна автомобіля, який при швидкості 72км/год витрачає на кожний кілометр шляху 90г бензину. ККД двигуна 30%
- Яку кількість бензину витратили двигуни літака, що пролетів 500км з середньою швидкістю 250км/год, якщо середня потужність його двигунів 2000кВт? ККД двигуна 25%.
.