ОСНОВИ ТЕРМОДИНАМІКИ

Розділ 3. Основи термодинаміки.
§1. Загальні відомості про термодинаміку.
§2. Перше начало термодинаміки.
§3. Термодинамічні процеси. Адіабатні та кругові процеси.
§4. Цикл Карно. Ідеальна теплова машина Карно як
ідеальний термометр.
§5. Реальні цикли теплових двигунів.
§6. Чому теплові двигуни мають низький ККД?
§7. Зворотний цикл Карно. Холодильники. Теплові насоси.
§8. Друге начало термодинаміки. Або про те, чому
природні події відбуваються так, а не навпаки.
§9. Чи загрожує Всесвіту «теплова смерть»?
.
Розділ 3. Основи термодинаміки. (Вивчається за необхідності)
.
§1. Загальні відомості про термодинаміку.
Вивчаючи молекулярну фізику, ми виходили з того, що навколишній світ складається з молекул які рухаються та певним чином взаємодіють між собою. Спираючись на ці прості базові твердження, ми збудували струнку наукову теорію, яка дозволяє пояснити широке коло природних явищ. І ці пояснення виявилися не лише достовірними а й гранично наглядними. Тому сьогодні нам важко уявити, що властивості твердих, рідких і газоподібних речовин, процеси нагрівання, плавлення, пароутворення, дифузії, горіння, тощо, можна пояснити не згадуючи про молекули. Тим не менше, це можливо. А доказом тому є наука, яка називається термодинамікою. Термодинаміка – це розділ фізики, в якому вивчають загальні властивості твердих, рідких і газоподібних речовин, та ті теплові процеси які відбуваються з ними.
Мал.1. Термодинаміка вивчає загальні властивості речовин та ті теплові процеси які відбуваються з ними.
Термодинаміка одна з небагатьох наук, яка має точну дату свого народження – 1824 рік. Саме цього року вийшла в світ книга молодого французького інженера Саді Карно (1796 – 1832), яка називалась «Роздуми про рушійну силу вогню і про машини здатні розвивати цю силу». В цій книзі Карно не лише пояснив закономірності перетворення теплоти в механічну роботу а й заклав основи тієї науки, яку сьогодні називають термодинамікою.
Потрібно зауважити, що поява науки про закономірності перетворення теплоти в механічну роботу, була очікуваною подією. Адже на початку 19-го століття з’явилися перші парові машини, які з одного боку дали колосальний поштовх для розвитку машинного виробництва, а з іншого – мали надзвичайно низьку енергетичну ефективність. Адже коефіцієнт корисної дії тогочасних парових машин не перевищував 4%. Ясно, що в такій ситуації потреби виробництва вимагали створення більш ефективних машин. А створити таку машину без розуміння тих процесів які в ній відбуваються практично неможливо. Тому перед тогочасною наукою постала цілком конкретна та практично важлива задача: дослідити закономірності перетворення теплоти в механічну роботу і з’ясувати умови за яких це перетворення буде максимально ефективним.
Саме таку задачу поставив перед собою і блискуче розв’язав військовий інженер Саді Карно. Дослідивши роботу тогочасних парових машин, Карно не лише сформулював та пояснив закономірності переходу теплоти в механічну роботу і не лише визначив ті умови за яких цей перехід буде гранично ефективним, а й розробив такий механізм дослідження властивостей речовин, який не передбачав певних знань про внутрішній устрій цих речовин. Цей механізм виявився настільки дієвим та ефективним, що дозволив створити абсолютно нову науку – термодинаміку.
По суті термодинаміка і молекулярна фізика вивчають та пояснюють одне і теж: загальні властивості твердих рідких і газоподібних речовин та ті теплові процеси які відбуваються з цими речовинами. Однак вивчають і пояснюють по різному. Молекулярна фізика виходить з того, що всі речовини складаються з надзвичайно дрібненьких частинок (молекул) які безперервно рухаються і певним чином взаємодіють між собою. Термодинаміка ж, пояснюючи те саме, виходить з іншого: при будь яких процесах що відбуваються в замкнутій системі, загальна кількість енергії цієї системи залишається незмінною, при цьому теплова енергія сама по собі не може переходити від холодного тіла до гарячого.
Звичайно, твердження про те, що молекулярна фізика і термодинаміка, це дві науки про одне і теж, є певним перебільшенням. Адже мова йде про дві різні, в певному сенсі протилежні науки, кожна з яких має свої специфічні особливості та сфери переважного застосування. Однак за великим рахунком, ці дві різні науки дійсно вивчають та пояснюють одну і туж групу споріднених явищ.
Якщо ж говорити про те, яким чином та чому виникли дві різні науки про одне і теж, то цей факт має певні історичні передумови і певні історичні пояснення. А ці передумови та пояснення полягають в наступному. Про існування молекул люди здогадувались дуже давно. Принаймі ще за 400 років до нашої ери давньогрецькі вчені обгрунтовано стверджували, що всі тіла складаються з надзвичайно дрібненьких частинок, які певним чином взаємодіють між собою. Однак факт того, що молекули дійсно існують був науково доведений лише в 1908 році. В такій ситуації, ті вчені які вірили в існування молекул, створили молекулярну фізику, тобто науку в якій загальні властивості речовин пояснювались виходячи з того, що ці речовини складаються з молекул.
З іншого боку, були вчені які намагались не приймати на віру ті твердження достовірність яких була сумнівною. Адже якби там не було, а до 1908 року, факт існування молекул не був науково доведеним. Тому ті вчені, які грубо кажучи не вірили в існування молекул, створили термодинаміку – науку, в якій загальні властивості речовин пояснювались на основі певних, на той час достовірно встановлених фактів, зокрема того, що прийнято називати законом збереження енергії.
Ви можете запитати: «якщо дві різні теорії, одні і ті ж події пояснюють по різному, то чи не означає це, що бодай одна з них є хибною?» Ні, не означає. Бо правильність чи неправильність теорії визначається не тим, подобається нам ця теорія чи не подобається. І навіть не тим, розуміємо ми її чи не розуміємо. Правильність чи неправильність теорії визначається тим, співпадають її передбачення з результатами відповідних експериментів чи не співпадають. І якщо передбачення теорії в точності співпадають з результатами експериментів, то ця теорія є науковою і правильною. А якщо не співпадають – то ми маємо справу з чим завгодно, тільки не з тим що прийнято називати науковою теорією. І в цьому сенсі як молекулярна фізика так і термодинаміка є безумовно науковими та безумовно достовірними теоріями. Адже всі передбачення кожної з них, в точності співпадають з результатами відповідних експериментів, при цьому не існує жодного експериментального факту який би суперечив цим теоріям. Звичайно в межах достовірності відповідних теорій.
Та як би там не було, а молекулярна фізика і термодинаміка, це дві абсолютно різні науки. Ці науки відрізняються не лише своїми базовими твердженнями, а й тими методами наукових досліджень які складають їх методологічну основу. Загалом, розрізняють три базових методи наукових досліджень: динамічний (або механічний), статистичний та термодинамічний. Скажімо, вивчаючи механіку ми практично завжди застосовували так званий динамічний метод досліджень. Суть цього методу полягає в тому, що знаючи початкові параметри руху тіл та ті закони за якими вони рухаються і взаємодіють, однозначно визначають параметри руху відповідних тіл в будь який момент часу. Наприклад, якщо дві пружні кульки відомих мас і відомих швидкостей, рухаються назустріч одна одній, то на основі законів ньютонівської механіки можна однозначно передбачити поведінку цих кульок як до так і після їх взаємодії.
Ясно, що застосувати динамічний метод досліджень до системи яка складається з мільярдів трильйонів молекул, практично не можливо. І не тільки тому, що цих молекул надто багато. А й тому, що самі молекули, це надзвичайно складні системи, поведінка яких описується не менш складними законами квантової механіки. Зважаючи на ці обставини, в молекулярній фізиці застосовують статистичний метод досліджень, тобто такий метод наукових досліджень при якому поведінку складної системи описують на основі відомих законів механіки та статистично усереднених параметрів окремих елементів цієї системи.
Скажімо в молекулярній фізиці ми говорили не про швидкість окремо взятої молекули, не про її кінетичну та потенціальну енергію, а про певним чим усереднену швидкість молекул, про їх середню кінетичну енергію, середню потенціальну енергію, тощо. При цьому, на основі цих усереднених характеристик молекул, та базі законів ньютонівської механіки, ми успішно пояснили широке коло тих явищ які є предметом вивчення молекулярної фізики.
Але виявляється, що поведінку складної системи можна спрогнозувати і не говорячи про її внутрішню будову. Наприклад не говорячи про те що тіла складаються з молекул. Таке прогнозування здійснюють на основі термодинамічного методу досліджень. Суть цього методу полягає в тому, що поведінку складної системи описують на основі тих параметрів які характеризують цю систему вцілому та тих законів які відображають взаємопов’язаність цих параметрів. Наприклад, охарактеризувавши стан певної маси газу (m=const) його об’ємом (V), тиском (р) та температурою (Т) і визначивши ті зв’язки що існують між цими величинами, не важко визначити відповідні параметри газу в тій чи іншій конкретній ситуації. При цьому не важливо знаєте ви про те що гази складаються з молекул, чи не знаєте. Розумієте що тиск, це усереднений результат ударів молекул чи не розумієте. Важливо лише те, що вам відомо: для постійної маси газу виконується співвідношення рV/T = const. А знаючи це співвідношення ви можете визначити параметри газу в тій чи іншій конкретній ситуації. Саме такий підхід і реалізується в термодинаміці.
В межах програми загальноосвітньої школи, переважна більшість тих явищ що є предметом вивчення термодинаміки, вивчається та пояснюється в молекулярній фізиці. Головна перевага молекулярної фізики в її наочності, а отже зрозумілості. Адже в молекулярній фізиці кожен об’єкт, кожну фізичну величину і кожне явище можна представити у вигляді певних наочних образів. Наприклад, молекули можна представити у вигляді пружних кульок; температуру – можна представити як міру середньої кінетичної енергії хаотичного руху молекул; тиск – як усереднений результат ударів молекул; пароутворення – як процес вильоту молекул з рідини і т.д.
Якщо ж говорити про термодинаміку, то ця наука є менш наочною і тому менш зрозумілою. Однак не потрібно думати, що термодинаміка чимось гірша за молекулярну фізику. Зовсім ні. Більше того. В певному сенсі, термодинаміка є більш точною і більш загальною наукою. Адже її висновки та передбачення отримують без використання спрощених моделей на кшталт ідеальний газ, ідеальна рідина, кристалічна решітка, тощо. Молекулярна ж фізика, обійтись без таких моделей не може.
Об’єктивно сильною і в той же час суб’єктивно слабкою стороною термодинаміки є те, що до вирішення поставлених задач вона підходить виключно з формально математичних позицій. В термодинаміці не важливо на скільки добре ви розумієте суть того що називаєте речовиною, теплотою, температурою, тиском, внутрішньою енергією чи ентропією. В термодинаміці важливо знати її базові аксіоми і вміти на основі цих аксіом та математичного аналізу, отримувати формальні рішення конкретних задач. Такий підхід дозволяє одержувати точні, достовірні результати, що є безумовним плюсом термодинаміки. В той же час, подібний формалізм позбавляє термодинаміку наочності і зрозумілості, що є безумовним недоліком цієї науки. Позбавитись цього недоліку можна в тому випадку, якщо формальну логіку термодинаміки доповнити наочністю молекулярної фізики. Тому, вивчаючи термодинаміку важливо пам’ятати, що як би там не було, а речовини все таки складаються з молекул які рухаються і взаємодіють між собою. Бо подобається нам чи не подобається а речовини влаштовані саме так.
Контрольні запитання.
1.Чим схожі та чим відрізняються молекулярна фізика і термодинаміка?
2. Як склалося так, що для пояснення однієї і тієї ж групи явищ, було створено дві різні науки?
3. Якщо молекулярна фізика і термодинаміка по різному пояснюють одні і ті ж явища, то чи не означає це, що пояснення однієї з цих наук з хибними? Чому?
4. Чому в межах шкільної програми властивості речовин пояснюють головним чином на основі молекулярної фізики а не термодинаміки?
5. Поясніть суть динамічного методу досліджень.
6. Поясніть суть статистичного методу досліджень.
7. Поясніть суть термодинамічного методу досліджень.
8. Чим схожі і чим відрізняються динамічний і статистичний методи досліджень?
9. Чим схожі і чим відрізняються статистичний і термодинамічний методи досліджень?
.
§2. Перше начало термодинаміки.
Закон збереження енергії, це фундаментальний закон Природи, який виконується у всіх відомих фізичних, хімічних, біологічних та інших процесах. При цьому, в різних розділах сучасної науки ви можете зустріти велике різноманіття на перший погляд різних, а по суті споріднених законів, які є прямими або опосередкованими формулюваннями закону збереження енергії. Наприклад, золоте правило механіки, закон Бернуллі, рівняння теплового балансу, другий закон Кірхгофа, перше начало термодинаміки, рівняння Ейнштейну для фотоефекту, це певні формулювання або опосередковані наслідки одного і того ж закону – закону збереження енергії. Закону в якому стверджується: При будь яких процесах, що відбуваються в замкнутій системі, загальна кількість енергії цієї системи, залишається незмінною, тобто зберігається. Іншими словами: ∑Едо = ∑Епісля (загальна кількість енергії до події, дорівнює загальній кількості енергії після події).
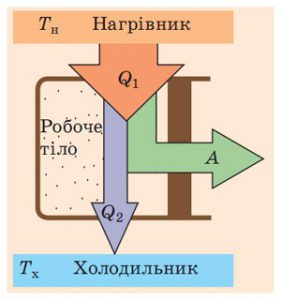
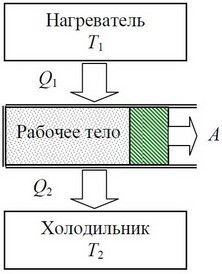
В термодинаміці, закон збереження енергії прийнято формулювати у вигляді першого начала (закону) термодинаміки. В цьому законі стверджується: Надана системі теплота (Q) частково йде на збільшення внутрішньої енергії системи (∆U), а частково, на виконання нею механічної роботи(А). Іншими словами: Q=∆U+A.
В науково-технічній практиці, той об’єкт який отримавши теплову енергію виконує механічну роботу, часто називають робочим тілом. Зважаючи на ці обставини, перше начало термодинаміки можна сформулювати наступним чином. Надана робочому тілу теплова енергія Q, частково йде на збільшення внутрішньої енергії робочого тіла ∆U (тобто на його нагрівання, плавлення, випаровування, тощо), а частково – на виконання ним певної механічної роботи А (на розширення робочого тіла). Наприклад, якщо газу що знаходиться під рухомим поршнем циліндру (мал.2) надати певну кількість теплоти (Q), то ця теплота частково піде на нагрівання газу, тобто на збільшення його внутрішньої енергії (∆U=Qн=cm∆t), а частково на розширення газу, тобто на виконання ним механічної роботи (А). При цьому буде виконуватись співвідношення Q=∆U+A.
Мал.2. Надане робочому тілу тепло (Q) частково йде на збільшення його внутрішньої енергії (∆U), а частково на виконання ним механічної роботи (А).
Співвідношення Q=∆U+A виконується в незалежності від того, яка речовина знаходиться в циліндрі умовної теплової машини. В незалежності від її хімічного складу, агрегатного стану чи будь яких інших властивостей. Це співвідношення виконується і в тому випадку, коли робоче тіло не отримує теплову енергію, а навпаки – втрачати її. Просто в цьому випадку, внутрішня енергія робочого тіла не збільшується, а зменшується і виконана ним механічна робота буде від’ємною, тобто такою яка виконана не робочим тілом, а над ним.
Оскільки в термодинаміці загалом і в першому началі термодинаміки зокрема, важливою дійовою особою є механічна робота, то буде не зайвим нагадати. Робота – це фізична величина, яка характеризує затрати енергії на виконання роботи, тобто певної енергозатратної дії і яка дорівнює цим затратам.
Позначається: А
Визначальне рівняння: А=ΔЕ
Одиниця вимірювання: А=Дж, джоуль.
Формула А=ΔЕ є базовим, визначальним рівнянням роботи. Однак, якщо мова йде про механічну роботу, то її зазвичай визначають за формулою А=Fℓcosα, де F – усереднена величина тієї сили що виконує роботу, ℓ – величина того переміщення яке відбувається при виконанні роботи, α – кут між напрямком вектора сили (F) та напрямком вектора переміщення (ℓ). Якщо напрям тієї сили що виконує роботу співпадає з напрямком переміщення тіла (α=0°; cos0°=1), то величина виконаної силою роботи визначається за спрощеною формулою А=Fℓ.
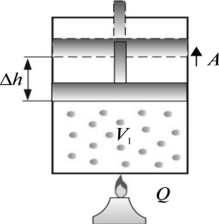
Не важко довести, що при ізобаричному розширенні газу (m=const, p=const), величина виконаної ним механічної роботи, визначається за формулою A=pΔV, де р – тиск газу, ΔV – зміна об’єму газу. Дійсно.
Задача 1. В процесі ізобаричного нагрівання, об’єм газу збільшився на ΔV. Визначити виконану газом механічну роботу.

Дано:
m=const
p=const
ΔV
Амех = ?
Рішення: За визначенням А= F·Δh.Оскільки в умовах даної задачі, тією силою яка виконує роботу є сила тиску газу, та враховуючи, що р = F/S, а отже F = pS, можна записати А = F·Δh = pSΔh = pΔV.
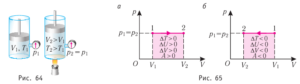
Загальні зауваження. Формула А=pΔV справедлива при будь якому ізобаричному (m=const, p=const) розширенні газу. Наприклад, якщо в процесі ізобаричного нагрівання повітря, частина цього повітря об’ємом ΔV була виштовхнута з вашої кімнати, то виконана при цьому механічна робота становитиме А=pΔV. Більше того, формула А=pΔV буде справедливою не лише при ізобаричному розширенні газу (ΔV>0), а й при його ізобаричному стисненні (ΔV<0). Просто в цьому випадку робота буде не додатною а від’ємною (газ протидіє його стисненню і тому виконує від’ємну роботу.
Буде не зайвим нагадати, що в залежності від того з яких молекул складається газ (ідеальний газ), величину його внутрішньої енергії U, а відповідно і зміни цієї енергії ΔU, можна визначити за однією з наступних формул:
– для одноатомних молекул U = 1,5νRT або U = 1,5pV;
– для двохатомних молекул U = 2,5νRT або U = 2,5pV;
– для трьох і більше атомних молекул U = 3,0νRT або U = 3,0pV.
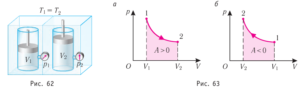
Знаючи фізичну суть того, що називають внутрішньою енергією тіла (U), кількістю теплоти (Q) та механічною роботою (А), дослідимо перше начало термодинаміки в ситуації, коли тим робочим тілом яке знаходиться в циліндрі умовної теплової машини є газ (а точніше – ідеальний газ), а тими процесами які відбуваються з газом є ізотермічний (m=const, T=const), ізобаричний (m=const, p=const) та ізохоричний (m=const, V=const) процеси.
Ізохоричний процес (m=const, V=const). Оскільки при ізохоричному процесі об’єм газу залишається незмінним (V=const, ΔV=0), то при будь яких змінах інших параметрів газу, зокрема при його нагрівання або охолодженні, виконана газом механічна робота дорівнюватиме нулю: A=pΔV=p·0=0. При цьому перше начало термодинаміки Q=∆U+A набуває вигляду Q=∆U. А це означає: а) якщо при ізохоричному процесі газ отримує теплову енергію (нагрівається), то його внутрішня енергія відповідно збільшується, тобто Q→ΔU; б) якщо при ізохоричному процесі газ віддає теплову енергію (охолоджується), то його внутрішня енергія відповідно зменшується, тобто ΔU→Q. В координатах тиск–об’єм (р–V), ізохоричному процесу відповідає певна ізохора (мал.3), яка представляє собою направлений вертикальний відрізок: а) газ отримує теплову енергію, б) газ втрачає теплову енергію.
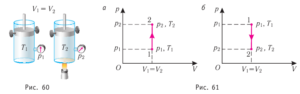
Мал.3. Ізохоричний процес та йому відповідні ізохори: а) при нагріванні газу, б) при охолодженні газу.
Ізобаричний процес (m=const, р=const). Оскільки при ізобаричному процесі об’єм газу змінюється (збільшується ΔV>0, або зменшується ΔV<0), то при будь яких змінах інших параметрів газу, зокрема при його нагріванні або охолодженні, виконується певна додатна або від’ємна робота. При цьому загальний вигляд першого начала термодинаміки Q=∆U+A залишається незмінним. А це означає: а) якщо при ізобаричному процесі газ отримує теплову енергію (нагрівається), то частина цієї енергії йде на збільшення його внутрішньої енергії, а частина на виконання ним певної механічної роботи, тобто Q→ΔU+А; б) якщо при ізобаричному процесі газ віддає теплову енергію (охолоджується), то це відбувається як за рахунок зменшення його внутрішньої енергії, так і за рахунок виконання ним від’ємної механічної роботи (в процесі охолодження об’єм газу зменшується, при цьому виділяється певна кількість теплоти), тобто ΔU+A→Q. В координатах тиск–об’єм (р–V), ізобаричному процесу відповідає певна ізобара (мал.4), яка представляє собою направлений горизонтальний відрізок: а) газ отримує теплову енергію, б) газ втрачає теплову енергію.
Мал.4. Ізобаричний процес та йому відповідні ізобара: а) при нагріванні газу, б) при охолодженні газу.
Оскільки при ізобаричному процесі величина виконаної газом механічної роботи визначається за формулою A=pΔV, то в системі координат p–V, величина цієї роботи дорівнює площі того прямокутника, який обмежений ізобарою 1→2, віссю 0–V та проведеними з країв ізобари вертикальними відрізками. При цьому: при ізобаричному розширенні газу (ΔV>0), виконана ним робота є додатною (А>0), а при ізобаричному стисненні (ΔV<0) – від’ємною (А<0).
Ізотермічний процес (m=const, Т=const). Оскільки при ізотермічному процесі температура газу залишається незмінним (Т=const, ΔТ=0), то при будь яких змінах інших параметрів газу, зокрема при його стисненні або розширенні, величина внутрішньої енергії газу залишається незмінною (оскільки Т=const, то U=const, а отже ΔU=0). При цьому перше начало термодинаміки Q=∆U+A набуває вигляду Q=А. А це означає: а) якщо отримуючи теплову енергію, газ ізотермічно розширюється, то вся надана йому енергія йде на виконання механічної роботи, тобто Q→А; б) якщо під дією зовнішньої сили, газ ізотермічно стискається і одночасно з цим віддає навколишньому середовищу отриману за рахунок стиснення енергію, то виконана над газом механічна робота, повністю перетвориться на теплову енергію навколишнього середовища, тобто А→Q. В координатах тиск–об’єм (р–V), ізотермічному процесу відповідає певна ізотерма (мал.5): а) – газ отримує теплову енергію, б) – газ втрачає теплову енергію.
Мал.5. Ізотермічний процес та йому відповідні ізотерми: а) при розширенні газу, б) при стисненні газу.
Не важко довести, що в системі координат p–V, величина тієї роботи яку виконує газ при його ізотермічному розширенні або стисненні, дорівнює площі тієї фігури яка обмежена ізотермою 1→2, віссю 0–V та проведеними з країв ізотерми вертикальними відрізками. При цьому: при ізотермічному розширенні газу (ΔV>0), виконана ним робота є додатною (А>0), а при ізотермічному стисненні (ΔV<0) – від’ємною (А<0). Дійсно, якщо геометричну фігуру V1–1–2–V2 (мал.6) розбити на велику кількість дрібних вертикальних фрагментів, то зміною тиску на кожному з них можна знехтувати. А це означає, що у відповідності з формулою ΔA=pΔV, величина елементарної роботи ΔА дорівнюватиме площі відповідного елементарного прямокутника. Загальна ж площа цих прямокутників, а отже і площа фігури V1–1–2–V2 дорівнюватиме тій загальній роботі яка була виконана при відповідному ізотермічному процесі.
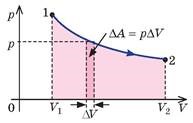

Мал.6. В системі координат р–V величина механічної роботи дорівнює площі відповідної геометричної фігури.
Аналізуючи ізотермічний процес, ми дійшли висновку, що у відповідності з першим началом термодинаміки при ізотермічному розширенні газу, вся надана йому теплова енергія Q повністю перетворюється на механічну роботу Q=A. Однак, якщо ви дійсно спробуєте провести відповідний експеримент, то неодмінно з’ясуєте, що здійснити тепловий процес при якому все надане системі тепло повністю перетворилось би в механічну роботу неможливо. Ви можете робити все що завгодно, придумувати будь які хитромудрі схеми, але повністю перетворити надану системі теплову енергію в механічну роботу ви не зможете. Не зможете тому, що в Природі діє один надзвичайно важливий закон який називається другим началом термодинаміки. В цьому законі стверджується: неможливо здійснити такий тепловий процес при якому все надане системі тепло, повністю перетворилось би в механічну роботу. Втім, про суть та значимість другого начала термодинаміки ми поговоримо дещо пізніше. На разі ж, розв’яжемо декілька задач, які стосуються першого начала термодинаміки та теплових процесів загалом.
Задача 2. Ідеальний газ із стану 1 в стан 2 може переходити трьома представленими на діаграмі р–V шляхами (мал.а). Визначте при якому переході виконана газом робота буде: а) найбільшою, б) найменшою.
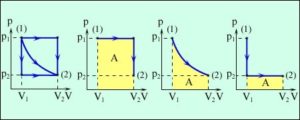
Рішення. Будемо виходити з того, що робота газу чисельно дорівнює площі фігури обмеженої графіком залежності тиску від об’єму, віссю 0V та вертикальними прямими, які відповідають значенням об’єму V1 і V2. Проаналізувавши кожний шлях переходу (мал.б,в,г), можна стверджувати, що при переході (б) виконана газом робота буде найбільшою, а при переході (г) – найменшою.
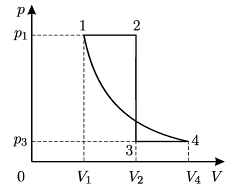
Задача 3. За заданою р–V діаграмою визначте яку роботу виконує газ при переході з стану 1 до стану 3?
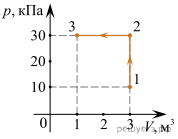
Рішення. На ділянці 1→2, ΔV=0 і тому A12=pΔV=0Дж.
На ділянці 2→3, ΔV=1м3–3м3= –2м3 і тому A23=pΔV=30·103Па·(–2м3)= –60·103Дж, де знак «–» вказує на те, що газ виконує від’ємну роботу (на ділянці 2→3 газ ізобарично стискається і тому протидіє цьому стисненню).
Загальні зауваження. Факт того, що на ділянці 1→2 газ не виконує механічну роботу (A=0), зовсім не означає що на цій ділянці не відбуваються певні енергетичні події. Дійсно, оскільки на ділянці 1→2 відбувається ізохоричне стиснення газу (V=const, p↑), то у відповідності з об’єднаним газовим законом (pV/T=const) на цій ділянці неминуче відбувається нагрівання газу(T↑). При цьому у відповідності з першим началом термодинаміки (Q=ΔU+A) надана газу теплова енергія йде на збільшення внутрішньої енергії газу. Іншими словами, на ділянці 1→2: V=const, p↑, Т↑, ΔU↑, А=0.
Задача 4. За заданою р–V діаграмою ідеального одноатомного газу, визначте яку кількість теплоти отримав або віддав цей газ при переході із стану 1 до стану 3?
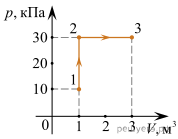
Рішення. На ділянці 1→2: V=const, р↑, оскільки рV/T=const, то Т↑. Оскільки ΔV=const, то А=рΔV=0. Таким чином, оскільки на ділянці 1→2 температура газу зростає, то на цій ділянці він отримує певну кількість енергії Q12, яка повністю йде на збільшення внутрішньої енергії газу (адже А=0), тобто Q12=ΔU12.
Оскільки для одноатомного газу U=1,5νRT, або U = 1,5pV, та зважаючи на те, що на ділянці 1→2 V=const, то ΔU = 1,5VΔр. Тому Q12=ΔU12= 1,5V12(р2 – р1)= 1,5·1(30·103 – 10·103)= 30·103Дж.
На ділянці 2→3: р=const, V↑, оскільки рV/T=const, то Т↑. Оскільки ΔV=3м3 – 1м3=2м3, то А23=рΔV=30·103·2=60·103Дж=60кДж.
Оскільки на ділянці 2→3 газ по перше нагрівається (Т↑), а по друге виконує механічну роботу (А>0), то це означає, що газ отримує певну кількість енергії Q23. При цьому у відповідності з першим началом термодинаміки Q23=ΔU23+A23.
Оскільки для одноатомного газу U=1,5νRT, або U = 1,5pV, та зважаючи на те, що на ділянці 2→3 р=const, то ΔU23 = 1,5рΔV= 1,5р23(V3 – V2)= 1,5·30·103(3 – 1)= 90·103Дж.
Q23=ΔU23+A23 = 90·103+60·103 = 150·103Дж =150кДж
У підсумку: Q = Q12 + Q23 = 30кДж + 150кДж = 180кДж.
Контрольні запитання.
1. Що стверджується в законі збереження енергії.
2. Що спільного між першим началом термодинаміки та рівнянням теплового балансу? Який з цих законів є більш загальним?
3. Якого вигляду набуває перше начало термодинаміки при теплообміні?
4. За якими формулами можна визначити величину виконаної роботи? Яка з цих формул є найбільш загальною?
5. На що йде надана газу теплова енергія при: а) ізохоричному процесі; ізотермічному процесі; в) ізобаричному процесі?
6. При якому ізопроцесі внутрішня енергія робочого тіла залишається незмінною?
7. В якому випадку виконана газом робота є додатною, а в якому – від’ємною?
8. Як ви думаєте, чому механічна робота легко і повністю перетворюється на теплоту, а теплота, якщо і перетворюється в механічну роботу то лише за певних умов і не повністю?
Вправа 32.
1. За заданими р–V діаграмами (мал. а, б), визначте яку роботу виконує газ при переході з стану 1 до стану 3?
а)  б)
б) 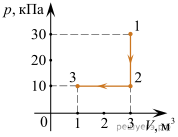
2. За заданими р–V діаграмами (мал. а – г), визначте яку роботу виконує газ при переході з стану 1 до стану 2?
3. Ідеальний газ здійснив зображені на малюнках (а) і (б) циклічні процеси. Визначте виконану газом роботу на кожній ділянці циклу та загальну роботу.
а) 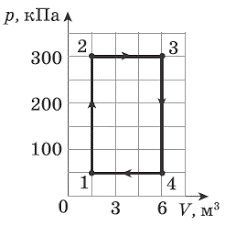 б)
б) 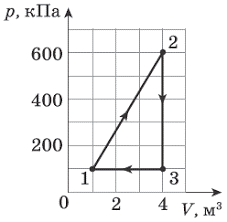
4. За заданою р–V діаграмою ідеального одноатомного газу визначте яку кількість теплоти отримав або віддав цей газ при переході із стану 1 до стану 3?

5. Яку роботу виконає газ масою m та молярною масою М при його ізобаричному нагріванні на ΔТ кельвінів?
6. За нормального атмосферного тиску, температура повітря 0°С, а його об’єм 20м3. Яку роботу виконає це повітря при його ізобаричному нагріванні на 17°С?
7. В циліндрі під поршнем знаходиться 25г повітря. Для його нагрівання на 40ºС при постійному тиску витратили 1кДж теплоти. На скільки змінилась внутрішня енергія повітря. Молярна маса повітря 0,029кг/моль.
.
§33. Термодинамічні процеси. Адіабатичні та кругові процеси.
В термодинаміці стан того чи іншого макрооб’єкту (термодинамічної системи), характеризують певним набором фізичних величин, які називаються термодинамічними параметрами, або параметрами термодинамічного стану системи. До числа термодинамічних параметрів відносяться температура, тиск, об’єм, внутрішня енергія, ентропія, ентальпія, тощо.
Дослідження показують, що при зміні будь якого термодинамічного параметру системи, автоматично змінюються інші її параметри. Наприклад змінюючи об’єм певної маси газу, ми автоматично змінюємо його тиск та температуру. Змінюючи температуру газу, ми автоматично змінюємо його тиск, або об’єм, або те та інше одночасно. Закон який відображає ті зв’язки які об’єктивно існують між параметрами термодинамічної системи називається рівнянням стану термодинамічної системи. Наприклад для газів рівняння стану можна записати у вигляді гранично простого співвідношення pV/T=const або pV/T=(m/M)R. Якщо ж говорити про тверді та рідкі макрооб’єкти, то зв’язок між їх основними термодинамічними параметрами є більш складним.
Будь яка термодинамічна система природним чином прагне знаходитись в стані термодинамічної рівноваги, тобто такому стані, при якому значення її термодинамічних параметрів в усіх точках системи однакові. Наприклад якщо у всьому об’ємі газу, значення температури, тиску, густини та інших параметрів однакові, то газ знаходиться в стані термодинамічної рівноваги. Якщо ж цей газ нагрівають, охолоджують, стискають, розширюють чи скажімо змінюють його кількість, то рівновага газу порушується. Адже в місті нагрівання, розширення чи витікання газу, його термодинамічні параметри відрізняються від їх величини в інших місцях. Однак після того як зовнішній вплив на газ припиняється, він досить швидко знову приходить до стану термодинамічної рівноваги, але вже з іншими значеннями температури, тиску, густини, внутрішньої енергії, тощо.
Процеси при яких відбувається зміна тих чи інших термодинамічних параметрів системи, називаються термодинамічними або тепловими процесами. Все різноманіття теплових процесів можна розділити на дві групи: 1) Процеси при яких стрибкоподібно та суттєво змінюються певні фізичні властивості речовини. Такі процеси називаються фазовими переходами. До їх числа відносяться переходи речовини з одного агрегатного стану в інший, а також різноманітні фазові переходи в межах одного і того ж агрегатного стану. 2) Процеси при яких змінюються лише числові (кількісні) параметри системи, але склад, структура та агрегатний стан речовини залишаються незмінними. Такі процеси відбуваються при стисненні та розширенні тіл, при їх нагріванні та охолодженні, при зміні кількості речовини в системі, тощо.
Вивчаючи молекулярну фізику, ми ознайомились з багатьма тепловими процесами. Наприклад ми знаємо що відбувається при плавленні і кристалізації, при пароутворенні і конденсації, при нагріванні та охолодженні. Знаємо, що процеси при яких маса речовини та один з її основних термодинамічних параметрів (p,V,T) залишаються незмінними, називаються ізопроцесами. Що для газів, ізопроцеси можна представити у вигляді простих математичних співвідношень, і що ці співвідношення можна представити графічно у вигляді відповідних ізотерм, ізобар та ізохор. Іншими словами, про теплові процеси ми знаємо багато. Багато, але далеко не все. Наприклад нам не доводилося говорити про так звані адіабатичні процеси, тобто такі процеси які відбуваються без теплообміну з навколишнім середовищем. З’ясовуючи характерні особливості адіабатичного процесу, розглянемо поведінку того газу що знаходиться в циліндрі під поршнем.
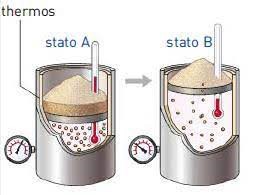
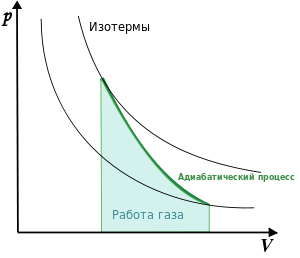
Мал.7. Величина тієї роботи яку виконує газ при його ізотермічному та адіабатичному стисненні (розширенні) є різною.
Якщо той газ що знаходиться під поршнем ізотермічно стискати, наприклад шляхом поступового накладання на поршень піску, то у відповідності з законом Бойля–Маріотта (pV=const), тиск газу буде збільшуватись. При цьому зовнішні сили виконають роботу величина якої дорівнює площі трапеції обмеженої ізотермою, віссю 0V та тими вертикальними прямими які відповідають початковому V1 та кінцевому V2 значенням об’єму газу.
Оскільки будь яке стиснення неминуче призводить до виділення теплоти, то ясно, що забезпечуючи ізотермічне стиснення газу, потрібно відводити від нього певну кількість теплової енергії. Якщо ж в процесі стиснення, теплову енергію не відводити, а саме це передбачає адіабатичний процес, то температура газу буде збільшуватись, що неминуче призведе до відповідно більш стрімкого зростання тиску. А це означає, що для адіабатичного стиснення газу потрібно більше енергетичних затрат аніж для аналогічного за об’ємом стиснення ізотермічного. І навпаки, при адіабатичному розширенні газу, газ виконує більше механічної роботи аніж при відповідному термодинамічному розширенні. Більшу на величину різниці площ адіабатичної та ізотермічної трапецій.
Важливою характеристикою будь якого процесу є його оборотність. В термодинаміці оборотним називають такий процес який в прямому і зворотному напрямку проходить одну і ту ж послідовність станів, при цьому так, що в кінці кожного циклу не лише термодинамічна система, а й всі пов’язані з нею об’єкти повертаються до початкового стану. Загалом, практично всі природні процеси, в тій чи іншій мірі необоротні. Однак в багатьох випадках їх необоротність є незначної і тому їх вважають практично оборотними. Прикладом практично оборотного механічного процесу є коливання нитяного маятника. Якщо ж говорити про теплові процеси, то ідеалізованим прикладом такого процесу є повільний адіабатичний процес.
Уявіть собі виготовлений із ідеального теплоізоляційного матеріалу ідеальний циліндр, в якому під ідеальним поршнем знаходиться ідеальний газ. Припустимо, що в початковий момент часу, газ має параметри р1V1T1. Поступово навантажуючи поршень дрібними порціями піску, ми будемо поступово змінювати параметри газу до тих пір, поки вони не досягнуть певної кінцевої величини р2V2T2. Здійснюючи зворотний процес, тобто поступово розвантажуючи поршень, ми змусимо газ розширюватись. І якщо режими навантаження та розвантаження поршня будуть симетричними, то в процесі розширення газ пройде ті ж стадії що і при стисненні. У підсумку і газ і пісок повернуться до початкового стану. А це означає, що відповідний процес є оборотним.

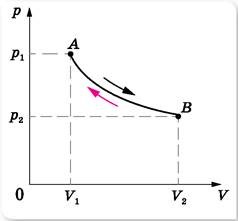
Мал.8. Ідеалізований адіабатичний процес, як приклад примусово–оборотного теплового процесу.
Звичайно, в даному випадку можна говорити лише про певний умовно оборотний процес. І не лише тому, що в реальній ситуації неминучими є втрати на тертя та теплообмін з навколишнім середовищем. А ще й тому, що пісок сам собою не навантажується і не розвантажується. А це означає, що процес «навантаження – розвантаження» потребує певних енергетичних затрат, а отже і певних змін в навколишньому світі. Тому коли ми стверджуємо, що той чи інший тепловий процес є оборотним, то маємо на увазі, що він не тільки наближено оборотний, а й примусово оборотний.
Оборотні процеси є частковим випадком більш загального класу термодинамічних процесів, які називаються круговими або циклічними процесами. Круговий процес (циклічний процес, цикл), це такий процес при якому термодинамічна система після певних змін повертається до початкового положення, при цьому не обов’язково, щоб в прямому та зворотньому напрямку процес відбувався однаково. Для кругового процесу важливо одне – після завершення циклу, система має повернутися до початкового стану. При кругових процесах допускається також будь які зміни в навколишньому світі. А це означає що круговий тепловий процес може відбуватися під дією зовнішніх чинників. Наприклад той адіабатичний процес який відбувався за рахунок навантаження та розвантажування піску, є круговим.
Певні кругові теплові процеси ми розглядали в §12 (Розв’язування задач. Тема: Теплові процеси в графіках). Тому буде не зайвим, ба навіть необхідним, повторити вивчене в тому параграфі. Наразі ж розглянемо теплові процеси з точки зору тих енергетичних подій які відбуваються в ході цих процесів. І розглянемо на прикладі конкретних задач (конкретних ситуацій близький до практичного застосування).
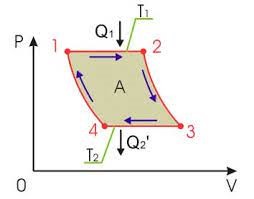
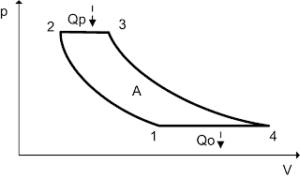
Задача 1. Під рухомим поршнем циліндру знаходиться газ, з яким відбуваються круговий процес графік якого представлено на малюнку. Опишіть цей процес на кожній ділянці з точки зору енергетичних подій (криві 1–2 і 3–4 є ізотермами).
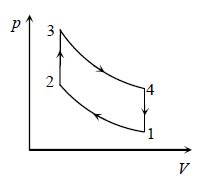
Рішення. Аналізуючи представлений на малюнку круговий процес, можна сказати наступне.
На ділянці 1 – 2 під дією певної зовнішньої сили відбувається ізотермічне стиснення газу (Т=const, V↓, p↑). При цьому зовнішні сили виконують певну механічну роботу. А оскільки процес стиснення газу є ізотермічним, то це означає, що в процесі такого стиснення, частина наданої газу енергії віддається навколишньому середовищу (охолоджувачу).
На ділянці 2 – 3 під дією зовнішньої сили відбувається ізохоричне стиснення газу (Т↑, р↑, V=const). При цьому зовнішні сили виконують певну механічну роботу, яка йде на збільшення внутрішньої енергії газу (на збільшення температури і тиску).
На ділянці 3 – 4 сильно нагрітий та сильно стиснений газ ізотермічно розширюється (Т=const, V↑, p↓). При цьому газ виконує певну механічну роботу. А оскільки процес розширення газу є ізотермічним, то це означає, що в процесі такого розширення, газ має отримувати певну кількість додаткової теплової енергії від стороннього джерела (нагрівника).
На ділянці 4 – 1 сильно нагрітий але втративший значну частину тиску газ продовжує розширюватись, але вже ізохорично (Т↓, р↓, V=const). При цьому газ за рахунок зменшення своєї внутрішньої енергії (зменшення температури і тиску) виконує певну механічну роботу.
Вище описаний тепловий процес має ту практично важливу особливість, що в ньому кількість тієї механічної роботи яка була витрачена на стиснення газу, є значно меншою за ту кількість механічної роботи яку отримують в процесі розширення газу. Звичайно, це не означає, що ця робота була отримана так би мовити з нічого (безкоштовно). Джерелом цієї роботи є та теплова енергія яку отримав газ від стороннього джерела (нагрівника) на етапі свого ізотермічного розширення (ділянка 3 – 4).
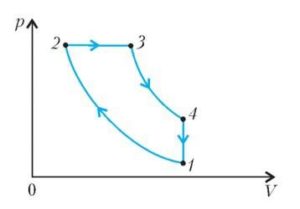
Задача 2. За заданою р–V діаграмою ідеального двохатомного газу, визначте яку кількість теплоти отримав або віддав цей газ на кожній ділянці переходу 1→2→3→1. Якою є загальна кількість цієї теплоти?
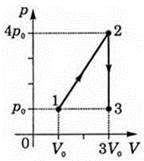
Рішення. Керуючись першим началом термодинаміки Q=ΔU+A, визначаємо кількість тієї теплоти яку отримує (+Q) або втрачає (–Q) робоче тіло на кожній ділянці заданого циклу.
Ділянка 1→2: V↑, p↑, оскільки pV/T=const, то T↑. А це означає:
1) А12=pΔV=0, на ділянці 1→2 усереднена величина тиску р=(р0+4р0)/2=2,5р0, тому А12=pΔV=2,5р0·2V0= 5p0V0;
2) ΔU12=U2 – U1 = 2,5p2V2 – 2,5p1V1= 2,5(4p03V0 – p0V0)= 27,5p0V0;
+Q12 = ΔU12 + A12 = 27,5p0V0 + 5p0V0 = 32,5p0V0;
Ділянка 2→3: V=const, p↓, оскільки pV/T=const, то T↓. А це означає:
1) А34=pΔV=0;
2) ΔU34=2,5VΔp=2,5·3V0(–3p0) = –22,5p0V0;
–Q12 = ΔU34 + A34 = 22,5p0V0.
Ділянка 3→1: V↓, p=const, оскільки pV/T=const, то T↓. А це означає:
1) А23=pΔV=p0·(–2)V0 = –2p0V0;
2) ΔU23=2,5pΔV=2,5·p0·(–2)V0= –5p0V0.
–Q23 = ΔU23 + A23 = –5p0V0 –2p0V0 = –7p0V0.
Таким чином загальний тепловий баланс процесу:
Q = 32,5p0V0 –22,5p0V0 –7p0V0 = 3p0V0.
Загальні зауваження. Буде не зайвим вкотре нагадати, що розв’язуючи задачі термодинаміки потрібно спиратись на наступні базові формули:
1. Рівняння стану ідеального газу (об’єднаний газовий закон):
pV/T=const, або pV/T=νR, де ν=m/M, R=8,31Дж/К·моль.
2. Формули для визначення внутрішньої енергії ідеального газу:
– для одноатомних молекул U = 1,5νRT або U = 1,5pV;
– для двохатомних молекул U = 2,5νRT або U = 2,5pV;
– для трьох і більше атомних молекул U = 3,0νRT або U = 3,0pV.
3. Перше начало термодинаміки:
Q = ΔU + A, де A=pΔV.
Контрольні запитання.
1. Назвіть ті теплові процеси які вивчалися в молекулярній фізиці.
2. На які дві групи можна розділити все різноманіття теплових процесів? Наведіть приклади.
3. Що називають рівнянням стану термодинамічної системи? Наведіть приклади.
4. Що називають термодинамічною рівновагою системи?
5. Який процес називають: а) ізотермічним, б) ізобаричним, в) ізохоричним, г) адіабатним?
6. Поясніть, чому адіабатне стиснення газу потребує більших енергетичних затрат аніж відповідне ізотермічне стиснення?
7. При якому розширенні адіабатичному чи ізотермічному газ виконує більшу роботу? Чому?
8. Чим відрізняються зворотні та кругові (циклічні) процеси? Який з цих процесів є більш загальним?
Вправа 33.
1. Ідеальний газ здійснив зображені на малюнках (а) і (б) кругові процеси. Визначте виконану газом роботу на кожній ділянці циклу та загальну роботу.
а) 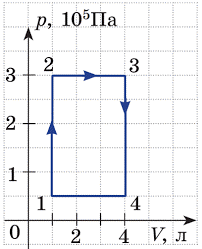 б)
б) 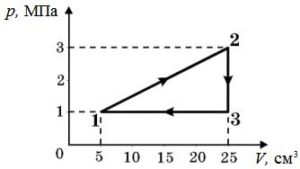
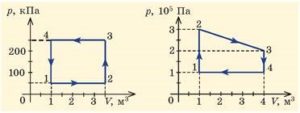
2. На малюнку представлені діаграми двох кругових теплових процесів. Опишіть ці процеси на кожній ділянці. Визначте величину виконаної газом роботи. Якою є ця робота: додатною чи від’ємною?
3. На малюнку представлені діаграми кругових теплових процесів. Опишіть ці процеси на кожній ділянці. Додатню чи від’ємну роботу виконує газ в кожному з процесів?
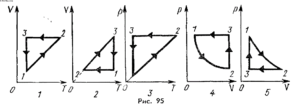
4. Під рухомим поршнем циліндру знаходиться газ, з яким відбуваються круговий процес графік якого представлено на малюнку. Опишіть цей процес на кожній ділянці з точки зору енергетичних подій (криві 2–3 і 4–1 є ізотермами).
5. Під рухомим поршнем циліндру знаходиться газ, з яким відбуваються круговий процес графік якого представлено на малюнку. Опишіть цей процес на кожній ділянці з точки зору енергетичних подій (криві 1–2 і 3–4 є ізотермами).
6. За заданою р–V діаграмою ідеального двохатомного газу, визначте яку кількість теплоти отримав або віддав цей газ на кожній ділянці переходу 1→2→3→4→1. Якою є загальна кількість цієї теплоти?
.
§34. Цикл Карно. Ідеальна теплова машина Карно як ідеальний термометр.
Напевно найвідомішим та найважливішим тепловим процесом є так званий цикл Корно. Цикл Карно, це такий ідеальний круговий процес (цикл), який представляє собою замкнуту послідовність двох ізотермічних та двох адіабатичних процесів, реалізація яких дозволяє максимально ефективно перетворити певну кількість теплоти в механічну роботу.
Та ідеальна теплова теплова машина яка дозволяє реалізувати цикл Карно складається з трьох базових частин. 1) Ідеального нагрівника (масивне ідеально теплопровідне тіло, температура якого Т1 є постійно високою). 2) Ідеального охолоджувача (масивне ідеально теплопровідне тіло, температура якого Т2 є постійно низькою). 3) Ідеального циліндра під ідеальним поршнем якого знаходиться робоче тіло (газ). Циліндр ідеальний не тільки тому, що його поршень забезпечує ідеальну герметичність та рух без тертя. А й тому, що циліндр та його поршень виготовлені з такого ідеального матеріалу який з одного боку забезпечує ідеальну теплоїзоляцію, а з іншого, при контакті з нагрівником або охолоджувачем, є ідеально теплопровідним.
Принцип дії даної ідеалізованої системи полягає в наступному. Припустимо, що в початковий момент часу в циліндрі теплової машини знаходиться високотемпературний стиснутий газ, параметри якого р1V1T1 (мал.9. точка 1) і що виконується наступна послідовність дій.
1. Поставимо циліндр на нагрівник і надамо газу можливість ізотермічно розширюватись (ізотерма 1→2). В процесі цього розширення газ отримує від нагрівника певну кількість теплоти Q1 і виконує певну механічну роботу.
2. В стані який відповідає точці 2 (р2V2T1), знімаємо циліндр з нагрівника. При цьому надходження теплоти припиняється. А оскільки газ має великий запас теплової енергії, то він продовжуватиме розширюватись, але розширюватись адіабатично (адіабата 2→3). Коли ж в процесі адіабатичного розширення температура газу знизиться до температури охолоджувача Т2 розширення припиняється. При цьому газ набуває параметрів р3V3T2 (точка 3).
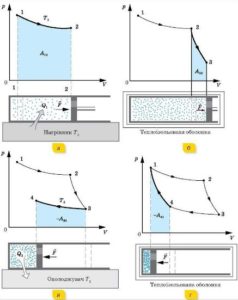
Мал.9. Етапи роботи ідеальної теплової машини та графічне відображення цих етапів в координатах р–V.
Подальше завдання полягає в тому, щоб повернути систему до початкового стану. Ясно, що вирішуючи цю задачу шляхом зворотного повторення попередніх циклів, тобто шляхом 3→2→1, ми отримаємо нулевий баланс механічної роботи. Адже на стиснення газу ми витратимо рівно стільки ж механічної енергії, скільки отримали в процесі його розширення.
Для того щоб систему повернути в початкове положення і отримати при цьому певний залишок механічної роботи, холодний газ спочатку потрібно стиснути ізотермічно, а потім – адіабатично. Дійсно. В процесі ізотермічного стиснення, газ частину своєї внутрішньої енергії (Q2) віддасть охолоджувачу. А це означає, що для повернення системи до початкового стану потрібно менше енергетичних затрат. Менше на величину різниці Q1 – Q2. Зважаючи на вище сказане, повернення системи до початкового стану здійснюють наступним чином.
3. В ситуації яка відповідає точці 3 (р3V3T2), циліндр ставлять на охолоджувач і виконують ізотермічне стиснення газу (ізотерма 3→4). При цьому частина внутрішньої енергії газу (Q2) переходить до охолоджувачу.
4. Коли об’єм газу зменшиться рівно на стільки, на скільки він збільшився в процесі ізотермічного розширення (точка 4), циліндр знімають з охолоджувача і подальше стиснення газу стає адіабатним (адіабата 4→1). При досягненні газом початкового стану, тобто стану з параметрами р1V1T1 (точка 1), стиснення припиняється. Цикл завершено і система готова до нового циклу.
Таким чином, газ (робоче тіло) здійснивши замкнутий цикл і отримавши від нагрівника певну кількість теплоти (Q1), частину цієї теплоти (Q2) віддав охолоджувачу, а частину перетворив на механічну роботу (A=Q1–Q2). А це означає, що коефіцієнт корисної дії (ККД) даного теплового процесу (η=Акор/Азатр) визначається за формулою η=(Q1–Q2)/Q1. При цьому не важко довести, що цю формулу можна записати у вигляді η=(Т1–Т2)/Т1. Дійсно, оскільки Q1=cm∆T1; Q2=cm∆T2, де с – питома теплоємність газу, m – маса газу (ці величини є незмінними) ∆T1 = T1 – T0 = T1; ∆T2 = T2 – T0 = T2, то можна записати η = (Q1 – Q2)/Q1 = (cmT1 – cmT2)/cmT1 = (T1 – T2)/T1.

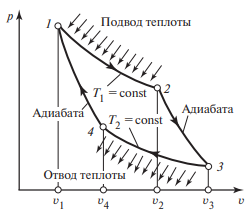
Мал.10. Принципова схема теплового двигуна та того ідеального теплового циклу (циклу Карно), який забезпечує максимальний ККД цього двигуна.
Звичайно, організувати роботу реального теплового двигуна за схемою яка називається циклом Карно, практично не можливо. Не можливо по перше тому, що в реальних машинах неможливо уникнути теплових втрат. А отже не можливо організувати строго адіабатичний процес.
По друге, процес який називається ізотермічним теплообміном (ізотермічним розширенням чи ізотермічним стисненням) є практично нездійсненним. Дійсно, що означає «при ізотермічному розширенні, робоче тіло отримує певну кількість теплоти»? Адже якщо процес ідеально ізотермічний, то це означає, що температура нагрівника і температура робочого тіла мають бути однаковими. В такому випадку, яким чином однаково нагріті тіла обмінюються теплом? Ясно, що коли ми говоримо про реальний ізотермічний теплообмін, то маємо на увазі, що між нагрівником і робочим тілом існує певний перепад температур. При цьому від величини цього перепаду залежить тривалість теплообміну: чим менший перепад, тим більша тривалість. Якщо ж говорити про ідеальний ізотермічний теплообмін, а саме такий передбачає цикл Карно, то такий теплообмін має тривати безкінечно довго. Зрозуміло, що в реальному тепловому двигуні організувати такий процес, забезпечивши при цьому ефективність роботи двигуна, не можливо.
Із вище сказаного ясно, що реальні цикли реальних теплових двигунів в тій чи іншій мірі відрізняються від циклу Карно. Але організовуючи роботу будь якого теплового двигуна, потрібно прагнути до того щоб його тепловий цикл був якомога більш схожим на цикл Карно. Адже реалізація саме такого циклу дозволяє отримати максимально великий ККД двигуна.
Потрібно зауважити, що пояснюючи закономірності перетворення теплоти в механічну роботу, пояснюючи загальний устрій та принцип дії теплового двигуна, створюючи ідеальну модель цього двигуна та описуючи ідеальну схему його роботи, Карно виходив з того помилкового припущення, що теплота це певна речовина (теплець), яка в процесі переходу від більш нагрітого тіла до менш нагрітого, виконує певну механічну роботу. Виконує подібно до того, як падаюча з певної висоти вода обертає водяне колесо. Та не дивлячись на помилковість поглядів що до природи теплоти, Саді Карно зумів зробити абсолютно правильний теоретичний висновок: енергетична ефективність ідеального теплового двигуна, визначальним чином залежить від тієї різниці температур яку має робоче тіло на початку (Т1) і вкінці (Т2) робочого циклу, і що його ККД має визначатись за формулою η=(Т1–Т2)/Т1.
Скоріш за все Саді Карно навіть не підозрював, яке величезне загально наукове значення матиме його ідеальна теплова машина. Не буде перебільшенням сказати, що в термодинаміці ідеальна теплова машина Карно, є тим основним приладом за допомогою якого вчені досліджують Природу та пояснюють загальні властивості твердих, рідких і газоподібних речовин. Власне суть термодинаміки в тому і полягає, що об’єкт досліджень умовно розміщують в циліндрі ідеальної теплової машини та аналізують його поведінку за тих чи інших термодинамічних обставин.
Однією з найважливіших заслуг ідеальної теплової машини перед фізикою загалом і термодинамікою зокрема є та, що застосовуючи цю машину вчені по суті довели, що температура є мірою середньої кінетичної енергії теплового руху не лише молекул ідеального газу, а й молекул будь яких твердих, рідких та газоподібних речовин.
Напевно ви пам’ятаєте скільки зусиль ми доклали задля того, щоб відповісти на здавалося б абсолютно просте запитання: «Що таке температура?» (читайте §6. Температура, як міра нагрітості тіла, та як міра середньої кінетичної енергії його молекул). Зрештою, спираючись на експериментально встановлені газові закони та теорію ідеального газу, ми дійшли висновку, що температура, це міра середньої кінетичної енергії молекул речовини. Але чесно кажучи, цей висновок був науково доведеним лише для молекул ідеального газу. Адже у своїх доказах ми спиралися саме на теорію ідеального газу. Якщо ж говорити про загально наукове доведення того, що температура є мірою середньої кінетичної енергії молекул будь якої речовини, то це стало можливим лише з застосуванням ідеальної теплової машини Саді Карно.
Дійсно, в теорії Карно стверджується, що в ідеальній тепловій машині, яка працює за ідеальним тепловим циклом (циклом Карно), між температурою нагрівника (Т1) і охолоджувача (Т2), та кількістю теплоти яку віддає нагрівник (Q1) і отримує охолоджувач (Q2) існує співвідношення T1/T2=Q1/Q2 (оскільки η=(Q1–Q2)/Q1 = (T1 – T2)/T1, або 1–(Q2/Q1) = 1 – (T2/T1), звідси T1/T2=Q1/Q2). Це означає, що в теорії Карно вимірювання температури по суті зводиться до вимірювання іншої, з нею пов’язаної величини – кількості теплоти (енергії).
Першим хто звернув увагу на цей факт був англійський фізик Вільям Томсон (лорд Кельвін). В 1848 році Томсон розробив такий теоретичний термометр, показання якого не залежали ні від чого іншого окрім ступеню нагрітості тіла (його температури). Звичайно, в реальності виготовити такий ідеальний термометр не можливо. Адже по суті цим термометром є ідеальна теплова машина Саді Карно. Але цей ідеальний термометр дозволив вченим теоретично довести, що показання реального газового термометра вточності співпадають з показаннями ідеального термометра Томсона. А це означало, що температура є мірою середньої кінетичної енергії не лише молекул ідеального газу, а й молекул будь яких твердих, рідких та газоподібних речовин.
Втім, не будемо забувати, що в термодинаміці все в тому числі і те, що називається температурою, пояснюється без згадки про існування молекул. Тому в термодинаміці прийнято наступне визначення температури: Температура, це фізична величина, яка характеризує стан термодинамічної рівноваги системи і значення якої визначається за термодинамічною шкалою температур.
Позначається: Т
Визначальне рівняння: нема
Одиниця вимірювання: [T] = К, кельвін.
Термодинамічна шкала температур, це така температурна шкала, в якій за початок відліку прийнято температуру абсолютного нуля, за одиницю вимірювання – кельвін (К), а за еталонний метод вимірювання – вимірювання на основі формули T1/T2=Q1/Q2 та визначення тієї кількості теплоти, яку витрачає нагрівник (Q1) і отримує холодильник (Q2) у відповідному циклі Карно.
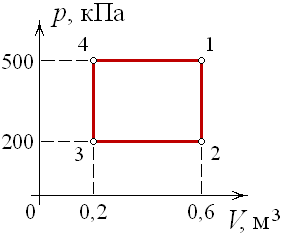
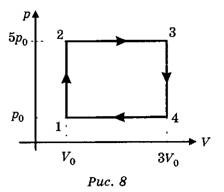
Задача. Одноатомний ідеальний газ здійснює зображений на малюнку цикл 1→2→3→4→1. Визначити ККД циклу.
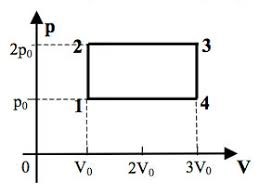
Рішення. Оскільки за визначенням η=Акор/Азаг, та враховуючи що в умовах теплового двигуна, загальною енергією (роботою), є та енергія яку отримує робоче тіло від нагрівника Азаг=Qн, а корисною енергією (роботою) є різниця між тією теплотою яку робоче тіло отримало від нагрівника та тією теплотою яку воно віддало охолоджувачу Акор=Qн – Qох, можна записати η= (Qн–Qох)/Qн = 1–Qох/Qн.
Керуючись першим началом термодинаміки Q=ΔU+A, визначаємо кількість тієї теплоти яку отримує (+Q) або втрачає (–Q) робоче тіло на кожній ділянці заданого циклу.
Ділянка 1→2: V=const, p↑, оскільки pV/T=const, то T↑. А це означає:
1) А12=pΔV=0;
2) ΔU12=1,5VΔp=1,5V0p0.
+Q12 = ΔU12 + A12 = 1,5p0V0.
Ділянка 2→3: V↑ p=const, оскільки pV/T=const, то T↑. А це означає:
1) А23=pΔV=2p0·2V0 = 4p0V0;
2) ΔU23=1,5pΔV=1,5·2p0·2V0= 6p0V0.
+Q23 = ΔU23 + A23 = 6p0V0 + 4p0V0 = 10p0V0.
Ділянка 3→4: V=const, p↓, оскільки pV/T=const, то T↓. А це означає:
1) А34=pΔV=0;
2) ΔU34=1,5VΔp=1,5·3V0(–1p0) = –4,5p0V0;
–Q12 = ΔU34 + A34 = 4,5p0V0.
Ділянка 4→1: V↓, p=const, оскільки pV/T=const, то T↓. А це означає:
1) А41=pΔV=p0·(–2)V0 = –2p0V0;
2) ΔU41=1,5pΔV=1,5·p0·(–2)V0= –3p0V0.
–Q41 = ΔU41 + A41 = 3p0V0 + 2p0V0 = 5p0V0.
Таким чином: Qн = +Q = 1,5p0V0 + 10p0V0 = 11,5p0V0.
Qох = –Q = 4,5p0V0 + 5p0V0 = 9,5p0V0.
η= 1–Qох/Qн = 1 – 9,5p0V0/11,5p0V0 = 1 – 0,83 = 0,17 = 17%.
Відповідь: η = 17%.
Контрольні запитання.
1. Яку будову має ідеальна теплова машина Карно?
2. В чому ідеальність циліндру з поршнем в тепловій машині Карно?
3. На основі аналізу малюнку 98 опишіть ті події які відбуваються в циклі Карно.
4. Поясніть, чому в циклі Карно газ який спочатку розширюється, а потім настільки ж стискається, у підсумку виконує певну механічну роботу?
5. Поясніть чому цикл Карно неможливо реалізувати на практиці?
6. Чи можна організувати на практиці ідеальний ізотермічний теплообмін? Чому?
7. На основі якого факту Вільям Томсон запровадив термодинамічну шкалу температур?
8. Як визначають термін «температура» в молекулярній фізиці? в термодинаміці? Яке з цих визначень вам більш зрозуміле?
Вправа 34.
1. Температура нагрівника ідеальної теплової машини 150°С, а охолоджувача 25°С. При цьому машина одержує від нагрівника 50кДж енергії. Який ККД цієї машини? Яку кількість механічної роботи виконала машина?
2. ККД ідеального теплового двигуна 35%. Робоче тіло одержало від нагрівника 6кДж теплоти. Скільки теплоти передано охолоджувачу?
3. Ідеальна теплова машина працює за циклом Карно. При цьому абсолютна температура нагрівника втричі вища за температуру охолоджувача. Визначте ККД машини.
4. Ідеальна теплова машина працює за циклом Карно. При цьому 80% теплоти одержаної від нагрівника, передається охолоджувачу температура якого 0°С. Визначте температуру нагрівника і ККД машини.
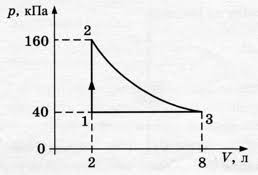
5. За заданою р–V діаграмою ідеального трьохатомного газу, визначте яку кількість теплоти отримав або віддав цей газ на кожній ділянці переходу 1→2→3→1, крива 2→3 ізотерма.
6. Під рухомим поршнем циліндру знаходиться газ, з яким відбуваються круговий процес графік якого представлено на малюнку. Опишіть цей процес на кожній ділянці з точки зору енергетичних подій (криві 1–2 і 3–4 є ізотермами; 2–3 і 4–1 є адіабатами).
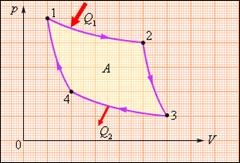
7. Двохатомний ідеальний газ здійснює зображений на малюнку цикл 1→2→3→4→1. Визначити ККД циклу.
.
§35. Реальні цикли теплових двигунів.
В попередньому параграфі ми говорили про ідеальну теплову машину та той ідеальний замкнутий тепловий процес (цикл Карно), реалізація якого дозволяє максимально ефективно перетворити певну кількість теплоти в механічну роботу. Наразі ж поговоримо про реальні теплові двигуни та їх реальні цикли. Ці двигуни і ці цикли хоч і є менш ефективними, але мають одну перевагу – їх можна реалізувати на практиці.
На теперішній час, найбільш поширеними і конструктивно найбільш різноманітними тепловими машинами є двигуни внутрішнього згорання. Двигунами внутрішнього згорання, називають такі поршневі двигуни, в яких робочим тілом є високотемпературний газ що утворюється при згоранні палива в середині робочого циліндру двигуна. Загальний устрій та етапи роботи типового двигуна внутрішнього згорання представлені на мал.11. Повний робочий цикл зображеного на малюнку двигуна здійснюється за чотири етапи (такти). На першому – відкривається вхідний клапан і циліндр заповнюється горючою сумішшю. На другому етапі, ця суміш стискається. На третьому – горюча суміш підпалюється, згорає і виконує корисну роботу. На четвертому етапі, відкривається випускний клапан і відпрацьовані продукти згорання виштовхуються за межі робочого циліндра.
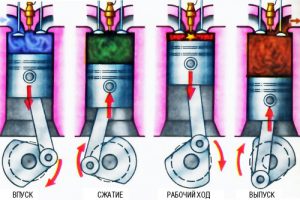
Мал.11. Загальний устрій та етапи роботи типового двигуна внутрішнього згорання.
Двигуни внутрішнього згорання зазвичай поділяють на карбюраторні та дизельні. В карбюраторних (бензинових) двигунах, горюча суміш утворюється за межами робочого циліндра (в карбюраторі) і в потрібний момент запалюється іскрою від свічки запалювання. В дизельних двигунах нема карбюратора і нема свічки запалювання. Натомість є форсунка – прилад, який в момент гранично сильного стиснення повітря, впорскує в це розжарене повітря паливо яке самозаймається.
Маючи уявлення про загальний устрій теплового двигуна і зокрема чотиритактного карбюраторного двигуна, розглянемо його роботу з точки зору тих теплових процесів які відбуваються в ньому. А ці процеси є наступними (мал.12).
1. В першому такті (всмоктування) поршень рухається вниз. При цьому через відкритий впускний клапан, горюча суміш всмоктується в циліндр. В кінці першого такту впускний клапан закривається. Процес заповнення циліндру горючою сумішшю можна вважати умовно ізобаричним (лінія 1→2).
2. В другому такті (стискання) поршень рухається вверх і стискаючи горючу суміш нагріває її. А зважаючи на швидкість цього процесу, це стиснення можна вважати умовно адіабатним (лінія 2→3).
3. Третій такт (робочий хід) складається з двох частин: швидкого згорання палива в процесі якого температура і тиск газу різко збільшуються а газ частково розширюється (лінія 3→4→5), та майже адіабатного розширення продуктів згорання (лінія 5→6). Робочий хід, це основний енергоутворюючий такт, механічна енергія якого частково йде на виконання механічної роботи, а частково на здійснення трьох інших енергозатратних тактів.
4. На початку четвертого такту (вихлоп), відкривається випускний клапан, при цьому тиск газу різко (майже ізохорично) зменшується (лінія 6→2), при цьому в процесі подальшого поступального руху поршня з циліндру виштовхуються залишки продуктів згорання і система повертається до початкового стану (лінія 2→1). В кінці четвертого такту, випускний клапан закривається і відкривається впускний.

Мал.12. Етапи роботи та тепловий цикл чотиритактного карбюраторного двигуна.
Звичайно, вище описаний реальний тепловий цикл, суттєво відрізняється від циклу Карно. Відрізняється по перше тому, що цей реальний цикл не є замкнутим. Адже в двигуні внутрішнього згорання при кожному новому циклі робоче тіло замінюється новим робочим тілом. По друге, даний цикл є незворотнім. Адже горюча суміш перетворюється на продукти згорання, тоді як зворотнє перетворення є неможливим. По третє, всі реальні процеси відбуваються з певними тепловими, механічними та іншими втратами.
Та не дивлячись на всі відмінності, загальні риси даного реального циклу все ж схожий на ідеальний цикл Карно. І основна з цих схожостей полягає в тому, що в будь якому реальному тепловому двигуні, виконання механічної роботи є результатом переходу певної кількості теплоти від нагрівника до охолоджувача, який відбувається за схемою
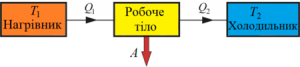
Потрібно зауважити, що в реальних теплових двигунах, функції охолоджувача практично завжди виконує навколишнє середовище (атмосфера). Бо саме в навколишнє середовище тепловий двигун викидає відпрацьовані продукти згорання. І температура цього навколишнього середовища має бути меншоє за температуру того що викидається з теплового двигуна. Адже якщо температура (а отже і тиск) навколишнього середовища буде більшою за температуру (а відповідно і тиск) тих продуктів згорання які виходять із двигуна, то ці продукти виходити не будуть, натомість газ навколишнього середовища заходитиме в двигун та протидіятиме його роботі.
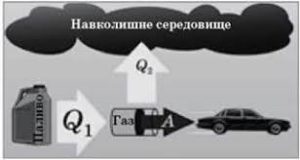
Мал.13. В реальних теплових двигунах охолоджувачем є навколишнє середовище.
Однією з основних характеристик двигуна внутрішнього згорання, від якої визначально залежить його к.к.д. є ступінь стиснення горючої суміші, яка дорівнює відношенню об’єму горючої суміші до стиснення (V1) до її об’єму при максимальному стисненні (V2): ε=V1/V2. В карбюраторних двигунах спупінь стиснення горючої суміші зазвичай становить 8 – 9 одиниць. Суттєвому підвищенню цього показника заважає так звана детонація горючої суміші, тобто неконтрольоване самозаймання суміші, яке відбувається в процесі її стиснення. При цьому зазвичай, детонація відбувається ще до того як поршень досягне свого крайнього верхнього положення. А це безумовно призводить до механічної руйнації двигуна.
В 1892 році німецький інженер Рудольф Дизель (1858–1913) розробив двигун в якому ступінь стиснення горючої суміші досягає 16 – 20 одиниць. Така висока ступінь стиснення досягається за рахунок того, що в дизельному двигуні стискають не горючу суміш, а чисте повітря. При цьому на заключній фазі стиснення, в циліндр за допомогою спеціальної форсунки вприскують пальне, яке при взаємодії з розжареним повітрям самозаймається. А оскільки процес перемішування дрібних крапельок пального з повітрям має певну тривалість, то відповідно більш тривалим є процес горіння. А це означає, що в дизельному двигуні силова дія продуктів згорання на поршень є більш оптимальною. Висока ступінь стиснення та оптимальний режим горіння, це ті основні переваги які забезпечують поріняно високу енергетичну ефективність дизельних двигунів (ККД дизельного двигуна приблизно на 10% більший за ККД відповідного карбюраторного двигуна).
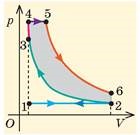
Коротко описуючи ті процеси що відбуваються в чотирьох тактному дизельному двигуні можна сказати наступне (мал.14). В першому такті повітря всмоктується в циліндр (лінія Ⅰ). В другому – повітря майже адіабатично стискається і нагрівається до високої температури (лінія Ⅱ). На початку третього такту (робочий хід) в циліндр впорскується пальне, яке при взаємодії з розжареним повітрям самозаймається. При цьому продукти згорання розширюються, спочатку ізобарично (лінія Ⅲ), а потім адіабатично (лінія Ⅲ) та виконують певну механічну роботу. На початку четвертого такту (вихлоп), відкривається випускний клапан, при цьому тиск газу різко (майже ізохорично) зменшується (лінія Ⅳ), в процесі ж подальшого поступального руху поршня з циліндру виштовхуються залишки продуктів згорання і система повертається до початкового стану (лінія Ⅳ). В кінці четвертого такту, випускний клапан закривається і відкривається впускний.

Мал.14. Етапи роботи та тепловий цикл чотиритактного дизельного двигуна.
Певні теплові цикли мають не лише ті двигуни які дійсно працюють за певною циклічною схемою, а й такі двигуни неперервної дії як реактивні. Нагадаємо, реактивними називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло з великою швидкістю вилітає назовню двигуна через так зване сопло (мал.15). Зазвичай, сопло реактивного двигуна представляє собою певне звуження його камери згорання яке плавно переходить в характерне розширення. Така конструкція забезпечує вирішення двох задач: 1) створює умови за яких швидкість вильоту молекул робочого тіла стає максимально великою; 2) створює умови за яких рух молекул робочого тіла стає максимально упорядкованим (направленим вздовж осі сопла).
Поступальний рух реактивного двигуна та того тіла яке цей двигун переміщує, обумовлений тими ж силовими причинами що і рух тіла гвинтівки, з дула якої вилітає куля, або рух човна з корми якого стрибає пірнальник. Просто з тіла реактивного двигуна вилітають не кулі, не снаряди і не пірнальники, а атоми тієї речовини що згорає в двигуні.
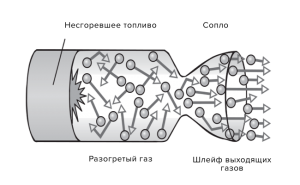
Мал.15. Схема загального устрою та теплового циклу реактивного двигуна.
Оскільки процес роботи реактивного двигуна є неперервним, то важко повірити, що в цьому неперервному процесі можна виділити певні елементи теплового циклу. І тим неменше робота реактивного двигуна підпорядкована певному умовно замкнутому циклу, графічне зображення якого представлено на мал.104б. Стисло коментуючи ті процеси які описує цей цикл, можна сказати наступне:
1→2 те умовно адіабатичне стиснення компонентів робочого тіла, яке відбувається за межами камери згорання двигуна (адже в камеру згорання компоненти робочого тіла мають впорскуватись під тиском який не менший за тиск всередині камери згорання;
2→3 ізобаричне підвищення температури робочого тіла за рахунок спалювання палива в камері згорання;
3→4 умовно адіабатичне розширення робочого тіла, яке відбувається в соплі двигуна і в процесі якого виконується корисна робота (теплова енергія продуктів згорання перетворюється на енергію механічного руху ракети);
4→1 вихід продуктів згорання за межі двигуна та створення умов для впорскування нової порції компонентів робочого тіла.
Аналізуючи загальний устрій реактивних, турбінних та поршневих двигунів, важко віднайти бодай якісь конструктивні аналогії. Важко тому, що з точки зору технічних рішень, ці двигуни влаштовані по різному. І тим не менше, всі ці абсолютно не схожі двигуни, працюють за однією принциповою схемою: нагрівник (джерело енергії) надає робочому тілу певну кількість теплоти (Q1); робоче тіло, частину цієї теплоти перетворює на механічну роботу (А), а частину (Q2= Q1–А) – передає охолоджувачу, яким по суті є навколишнє середовище.

Контрольні запитання.
1. Поясніть загальний устрій та принцип дії поршневого двигуна.
2. На основі аналізу мал.101 стисло опишіть етапи умовно замкнутого теплового циклу карбюраторного двигуна.
3. Чому ступінь стиснення горючої суміші в карбюраторному двигуні є відносно низькою?
4. За рахунок чого ККД дизельних двигунів суттєво більший за ККД двигунів карбюраторних?
5. На основі аналізу мал.102 стисло опишіть етапи умовно замкнутого теплового циклу дизельного двигуна.
6. Поясніть загальний устрій та принцип дії реактивного двигуна.
7. На основі аналізу мал.103 стисло опишіть етапи умовно замкнутого теплового циклу реактивного двигуна.
8. Що в принциповій схемі теплового двигуна називають нагрівником, робочим тілом та охолоджувачем?
Вправа 35.
1. ККД ідеального теплового двигуна 25%. Яка температура нагрівача, якщо температура охолоджувача 22ºС?
2. Температура нагрівача ідеальної теплової машини 117ºС, а охолоджувача 27ºС. Кількість тієї теплоти, яку отримує машина від нагрівника за 1с становить 60кДж. Визначити ККД машини, її потужність та ту кількість теплоти яку отримує охолоджувач.
3. Визначити ККД теплового двигуна, який розвиває потужність 95кВт та витрачає за годину 25кг дизельного палива (q=42·106Дж/кг)?
4. Реактивний літак пролітає зі швидкістю 900км/год шлях 1800км, витративши 4т палива. Потужність двигуна літака 5900кВт, а його ККД 23%. Яка питома теплота згорання палива?
5. Одноатомний ідеальний газ здійснює зображений на малюнку цикл 1→2→3→4→1. Визначити ККД циклу.
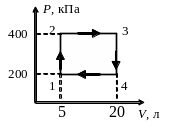
6. Теплова машина, робочим тілом якої є одноатомний ідеальний газ, працює за циклом 1→2→3→4→1, де 4→1 адіабата. Визначте ККД теплової машини, якщо V1=V0; V2=2V0; V3=3V0; p1=p0; p3=6p0.
.
§36. Чому теплові двигуни мають низький ККД?
Із аналізу формули Карно η=(Т1–Т2)/Т1, з усією очевидністю випливає практично важливий висновок: організовуючи роботу реального теплового двигуна, потрібно прагнути до того, щоб на початку робочого циклу, температура робочого тіла була максимально великою, а в кінці цього циклу – максимально низькою.
Ясно, що прагнучи максимально збільшити температуру робочого тіла, ми неминуче стикнемося з низкою технічних проблем. Наприклад, з проблемою того, що при високих температурах, конструктивні матеріали втрачають свої міцнісні властивості. З іншого боку, можливості максимального зниження температури робочого тіла також суттєво обмежені. Обмежені бодай тим, що робоче тіло не можна змусити виконувати корисну роботу, якщо температура цього тіла нижча за температуру навколишнього середовища.
Вище сказане означає, що ККД найідеальнішого теплового двигуна не може бути гранично великим. Наприклад, якщо максимальна температура робочого тіла 2000К, а температура навколишнього середовища 300К, то ККД найідеальнішого теплового двигуна не може перевищувати 85%: ηmax=(2000 – 300)/2000=0,85=85%. Якщо ж говорити про реальні теплові двигуни, з їх реальним перепадом температур та реальним рівнем інших енергетичних втрат, то їх ККД практично завжди менший 50%.
Таблиця. Коефіцієнти корисної дії сучасних теплових двигунів.
| Тип двигуна | ККД (%) |
| Парова машина Уатта
Двигуни внутрішнього згорання: . – карбюраторні . – дизельні Турбінні двигуни Турбореактивні двигуни Реактивні двигуни |
2
25 – 35 30 – 40 25 – 35 25 – 35 30 – 35 |
Не важко бачити, що реальний коефіцієнт корисної дії теплового двигуна практично будь якої конструкції є надзвичайно низьким. Адже в процесі роботи теплового двигуна приблизно 70% тієї енергії що виділяється при згоранні палива, в буквальному сенсі викидається «на вітер». Чому ж енергетична ефективність навіть найсучасніших теплових двигунів є такою низькою? Чому ККД електричного двигуна становить 97 – 99%, а теплового – лише 25 – 40%? Що ж, спробуємо відповісти і на ці слушні та важливі запитання.
Аналізуючи роботу реального теплового двигуна, наприклад двигуна внутрішнього згорання, не важко з’ясувати, що та теплова енергія (Q) яка виділяється в процесі згорання палива витрачається наступним чином:
– йде на виконання корисної механічної роботи (Амех);
– викидається в атмосферу разом з продуктами згорання (Qпр.гор);
– викидаються в атмосфера в процесі роботи системи охолодження (Qox);
– йде на інші неминучі втрати (Qiн).
Іншими словами: Q = Aмех + Qпр.гор + Qох + Qін .
Напевно основним джерелом енергетичних втрат будь якого теплового двигуна є та невикористана енергія, яка викидається за межі робочого циліндру двигуна разом з продуктами згорання. Дійсно. В камері згорання сучасного карбюраторного двигуна, температура газу досягає 3000К. В процесі розширення, цей газ виконує механічну роботу і охолоджується. Однак, вже при температурі близькій до 1300К, газ викидається за межі циліндра. А разом з ним, викидається і величезна кількість нереалізованої енергії (≈ 43%). Виникає закономірне питання: А чому теплова енергія газу використовується так неефективно? Адже якби газ викидали не при 1300К, а скажімо при 400К, то рівень відповідних теплових втрат знизився б з 43% до 13%.
Сподіваюсь, ви не думаєте що ті інженери які проектують теплові двигуни не знають про вище згаданий факт? Звичайно знають. І безумовно працюють над тим, щоб максимально ефективно використати енергетичний потенціал палива. Але ця задача не є такою простою як може здатися на перший погляд.
Дійсно. Припустимо, що ви хочете створити двигун в якому рівень теплових втрат є гранично низьким. З цією метою ви прагнете організувати робочий цикл двигуна таким чином, щоб його продукти згорання викидались не при 1300К, а при 400К. Проектуючи такий двигун, ви неодмінно з’ясуєте, що робочий хід його поршня потрібно збільшити в 3 рази. А прагнучи в 3 рази збільшити робочий хід поршня, ви неодмінно з’ясуєте, що діаметр циліндра двигуна потрібно також збільшити в 3 рази, А це означає, що об’єм цього циліндра а отже і його масу, а відповідно об’єми та маси поршня, корпусу двигуна, системи охолодження тощо, потрібно збільшити в 33=27 разів.
Крім цього, ви неодмінно з’ясуєте, що робочий цикл вашого «ідеального двигуна» стане більш тривалим. Що погіршаться динамічні параметри процесу. Зменшиться питома потужність двигуна. Збільшаться теплові втрати в системі охолодження. Виникнуть проблеми в організації безпечного вихлопу продуктів згорання, тощо. В такій ситуації перед вами неминуче постане питання: а чи варто максимально розширювати, а відповідно і охолоджувати продукти згорання двигуна, якщо таке охолодження та йому відповідне збільшення ККД неминуче призводить до геометричного зростання розмірів, маси, ціни та інших параметрів двигуна?
Таким чином, проектуючи реальний тепловий двигун, ви будете змушені вирішувати складний комплекс взаємопов’язаних проблем. Проблем такого ґатунку, що певний виграш в одному напрямку, неминуче призводить до відповідного програшу в інших напрямках. Кінцевим же рішенням цієї системи оптимізаційних задач буде висновок: для карбюраторних двигунів з максимальною температурою робочого тіла 3000К, оптимальна температура вихлопу продуктів згорання має бути близькою до 1300К.
Звичайно, ви можете спробувати підвищити максимальну температуру робочого тіла двигуна, скажімо до 4000К. Але і в цьому випадку, реалії життя неодмінно приготують вам нові сюрпризи. Наприклад вам знадобиться нова, більш дорога та енергетично більш затратна система охолодження. Вам неминуче знадобиться новий, більш дорогий вид палива. Вам знадобляться нові, більш дорогі конструктивні матеріали. Крім цього, ви неодмінно з’ясуєте, що для двигунів з максимальною температурою робочого тіла 4000К, оптимальною температурою вихлопу продуктів згорання є не 1300К, а 1500К. При цьому, ви знову переконаєтесь в тому, що намагаючись зменшити втрати в одному місці, ви будете створювати умови для їх появи в іншому.
Другою масштабною складовою енергетичних втрат теплового двигуна є втрати пов’язані з роботою системи охолодження (Qох). Неминучість таких втрат є очевидною. Адже, в умовах надвисоких температурних навантажень, рівень яких значно перевищує температуру плавлення більшості конструктивних матеріалів, нормальний режим роботи основних елементів двигуна, може забезпечити лише ефективно система охолодження. При цьому кількість тієї енергії яка «викидається» в систему охолодження, жорстко регламентована багатьма обставинами. А ці обставини такі, що в сучасних двигунах внутрішнього згорання, в систему охолодження «викидається» від 15% до 25% загальної кількості генерованої теплоти.
Третю групу енергетичних втрат теплового двигуна, складає вся сукупність інших можливих втрат (Qін). До їх числа відносяться:
– та енергія яка йде на повернення механізму двигуна в початкове робоче положення (адже, наприклад, в чотирьох тактному двигуні, лише один такт є робочим, тоді як три інші – підготовчі);
– втрати пов’язані з неповним згоранням палива;
– втрати пов’язані з наявністю сили тертя;
– втрати пов’язані з забезпеченням роботи гідравлічної та електричної систем двигуна;
– інші можливі втрати.
Сукупність подібних втрат становить приблизно 8% від загального енергетичного балансу теплового двигуна. І як ви розумієте, зменшити величину цих відсотків надзвичайно складно.
Ясно, що маючи такий «букет» невідворотних втрат, створити тепловий двигун з надвисоким коефіцієнтом корисної дії практично неможливо. Тому факт того, що сучасні теплові двигуни мають відносно низький ККД, зовсім не означає що ці двигуни недосконалі. Цей факт вказує лише на те, що процес перетворення теплоти в механічну роботу, неминуче супроводжується великими енергетичними втратами, і що величина цих втрат, зазвичай суттєво перевищує 50%.
Власне факт того, що енергетична ефективність теплових двигунів відносно низька, є прямим наслідком того закону який називається другим началом термодинаміки. А суть цього закону зводиться до того, що в Природі енергія порядку (механічна робота, енергія електричного струму, тощо), легко і повністю перетворюється в енергію безпорядку (теплоту). А от енергія безпорядку, якщо і перетворюється в енергію порядку, то лише примусово і неповністю, тобто з певними енергетичними втратами.
Якщо ж говорити про двигун електричний, то він перетворює енергію одного порядку (енергію упорядкованого руху заряджених частинок), в енергію іншого порядку (механічну роботу). А таке перетворення, якщо і супроводжується певними енергетичними втратами, то лише такими які пов’язані з механічним або електричним тертям. А такі втрати відносно легко мінімізуються. Тому сучасні електричні двигуни мають високий ККД, величина якого досягає 99%.
Таким чином, факт відносно низької енергетичної ефективності всього різноманіття сучасних теплових двигунів, є прямим наслідком того, що ці прилади перетворюють енергію безпорядку в енергію порядку. Натомість, енергетична ефективність тих приладів які перетворюють енергію порядку в енергію безпорядку, або енергію порядку в енергію іншого порядку, є або може бути близькою до 100%.
Контрольні запитання.
1. Що називають коефіцієнтом корисної дії приладу?
2. Що необхідно зробити для того щоб максимально збільшити ККД теплового двигуна? Чи легко це реалізувати на практиці? Чому?
3. Чому в теплових двигунах продукти згорання палива викидають за межі двигуна при відносно великих температурах?
4. Назвіть основні групи теплових втрат в двигуні внутрішнього згорання.
5. Запишіть відсоткові співвідношення між Q та Aмех, Qпр.гор, Qох, Qін, для усередненого теплового двигуна.
6. Чому в сучасних теплових двигунах близько 20% генерованої теплової енергії витрачається на систему охолодження.
7. Чому ККД сучасних теплових двигунів значно менший за 50%, тоді як ККД сучасних електричних двигунів близький до 100%?
8. Чи можна сподіватися на те, що в майбутньому ККД теплових двигунів буду збільшено вдвічі (до 75%)? Чому?
9. В чому основна складність роботи інженера-конструктора?
Вправа 37.
1. Температура нагрівника ідеальної теплової машини 150°С, а охолоджувача 25°С. Від нагрівача машина отримує 50кДж енергії. Визначте величину виконаною машиною роботи.
2. В ідеальній тепловій машині ККД якої 45% газ отримує від нагрівача 12кДж теплоти. Яка температура нагрівача, якщо температура охолоджувача 27°С? Скільки джоулів теплоти машина віддає охолоджувачу.
3. Визначити ККД теплового двигуна, який розвиває потужність 95кВт та витрачає за годину 25кг дизельного палива (q=42·106Дж/кг)?
4. Автомобіль рухається зі швидкістю 90км/год, при цьому потужність його двигуна 700кВт, а його ККД 30%. Визначте витрати бензину на 1км шляху.
5. Теплова машина, робочим тілом якої є одноатомний ідеальний газ, працює за циклом 1→2→3, де 2 – ізотерма. Визначте ККД теплової машини.
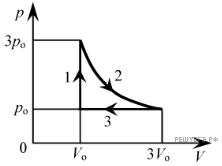
6. Теплова машина, робочим тілом якої є одноатомний ідеальний газ, працює за циклом 1→2→3. Визначте ККД теплової машини.
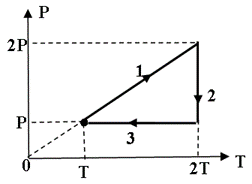
.
§38. Зворотний цикл Карно. Холодильники. Теплові насоси.
Важливою властивістю циклу Карно є його зворотність. Це означає, що та ідеальна теплова машина яка працює за циклом Карно може: в процесі переходу теплоти від гарячого тіла до холодного, виконувати механічну роботу (мал16а), а в процесі виконання механічної роботи, передавати теплоту від холодного тіла до гарячого (мал16б).
а) 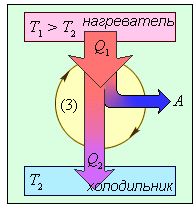 б)
б) 
Мал.16. Ідеальна теплова машина Карно дозволяє: а) в процесі переходу теплоти від гарячого тіла до холодного, виконувати механічну роботу; б) в процесі виконання механічної роботи, передавати теплоту від холодного тіла до гарячого.
Про те як ідеальна теплова машина, працюючи за циклом Карно перетворює теплоту в механічну роботу, ви вже знаєте. Наразі ж поговоримо про те, яким чином теплота може переходити від холодного тіла до гарячого. З’ясовуючи фізичну суть такого, на перший погляд парадоксального і абсолютно неможливого переходу, давайте запустимо ідеальну теплову машину по технологічному колу яке називається зворотнім циклом Карно і проаналізуємо отримані результати. Припустимо, що в циліндрі ідеальної теплової машини (мал.17а) знаходиться високотемпературне робоче тіло (газ) параметри якого p1V1T1 і що ці параметри змінюються за схемою яка називається зворотнім циклом Карно 1→4→3→2→1.
а)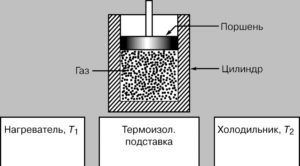 б)
б)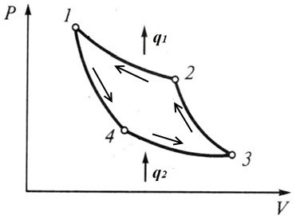
Мал.17. а) Схема ідеальної теплової машини; б) зворотній цикл Карно.
1. На першому етапі цього циклу (адіабата 1→4), високотемпературному стиснутому газу надають можливість адіабатно розширюватись, а отже і відповідним чином охолоджуватись.
2. Коли температура газу досягає позначки Т2 (температура охолоджувача), циліндр ставлять на охолоджувач, при цьому розширення газу продовжується але вже ізотермічно (ізотерма 4→3). В процесі такого розширення, певна кількість теплоти (Q2) переходить від охолоджувача до газу (робочого тіла). Переходить тому, що в процесі розширення газ неминуче охолоджується. А це означає, що ізотермічне розширення газу можливе лише в тому випадку, якщо він отримує від навколишнього середовища (в даному випадку від охолоджувача) певну кількість теплоти.
3. На третьому етапі, циліндр знімають з охолоджувача, а той газ що в ньому знаходиться примусово адіабатично стискають (адіабата 3→2). При цьому температура газу збільшується. Коли ж ця температура досягає позначки Т1 (температура нагрівника), циліндр ставлять на нагрівник і подальше стиснення газу стає ізотермічним.
4. В процесі ізотермічного стиснення (ізотерма 2→1), певна кількість теплоти (Q1) переходить від газу (робочого тіла) до нагрівника. Переходить тому, що в процесі стиснення газ неминуче нагрівається. А це означає, що ізотермічне стиснення газу можливе лише в тому випадку, якщо він певну кількість теплоти віддає навколишньому середовищу (в даному випадку нагрівнику).
Таким чином, в процесі тих термодинамічних змін які називаються зворотнім циклом Карно, робоче тіло, отримавши від холодного тіла певну кількість теплоти (Q2), а від зовнішніх сил – певну кількість механічної енергії (роботи А), передає цю загальну кількість енергії нагрітому тілу (Q1=Q2+A). При цьому холодне тіло стає ще більш холодним, а нагріте – ще більш нагрітим. Іншими словами, принципова схема переходу теплоти від холодного тіла до нагрітого має вигляд:
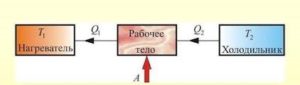
Сподіваюсь ви розумієте, що вище описаний перехід теплоти від холодного тіла до гарячого, не суперечить тому закону в якому стверджується: теплота сама по собі не може переходити від холодного тіла до гарячого. Не суперечить тому, що в зворотньому циклі Карно, перехід теплоти від холодного тіла до гарячого відбувається не самовільно, а примусово: за рахунок тієї механічної роботи яку виконують зовнішні сили в процесі примусового стиснення нагрітого робочого тіла.
Звичайно, зворотній цикл Карно є ідеалізованим і таким, який не можливо здійснити на практиці. Не можливо за тих же причин, що і прямий цикл Карно. Але цей ідеалізований цикл має надзвичайно важливе практичне значення. Адже він не лише пояснює загальний устрій та принцип дії тих реальних теплових машин які називаються холодильниками, морозильними камерами, тепловими насосами, кондиціонерами, тощо, а й вказує на шляхи вдосконалення роботи цих машин.
На практиці ідея примусового переходу теплоти від холодного тіла до гарячого, реалізується в загально відомому приладі який називається холодильником. Холодильник, це прилад, в якому за рахунок виконання певної механічної роботи, створюються такі умови, за яких температура в певній обмеженій частині простору, значно менша за температуру навколишнього середовища. Про будову та принцип дії холодильника ми говорили в §13. Тому наразі зосередимо свою увагу на аналізі тих термодинамічних процесів, які відбуваються в холодильнику з точки зору їх відповідності зворотньому циклу Карно.
Нагадаємо, холодильник представляє собою замкнуту герметичну систему, заповнену речовиною яка легко переходить з газоподібного стану в рідкий і навпаки (аміак, фреон, сірчистий ангідрид, тощо). Основними технічними елементами холодильника (мал.18) є компресор (4), теплообмінник (1), морозильна камера (3) та регулюючий клапан (2).
а) б)
б)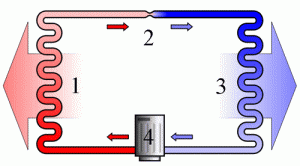
Мал.18. Загальний устрій (а) та принципова схема (б) холодильника.
Описуючи принцип дії холодильника та ті теплові процеси що в ньому відбуваються можна сказати наступне. Компресор у поєднанні з регулюючим клапаном, створюють в системі морозильної камери (випаровувача) зону зниженого тиску (р≈0,6атм), а в системі теплообмінника (конденсатора) – зону підвищеного тиску (р≈1,6атм). Крім цього, компресор змушує робоче тіло холодильника постійно циркулювати в системі компресор – теплообмінник – регулюючий клапан – морозильна камера – компресор. В процесі ж цього кругообігу відбуваються наступні події.
1. Помірно охолоджена рідина (робоче тіло) через регулюючий клапан потрапляє в систему морозильної камери, де швидко випаровується (розширюється) і відповідно охолоджується (приблизно до –20°С). Це швидке охолодження можна вважати адіабатним (мал.19б, лінія 1→2).
2. Поступово рухаючись каналами морозильної камери, холодний пар охолоджує навколишній простір і за рахунок отриманої від нього теплоти нагрівається (приблизно до –5°С). Це нагрівання можна вважати ізобаричним (лінія 2→3).
3. Виходячи з морозильної камери, пар за допомогою компресора нагнітається в систему теплообмінника (зону підвищеного тиску) де швидко конденсується (стискається) і відповідно нагрівається (приблизно до +50°С). Це швидке нагрівання можна вважати адіабатним (лінія 3→4).
4. Поступово рухаючись каналами теплообмінника, гаряча рідина частину своєї енергії віддає навколишньому середовищу і відповідно охолоджується (приблизно до кімнатної температура). Це поступове охолодження можна назвати ізобаричним (лінія 4→1). Помірно охолоджена рідина, через регулюючий клапан знову потрапляє в систему морозильної камери, і процес повторюється.
а) 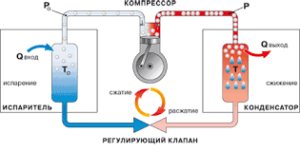 б)
б) 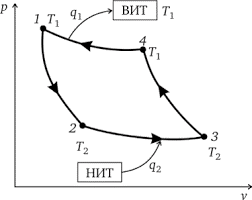
Мал.19. а) Принципово – конструктивна схема холодильника, б) схема теплового циклу холодильника.
Таким чином, примусово здійснивши замкнутий цикл, робоче тіло холодильника забрало певну кількість теплоти в морозильній камері і віддало її навколишньому середовищу. При цьому неважко бачити, що в загальних рисах реальний тепловий цикл холодильника схожий на зворотній цикл Карно.
Характерною особливістю холодильника є те, що виробляючи холод в одному місці, він неминуче генерує теплоту в іншому місці. При цьому, серед різноманіття електронагрівальних приладів, саме холодильник є енергетично найефективнішим. Пояснюючи цей парадоксальний факт, можна сказати наступне. Коли у вашій кімнаті світить лампочка, працює телевізор, вентилятор, електрокамін чи електродвигун, то та електроенергія яку споживає відповідний прилад у підсумку перетворюється на теплоту. І кількість цієї теплоти (Q) дорівнює кількості спожитої приладом електроенергії (виконаної роботи А): Q=A. Якщо ж говорити про ту теплоту, яку відає навколишньому середовищу теплообмінник холодильника (Q), то вона складається з двох частин: тієї теплоти яку отримує робоче тіло в результаті виконання механічної роботи (А), та тієї теплоти (Q2) яка переходить до теплообмінника від морозильної камери, тоб то Q=A+Q2. При цьому електроенергія витрачається лише на виконання механічної роботи. А це означає, що при одних і тих же енергетичних затратах, теплообмінник холодильника виробляє більше теплоти аніж будь який інший електронагрівальний прилад: A+Q2 > А.
Звичайно, холодильники створюють не для того щоб вони обігрівали наші помешкання, а якраз навпаки, щоб в певній обмеженій частині простору мати необхідно низьку температуру. Однак якщо холодильник, а точніше його теплообмінник, дійсно застосувати як електронагрівальний прилад, то він дійсно виявиться найефективнішим серед інших подібних приладів. І такі холодильники – обігрівачі дійсно існують. Їх називають тепловими насосами. Тепловий насос, це прикад який отримуючи теплову енергію від низькотемпературного зовнішнього джерела (наприклад зовнішнього повітря, грунту, води, тощо) перетворює цю енергію на високотемпературну та передає споживачу (наприклад в систему опалюванняпомешкання).
Тепловий насос по суті передставляє собою потужний холодильник, випаровувач (морозильна камера) якого знаходиться за межами будівлі, а його теплообмінник – всередині будівлі (мал.20). Принцип дії теплового насосу очевидно простий. В процесі роботи компресора, розташовані назовні та охолоджені приблизно до –20°С елементи системи випаровувача, отримуючи від значно теплішого зовнішнього середовища певну кількість теплоти відповідно нагріваються (≈ 0°С). В системі теплообмінника підігріте робоче тіло стискається, конденсується та нагрівається (≈ +60°С) і використовується в системі опалювання чи для інших потреб. І потрібно зауважити, що енергетична ефективність такої системи надзвичайно висока. Адже приблизно 75% тієї теплоти яку ви отримуєте в приміщенні, це практично безкоштовна енергія навколишнього середовища.
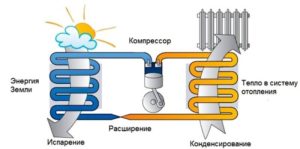
Мал.20. Схема принципового устрою теплового насосу.
Контрольні запитання.
1. Назвіть основні технічні елементи холодильника.
2. Поясніть принцип дії холодильника.
3. На якому етапі роботи холодильника, його робоче тіло отримує теплоту, а на якому віддає? Де відбуваються ці теплопередачі?
4. Порівняйте зворотній цикл Карно з реальним теповим циклом холодильника.
5. Чому холодильник можна вважати найефективнішим електронагрівальним приладом?
6. Чи можна вважати нагрівальним приладом телевізор, вентилятор, електродвигун? Поясніть.
7. Поясніть будову та принцип дії теплового насосу.
8. Чому теплообмінник теплового насосу (холодильника) виділяє більше енергії аніж споживає його компресор? Чи не суперечить цей факт закону збереження енергії?
Вправа 38.
1. Газ, розширюючись ізобарично при тиску 2·105Па, виконує роботу 0,2кДж. Визначити початковий об’єм газу, якщо його кінцевий об’єм дорівнює 2,5·10–3м3.
2. В ідеальній тепловій машині, за рахунок кожного кілоджоуля енергії отриманої від нагрівника, здійснюється робота 300Дж. Визначити ККД машини і температуру нагрівника, якщо температура охолоджувача 17°С.
3. Чому при випусканні газу з балона вентиль покривається росою або навіть інієм?
4. Як зміниться внутрішня енергія 280г азоту при його охолодженні на 100°С?
5. У вертикально розташованому циліндрі, площа основи якого 0,5дм3, під поршнем масою 6кг що ковзає без тертя міститься повітря. Під час ізобаричного нагрівання повітря, поршень піднімається на 20см. Яку роботу виконує повітря, якщо зовнішній тиск 100кПа?
6. Теплова машина, робочим тілом якої є одноатомний ідеальний газ, працює за циклом 1→2→3→4. Визначте ККД теплової машини.
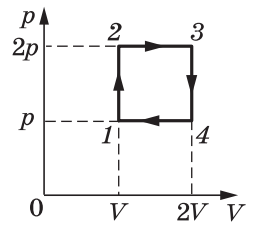
7. Теплова машина, робочим тілом якої є один моль одноатомного ідеального газу, працює за циклом 1→2→3→4. Визначте ККД теплової машини.
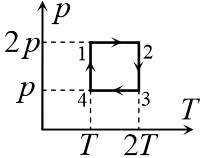
.
§39. Друге начало термодинаміки. Або про те, чому природні події відбуваються так, а не навпаки.
Аналізуючи ті події які відбуваються в навколишньому світі, не важко помітити, що вони незворотні. Виведений з рівноваги маятник, рано чи пізно зупиняється. І після цього можна як завгодно довго очікувати зворотних подій, але вони не відбудуться. Не відбудуться тому, що коливання маятника є незворотними. Той газ що знаходиться в одній половині посудини, після прибирання роздільної стінки, займає увесь доступний йому об’єм. При цьому марно очікувати того, що молекули газу самі собою повернуться до попереднього об’єму. Марно тому, що даний процес є незворотним. Нагріта деталь, при занурені в холодну воду швидко охолоджується. І можна чекати скільки завгодно, але система сама собою до початкового стану не повернеться. Не повернеться тому, що процес переходу теплоти від гарячого тіла до холодного є незворотним. Обєм
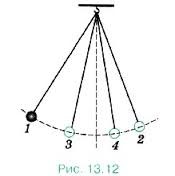
Мал.21. Деякі приклади незворотних процесів.
Звичайно, для всіх вище описаних та їм подібних випадків можна придумати певний «хитрий» пристрій, який би повертав систему до початкового стану: розгойдував маятник, стискав би до попереднього об’єму газ, охолоджував воду та нагрівав би деталь. Але, як ви розумієте, самі собою системи «хитрими» не стають і без певних енергетичних затрат не працюють. А тому ми констатуємо факт того, що природний хід подій є незворотний. Випускаєш з рук склянку, вона падає, розбивається і скільки не очікуй, а друзки самі собою не зберуться в єдине ціле і не стрибнуть назад в руку.
Якщо ви проаналізуєте відомі фізичні процеси та ті закони що їх описують, то неодмінно з’ясуєте, що практично всі вони симетричні. А це означає, що згідно з цими законами природні події можуть відбуватись як в прямому так і в зворотному напрямку. Але якщо закони Природи жодним чинам не протидіють зворотному ходу подій, то чому ж ці зворотні події самі собою не відбуваються? Відповідь на це та йому подібні запитання дає надзвичайно важливий закон, який називається другим началом термодинаміки.
Друге начало термодинаміки можна сформулювати по різному. Наприклад так: теплова енергія не може сама по собі переходити від холодного тіла до гарячого. Або так: неможливо здійснити такий тепловий процес при якому все надане системі тепло, повністю перетворилось би в механічну роботу. А можна і так: будь які процеси що відбуваються в замкнутій системі не можуть призвести до зменшення загальної ентропії цієї системи.
Та якими б не були формулювання другого начала термодинаміки, а його фізична суть залишається незмінною: в природних процесах, порядок легко і сам по собі перетворюється на безпорядок, а от безпорядок якщо і перетворюється на порядок то лише за наявності певної енергетичної доцільності і з певними енергетичними втратами. Ілюструючи цю фізичну суть, проведемо та проаналізуємо наступний простий експеримент.
Візьмемо дві склянки пшениці і зерна однієї з них пофарбуємо в чорний, зелений чи будь який інший колір. Акуратно висипаємо фарбоване та нефарбоване зерно в прозору скляну посудину. Висипаємо так, щоб чорне зерно було зверху а жовте знизу (або навпаки). При цьому ми отримаємо ситуацію, яка ілюструє певний порядок в розташуванні зерен: чорні – зверху, жовті – знизу.
Тепер беремо ложку, виделку, паличку чи що завгодно і починаємо перемішувати зерна. Ви робите один оберт, другий, третій, …, десятий і неодмінно бачите що чорні і жовті зерна перемішуються. Тепер давайте спробуємо повернути хід подій і зробимо ідеально такі ж оберти у зворотньому напрямку. Виконуючи ці зворотні рухи, ви неодмінно з’ясуєте, що система не повертається до попереднього стану. Ви можете як завгодно довго та як завгодно хитро перемішувати зерно в очікувані того що воно знову розташується в початковому порядку, але цього ніколи не відбудеться. І не тому, що цього не може бути взагалі, а тому що ймовірність цієї події є практично нулевою.
Оскільки ми заговорили про ймовірність тієї чи іншої випадкової події, то буде не зайвим з’ясувати суть того, що прийнято називати ймовірністю. За визначенням: ймовірність (р) певної випадкової події, це величина, яка дорівнює відношенню числа тих випадків коли очікувана подія відбувається (z), до загальної кількості можливих випадків (N), тобто: p = z/N. Наприклад, ймовірність того що в результаті неупередженого кидання грального кубика випаде цифра «5» становить р=1/6. Якщо ж ви одночасно кидаєте два кубики і очікуєте випадіння двох п’ятірок, то ця подія відбудеться з ймовірністю р=(1/6)(1/6)=1/36. Якщо ж в експерименті задіяно три кубики, то ймовірність одночасного випадіння трьох п’ятірок становить р=(1/6)(1/6)(1/6)=1/196.
Звичайно, це не означає що очікувана подія відбудеться на 196 киданні кубиків. Це навіть не означає, що в кожній серії яка складається з 196 кидань, один раз обов’язково випаде комбінація з трьох п’ятірок. Твердження: «ймовірність події становить 1/196» – означає лише те, що виконавши N експериментальних серій (де N – достатньо велике число), кожна з яких складається з 196 експериментів, ви отримаєте приблизно N очікуваних подій, тобто в середньому по одній очікуваній події на одну експериментальну серію. При цьому насправді, в деяких серіях очікувана подія може відбутися 2, 3, а то й 10 разів, а в деяких – не відбудеться жодного разу.
Зважаючи на вище сказане і виходячи з того, що в нашому експерименті з зерном приймають участь 200 фарбованих і 200 не фарбованих зернин, не важко визначити ймовірність того, що в процесі перемішування, зерна розташуються в певному порідку, наприклад чорні – зверху, жовті – знизу. Дійсно. Ймовірність того, що певна фарбована зернина опиниться в верхній частині посудини становить р=1/2. При цьому, ймовірність того, що всі 200 фарбованих зернин одночасно опиняться у верхній частині посудини становить р=(1/2)200=1/2200≈1/1063. Ілюструючи величину цієї ймовірності можна сказати наступне. Якщо ви за одну секунду встигнете виконати операцію перемішування зерен, встигнете зупинитись і подивитись на те чи не відбулась очікувана подія, то ймовірніше за все така подія відбудеться один раз на 1063 секунд. Для порівняння зазначимо, що вік нашого Всесвіту не перевищує 14·109 років, що приблизно становить 4,4·1017 секунд.
Тепер, коли ви знаєте що в процесі тих чи інших подій, порядок легко перетворюється на безпорядок, а от безпорядок сам по собі порядком не стає, не важко пояснити чому механічна робота легко та повністю перетворюється на теплоту, а от теплота сама собою роботою не стає. Дійсно. В процесі виконання роботи, певне тіло переміщується як єдине ціле. А це означає що всі частинки цього тіла, всі його атоми, молекули та електрони, рухаються як одне ціле, а отже рухаються упорядковано. Іншими словами, механічна робота (Амех), є енергією упорядкованого руху всіх частинок даного тіла. Якщо ж говорити про теплоту (Q), то вона як за визначенням так і за своєю суттю є енергією хаотичного руху молекул.
Переконатись в тому, що механічна робота (порядок) легко перетворюється на теплоту (безпорядок) не складно. Для цього достатньо потерти долоні рук одна об одну. При цьому неодмінно з’ясується, що виконавши певну механічну роботу (потерши долоні одна об одну) ви отримаєте відповідну кількість теплових відчуттів. Якщо ж говорити про кількісні докази такого перетворення, то першим хто отримав такі докази був Джоуль. В експериментах Джоуля, механічна робота (Амех), а точніше енергія обертального руху тіла, повністю перетворювалась в теплоту (Q).
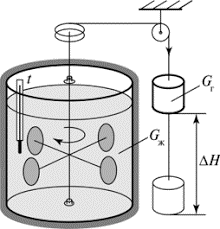
Мал.22. Механічна робота легко і повністю перетворюється на теплоту, а от теплота, сама собою в механічну роботу не перетворюється.
Але, якщо в процесі обертання зануреної у воду крильчатки (мал.111), енергія її механічного руху перетворюється на теплоту, то чому б молекулам води, бодай мізерну частинку своєї енергії не перетворити на механічну роботу? Адже тієї енергії яку можна отримати при охолоджені одного літра води всього на один градус, вистачить на те щоб підняти тіло масою 1кг на висоту 420м. Однак марно очікувати того, що якась мізерна частина наявної у воді теплової енергії, сама собою перетвориться на енергію механічного обертання крильчатки та піднімання бодай мізерного вантажу.
І це закономірно. Адже для того щоб крильчатка почала обертатись, рух молекул рідини має стати упорядкованим. При цьому абсолютно очевидно, що ймовірність події при якій 334·1023 хаотично рухомих молекул (а саме стільки їх міститься в одному літрі води), ні з того ні з сього почнуть рухатись в одному напрямку і що цей упорядкований рух буде тривати так довго, що крильчатка дійсно почне обертатись, практично нулева. Не менш очевидно і те, що в подібних ситуаціях терміни «малоймовірна подія» і «неможлива подія» є тотожними.
Звичайно, вище сказане не означає, що наяву у воді теплову енергію в принципі не можливо перетворити на механічну роботу. Скажімо, якщо пластинку крильчатки з одного боку нагріти, а з іншого – залишити холодною, то тиск молекул води на нагріту поверхню буде дещо більшим. При цьому за наявності достатнього перепаду температур, крильчатка почне обертатись та виконувати відповідну механічну роботу. Але як ви розумієте, самі собою поверхні крильчаток різнонагрітими не стають.
Таким чином, все різноманіття наявних фактів вказує на те, що в природі енергія порядку будь то енергія механічної роботи, енергія електричного струму, хімічних зв’язків чи біологічних процесів, легко перетворюється на енергію хаотичного руху молекул тобто теплоту. А от теплота сама собою енергією порядку не стає. Тому коли та чи інша система знаходяться в стані теплової рівноваги з навколишнім середовищем, то наявна в ній енергія теплового руху молекул сама собою не стає а ні енергією механічної роботи, а ні енергією електричного струму, а ні енергією біологічних структур.
Потрібно зауважити, що друге начало термодинаміки не суперечить ні першому началу термодинаміки, ні закону збереження енергії. В ньому лише констатується той факт, що Природа влаштована таким чином, що в ній енергія порядку легко перетворюється на енергію безпорядку, а от енергія безпорядку, якщо і перетворюється в енергію порядку то лише за наявності певних енергетичних причин.
При цьому, потрібно особливо підкреслити, що в другому началі термодинаміки не стверджується що безпорядок не може перетворюватись на порядок. В ньому говориться лише про те, що за відсутності енергетичних причин, таке перетворення є малоймовірним. Але якщо для подібного перетворення є певні енергетичні підстави, то безпорядок не лише може перетворюватись на порядок, а й практично неминуче цим порядком стає. Наприклад, в процесі кристалізації, хаотично розташовані молекули рідини, вишиковуються в певному, строго визначеному порядку. Вишиковуються тому, що такий порядок є енергетично доцільним. В процесі хімічних взаємодій, певні атоми об’єднуються в більш складні упорядковані структури – молекули. Об’єднуються тому, що таке об’єднання є енергетично доцільним. З плином часу, хаотично розташовані молекули аморфного тіла, вишиковуються в певному, енергетично доцільному порядку. Навіть те що ми називаємо життям і що характеризується надзвичайною складністю та упорядкованістю, є прямим наслідком факту того, що енергетично доцільна подія рано чи пізно відбувається. Втім, про енергетичні передумови виникнення та еволюційного саморозвитку життя на Землі, ми поговоримо ще не скоро.
Контрольні запитання.
1. Що означає твердження: фізичні закони симетричні.
2. Наведіть приклади незворотних подій. Поясніть причини цієї незворотності.
3. В чому суть другого начала термодинаміки?
4. Чи не суперечить другому началу термодинаміки факт того, що в холодильнику теплота переходить від холодного до гарячого?
5. Яка ймомірність того, що в результаті неупередженого викидання п’яти гральних кубиків, випаде п’ять п’ятірок? Що означає ця ймовірність?
6. Чому механічна робота легко і повністю перетворюється на теплоту, а от теплота перетворюється на роботу лише за певних умов і не повністю?
7. Чому енергія електричного струму легко перетворюється на теплоту, а от теплота сама собою електричним струмом не стає?
8. Чому теплові двигуни мають низький ККД?
9. Наведіть приклади того, як безпорядок природним шляхом стає порядком. Чи не суперечать ці перетворення другому началу термодинаміки?
.
§40. Чи загрожує Всесвіту «теплова смерть»?
В попередньому параграфі ми говорили про те, що природний хід подій є незворотним, і що це пов’язано з фактом того, що упорядкований рух молекул легко стає безладним, тоді як зворотний процес сам по собі не відбувається. Не відбувається не тому що цього не може бути взагалі, а тому що ймовірність такого розвитку подій є практично нулевою. Закон, який відображає такий стан речей називається другим началом термодинаміки. Цей закон можна сформулювати по різному. Наприклад так: якщо в системі є різниця температур, то з плином часу температура всіх її частин буде вирівнюватись, а кількість вільної енергії в системі, тобто тієї енергії яка здатна перетворюватись в її нетеплові форми, буде неухильно зменшуватись (звичайно за умови, що в системі нема енергетичних чинників які протидіють такому зменшенню). По іншому, таке формулювання другого начала термодинаміки називають законом зростання ентропії. Та суть не в назвах, а в змісті. А цей зміст полягає в тому, що в замкнутих системах кількість нетеплової енергії може тільки зменшуватись, звичайно за умови, що в цих системах нема енергетичних чинників які протидіють такому зменшенню.
Але якщо механічна, хімічна, електрична, біологічна та інші види енергії легко перетворюються в теплоту, а зворотній процес можливий лише за певних умов, то здається абсолютно очевидним, що рано чи пізно всі види енергії мають перетворитись на теплоту. Це означає, що рано чи пізно Всесвіт має прийти до такого стану, коли всі форми енергії будуть перетворені в енергію хаотичного руху частинок. Такий Всесвіт приречений на вічний тепловий спокій. Адже в ньому, ні за яких обставин енергія хаотичного руху частинок не зможе перетворитись на будь що інше. Невипадково такий стан Всесвіту називають його «тепловою смертю».
Прихід Всесвіту до стану «теплової смерті» формально не суперечить ні закону збереження енергії, ні другому началу термодинаміки. Більше того, якщо вважати друге начало термодинаміки таким же фундаментальним та всеосяжним законом Природи як і закон збереження енергії, і якщо виходити з того що у Всесвіті нема енергетичних факторів які б протидіяли загальному перетворенню будь яких видів енергії в теплоту, то потрібно визнати: згідно з другим началом термодинаміки, Всесвіт неминуче очікує «теплова смерть».
Однак в тому то й справа, що наші припущення не є достовірними. Адже насправді, друге начало термодинаміки не є таким же загальним та всеотяжним законом, як закон збереження енергії. По друге, у Всесвіті постійно діють певні енергетичні фактори які сприяють перетворенню енергії безпорядку в енергію інших видів.
Оскільки основним аргументом «теорії» теплової смерті Всесвіту є друге начало термодинаміки, то буде не зайвим ще раз уважно придивитись до фізичної суті цього безумовно видатного закону. І так. В другому началі термодинаміки стверджується, що теплота переходить від гарячого тіла до холодного, а не невпаки. Що молекули газу легко займають увесь наданий їм об’єм, але ніколи самі собою не збираються в половині цього об’єму. Що будь які процеси призводять до збільшення ентропії системи, тобто до збільшення безпорядку в ній. Що розкидані у Всесвіті частинки самі собою не збираються в одному місці і т.д.
Дійсно, якщо мова йде про так звані макрооб’єкти, тобто об’єкти звичних земних розмірів та мас, то для них, друге начало термодинаміки безумовно виконується за будь яких обставин. Безглуздо сподіватись на те, що ті молекули які знаходяться в 1м3 повітря, самі собою зберуться в половині цього oб’єму. Однак зовсім не обов’язково щоб те, що є безглуздим для макро тіл, буде таким же безглуздим для мікрооб’єктів. Наприклад, якщо ви візьмете «посудину» об’ємом 1·10–24м3, то за нормальних умов в ній виявиться приблизно 26 молекул газу. Не важко порахувати, що ймовірність того що всі 26 молекул опиняться в половині цього об’єму становить р=1/226 ≈1/108.
Звичайно, якби ви перемішували фарбовані та нефарбовані зерна і якби цикл такого переммішування тривав одну секунду, то подія ймовірність якої 1/108, відбувалась би приблизно один раз на три роки. Але оскільки мова йде про молекули, тобто частинки які в процесі свого руху за одну секунду стикаються одна з одною (читай перемішуються) 5·109 разів, то не важко довести, що очікувана подія буде відбуватись щонайменше 10 разів за секунду. А це означає, що опустивши в певну миттєвість ту перебірку яка ділить ваш мікрооб’єм навпіл, ви неодмінно з’ясуєте, що всі 26 молекул знаходяться в половині даного об’єму. Ви можете скільки завгодно випускати молекули із цієї половини, але вони знову і знову будуть повертатись назад. А це означає, що в об’ємі 10–24м3 друге начало термодинаміки не працює.
Мал.23. Те що безумовно достовірне для великої кількості молекул, може виявитись недостовірним для їх малої кількості.
В мікро об’ємі, друге начало термодинаміки не працює і в тому випадку коли стверджує: теплота не може переходити від холодного тіла до гарячого. Адже якщо в різних місцях посудини об’ємом 10–24м3 встановити «термометри» і проаналізувати їх показання, *) то неодмінно з’ясується що ці показання суттєво різні і такі що постійно змінюються. При цьому змінюються таким чином ніби теплова енергія переходить не лише від нагрітого тіла до холодного, а й навпаки.
*) Ясно, що в даному випадку мова йде про певні умовні термометри та про певну умовну температуру. Температуру, яка характеризує не середнє значення теплової енергії молекул, а миттєве значення цієї енергії в даній точці простору.
Вище сказане по суті означає, що друге начало термодинаміки не є загальним, всеосяжним законом. Не є бодай тому, що рамки достовірності цього закону в значній мірі обмежені. Тому коли ми стверджуємо, що згідно з другим началом термодинаміки Всесвіт неминуче очікує «теплова смерть», то будуємо свої передбачення на законі, достовірність якого є обмеженою. Адже ми не можемо з впевненістю стверджувати, що той закон який справедливий для об’єму 1м3 і не справедливий для об’єму 10–24м3, виявиться справедливим для об’єму 1060м3.
Втім, припустимо що друге начало термодинаміки є справедливим не лише для звичайних макрооб’єктів, а й для Всесвіту вцілому. Тим більше, що у нас нема вагомих підстав заперечувати це. Натомість у нас є всі підстави стверджувати, що навіть у випадку необмеженої достовірності другого начала термодинаміки, твердження про неминучість «теплової смерті» Всесвіту є безпідставним. Дійсно. Коли ми стверджуємо, що та чи інша система природним шляхом прагне до безпорядку, то маємо на увазі, що в цій системі нема енергетичних чинників які б прагнули організувати певний порядок в ній. Насправді ж у Всесвіті такі чинники є. І головний з них – всесвітнє тяжіння.
Адже саме сили тяжіння, збирають безладно розкидані частинки космосу в гігаснські газово-пилові туманності, зірки, планети та інші космічні об’єкти. Саме сили тіжіння об’єднують гіганські та дрібні космічні тіла в зіркові та планетарні системи, галактики, метагалактики та цілісний Всесвіт. Саме сили тяжіння розігрівають надра зірок до десятків і сотень мільйонів градусів і запалюють в них термоядерні топки, енергія яких перетворює тепловий хаос в енергію упорядкованого руху повітряних мас, річок та океанських течій, в енергію живої матерії, в енергію деревини, вугілля, нафти, тощо.
А це означає, що навіть в тому випадку, якщо енергію кругообігів води, повітря і живої матерії, енергію нафти, вугілля, та горючих газів, енергію руху планет, зірок та інших космічних тіл, перетворити на енергію хаотичного руху атомів, і навіть якщо ці атоми розкидати в безмежних просторах Всесвіту, сили всесвітнього тяжіння всерівно зберуть ці атоми в нові зірки, запалять в їх надрах нові термоядерні топки і створять необхідні умови для організації нових кругообігів неживої та живої матерії.
Тому, коли ми стверджуємо, що згідно з другим началом термодинаміки Всесвіт неминуче очікує теплова смерть, то висловлюєм однобоке, не обгрунтоване твердження, яке не враховує факту того, що в Природі постійно діють певні надпотужні чинники (зокрема сили гравітаційної взаємодії), які сприяють перетворенню безпорядку на порядок. А якщо Всесвіт і очікують певні еволюційні зміни, то вони зовсім не такі про які говорить гіпотеза теплової смерті Всесвіту.
Контрольні запитання.
1. Чому природний хід подій є незворотним?
2. Яка фізична суть другого начала термодинаміки?
3. Що стверджує гіпотеза «теплової смерті» Всесвіту?
4. На базі якого закону створено гіпотезу «теплової смерті» Всесвіту?
5. Наведіть приклади ситуацій в яких друге начало термодинаміки не діє.
6. Наведіть приклади ситуацій в яких безпорядок природним шляхом перетворюється на порядок.
7. Який головний природний чинник протидіє «тепловій смерті» Всесвіту?