ГАЗОПОДІБНІ РЕЧОВИНИ ТА ЇХ ВЛАСТИВОСТІ

Тема 2.2. Газоподібні речовини та їх властивості.
§10. Загальні відомості про пари та гази.
§11. Гази та їх властивості. Газові закони як узагальнення експериментальних фактів.
§12. Газові закони, як прямі наслідки (передбачення) молекулярно-кінетичної теорії.
§13. Розв’ язування задач. Тема: Термодинамічні процеси в графіках.
§14. Пари та їх властивості. Насичені і ненасичені пари. Випаровування та кипіння.
§15. Критичний стан речовини. Діаграма стану речовини.
§16. Вологість повітря та способи її вимірювання.
§17. Атмосфера Землі.
.
§10. Загальні відомості про пари та гази.
Дослідження показують, що все різноманіття газоподібних речовин (V≠const; Ф≠const; Еп ˂ Ек) можна розділити на дві суттєво різні групи: пари та гази. При цьому, одна і та ж речовина, за одних умов може бути паром, а за інших – газом. Чим же відрізняються пари від газів? Чому газоподібний кисень називають газом, а газоподібну воду – паром? За яких умов пар перетворюється на газ, а газ стає паром? Відповіді на ці запитання дають наукові визначення відповідних термінів.
Парами називають такі газоподібні речовини, які знаходяться при до критичних температурах (t ˂ tкр). Це означає що: 1) середня кінетична енергія молекул пару не набагато більша за їх середню потенціальну енергію (Ек > Еп); 2) пар можна перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Наприклад, якщо взяти газоподібну воду, газоподібний бензин чи газоподібний ефір, і при кімнатній температурі почати зменшувати їх об’єм, то в процесі стиснення, ці газоподібні речовини почнуть конденсуватись, тобто перетворюватись на відповідну рідину. Звичайно за умови, що стискається саме пар, а не суміш пару з газом. Адже якщо наприклад, шляхом стиснення ви захочите сконденсувати ту воду, невелика кількість якої міститься в повітрі вашої квартири, то скоріш за все не зможете цього зробити. Не зможете тому, що фактично будете стискати не пари води, а суміш великої кількості того газу який називається повітрям та незначної кількості парів води.
Мал.22. В процесі ізотермічного стиснення (m=const, T=const), пар перетворюється на відповідну рідину.
Газами називають такі газоподібні речовини, які знаходяться при за критичних температурах (t ˃ tкр). Це означає що: 1) середня кінетична енергія молекул газу набагато більша за їх середню потенціальну енергію (Ек >> Еп); 2) газ не можливо перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Наприклад якщо взяти газоподібний кисень (О2), газоподібний водень (Н2) чи газоподібний азот (N2) і при кімнатній температурі почати зменшувати їх об’єм, то неодмінно з’ясується, що за будь якого ступеню стиснення, в посудині буде знаходитись однорідна газоподібна речовина. При цьому, навіть в тому випадку коли густина цієї речовини стане більшою за густину рідини, скажімо води, у вас не буде підстав стверджувати, що в посудині з’явилась рідина. Не буде по перше тому, що в процесі стиснення ви не зафіксуєте моменту перетворення газу на рідину. А по друге, якою б густою не була та речовина що знаходиться в посудині, вона матиме основну властивість газу – при наданні цій речовині будь якого об’єму, вона практично миттєво займе увесь цей об’єм.

Мал.23. В процесі ізотермічного стиснення (m=const, T=const), газ не перетворюється на відповідну рідину.
Звичайно, факт того, що при кімнатній температурі газоподібний кисень, газоподібний водень та газоподібний азот не можливо перетворити на відповідну рідину, зовсім не означає, що цього не можливо зробити в принципі. Просто для того щоб газ перетворити на рідину, його спочатку потрібно перетворити на відповідний пар. А це означає, що газ потрібно охолодити до певної до критичної температури (t<tкр). Скажімо для кисню, ця критична температура становить –118,4ºС; для азоту –147,1ºС; для водню – 241ºС.
На завершення зауважимо, що більш детальна розмова про загальні властивості парів та газів, а заодно і про ту температуру яка називається критичною, відбудеться в наступних параграфах даної теми.
Контрольні запитання.
1. Які речовини називають газоподібними?
2. Чому пари і гази називають газоподібними?
3. Чому газоподібну воду називають пором, а газоподібний кисень – газом?
4. Яке стиснення називають ізотермічним?
5. Чи можна газоподібний кисень перетворити на відповідну рідину? Що для цього потрібно зробити?
6. Що випливає з твердження: «пар знаходиться при до критичній температурі»?
7. Що випливає з твердження: «газ знаходиться при за критичній температурі»?
.
§11. Газові закони, як узагальнення експериментальних фактів.
Нагадаємо. Газами називають такі газоподібні речовини (V≠const; Ф≠const; Еп ˂ Ек), які знаходяться при за критичних температурах (t ˃ tкр). Це означає що: 1) середня кінетична енергія молекул газу набагато більша за їх середню потенціальну енергію (Ек >> Еп); 2) газ не можливо перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Факт того, що середня кінетична енергія молекул газу набагато більша за їх середню потенціальну енергію (Ек >> Еп), по суті означає, що фізичні властивості хімічно різних газів є практично однаковими. Однаковими тому, що індивідуальні властивості речовини, визначальним чином залежать від енергії взаємодії її молекул. А оскільки для газів Еп << Ек, то загальна поведінка молекул газу, а отже і його загальні фізичні властивості, практично не залежать від індивідуальних особливостей тих молекул з яких цей газ складається. Те що хімічно різні гази мають практично однакові фізичні властивості, з усією очевидністю підтверджують так звані газові закони. Власне про ці закони ми і поговоримо в даному параграфі.
Фізичний стан певної маси газу (m=const) можна охарактеризувати трьома величинами: тиск (р), об’єм (V) та температура (Т). Ці величини прийнято називати основними термодинамічними параметрами газу. Процеси при яких так чи інакше змінюються термодинамічні параметри певної маси газу (m=const) називаються термодинамічними процесами. Термодинамічні процеси, при яких маса газу та один з його основних термодинамічних параметрів (р,V,Т) залишаються незмінними, називаються ізопроцесами (від грецького «ізос» – незмінний). Розрізняють три ізопроцеси:
ізотермічний: m=const, T=const;
ізобаричний: m=const, p=const;
ізохоричний: m=const, V=const;
Слова «термос», «барос», «хорема» мають грецьке походження і означають відповідно: «теплий» (температура), «важкий» (тиск), «ємність» (об’єм).
Напевно ви погодитесь з тим, що об’єм, тиск і температура певної маси газу є взаємо пов’язаними величинами. Адже кожен знає, що в процесі зменшення об’єму, тиск газу збільшується. Кожен знає, що в процесі нагрівання, гази розширюються. А якщо не розширюються, то результатом їх нагрівання є підвищення тиску. Закони, які відображають ті зв’язки що об’єктивно існують між об’ємом, тиском та температурою певної маси газу, називають газовими законами.
Важливість газових законів полягає в тому, що саме ці експериментально відкриті закони, стали тією експериментальною основою на базі якої була створена сучасна молекулярно-кінетична теорія. Достатньо сказати, що саме на основі аналізу тих співвідношень, які прийнято називати газовими законами, були визначені ті фундаментальні сталі, значимість яких виходить далеко за межі властивостей газів і які називаються абсолютним нулем (t= –273ºС), універсальною (молярною) газовою сталою (R=8,31Дж/К·моль), сталою Больцмана (k=1,38∙10–23Дж/К) та сталою Авогадро (NA= 6,02∙10231/моль). Зважаючи на ці обставини, газові закони потрібно розглядати не як певні мало значимі співвідношення між параметрами певної маси газу, а як ті експериментальні факти, які лежать в основі сучасної молекулярно-кінетичної теорії.
Газові закони.
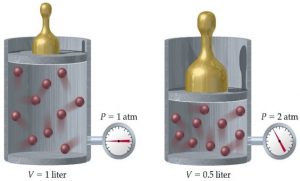
Закон Бойля – Маріотта – це закон, в якому стверджується: при ізотермічному процесі, добуток тиску будь якого газу на його об’єм, залишається незмінним. Іншими словами: якщо m=const, T=const то pV=const.

Мал.24. При ізотермічному процесі, добуток тиску газу на його об’єм залишається незмінним (закон Бойля – Маріотта).
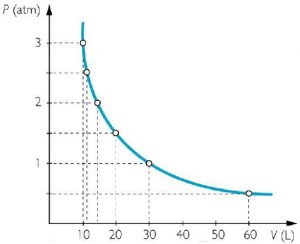
Даний закон був експериментально встановлений в 1662 році англійським фізиком Робертом Бойлем (1627–1691) та незалежно від нього, французьким фізиком Едмом Маріоттом (1620–1684). Суть закону Бойля-Маріотта очевидно проста: якщо при постійній температурі, об’єм певної маси газу зменшити в n разів, то його тиск в n разів збільшиться, а якщо цей об’єм в n разів збільшити, то тиск газу в n разів зменшиться.
Закон Бойля-Маріотта можна представити у вигляді відповідного графіку, який прийнято називати ізотермою. При цьому в різних системах координат одна і та ж ізотерма виглядає по різному (мал.25)
Мал.25. Загальний вигляд ізотерми в різних системах координат.
Закон Гей-Люсака – це закон, в якому стверджується: при ізобаричному процесі, відношення об’єму будь якого газу до його абсолютної температури залишається незмінним. Іншими словами: якщо m=const, р=const то V/T = const, або V/(t+273) = const.
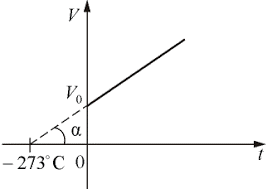
Мал.26. При ізобаричному нагріванні будь якого газу, його об’єм лінійним чином збільшується (закон Гей-Люсака).
Даний закон був експериментально встановлений в 1802 році, французьким фізиком Жозефом Луі Гей-Люсаком (1778–1850). Суть закону Гей-Люсака є наступною: якщо при постійному тиску (р=const), абсолютна температура (Т) певної маси газу збільшується в n разів, то в n разів збільшується і об’єм цього газу, а якщо температура газу зменшиться, то відповідно зменшиться і його об’єм. При цьому потрібно мати на увазі, що мова йде про абсолютну температуру газу, тобто температуру виміряну в кельвінах. Адже якщо наприклад, при постійному тиску, газ з температурою 2°С нагріти до 4°С, то його об’єм не збільшиться вдвічі. Для такого збільшення об’єму газ потрібно нагріти не до 4°С, а до 277°С, тобто від 275К (2°С) до 2·175К= 550К = 277°С.
Потрібно зауважити, що в часи Гей-Люсака температуру вимірювали не в кельвінах, а в градусах Цельсія і тому відповідний закон записувався не у вигляді V/T = const, а у вигляді V/(t+273) = const. Закон Гей-Люсака очевидно вказував на те, що в природі існує гранично низька температура, і що її величина –273ºС. Подальші дослідження показали, що таку температура дійсно існує, і що її величина дійсно дорівнює –273ºС (точніше –273,15ºС). Цю гранично низьку температуру називають абсолютним нулем.
Закон Гей-Люсака можна представити у вигляді відповідного графіку, який прийнято називати ізобарою. При цьому в різних системах координат одна і та ж ізобара виглядає по різному (мал.27)
Мал.27. Загальний вигляд ізобари в різних системах координат.
Чесно кажучи, ще за п’ятнадцять років до загально визнаної дати відкриття закону Гей-Люсака, аналогічний висновок зробив французький фізик Жак Шарль (1746–1823). Однак, результати своїх досліджень Шарль за лише йому відомих мотивів, тримав у таємниці. А це означає, що за загально прийнятими правилами, його не можна вважати автором відповідного закону. Тим не менше, в деяких наукових джерелах закон Гей-Люсака називають законом Шарля. Втім, в переважній більшості наукових джерел, законом Шарля називають ще один газовий закон, який по суті є похідним від законів Бойля – Маріотта та Гей-Люсака.
Закон Шарля – це закон, в якому стверджується: при ізохоричному процесі, відношення тиску будь якого газу до його абсолютної температури залишається незмінним. Іншими словами: якщо m=const, V=const то р/T = const, або р/(t+273) = const.

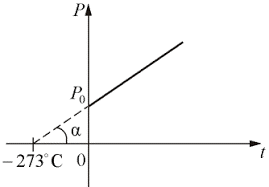
Мал.28. При ізохоричному нагріванні будь якого газу, його тиск лінійним чином збільшується (закон Шарля).
Закон Шарля можна представити у вигляді відповідного графіку, який прийнято називати ізохорою. При цьому в різних системах координат одна і та ж ізохора виглядає по різному (мал.29)
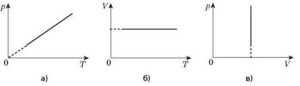
Мал.29. Загальний вигляд ізохори в різних системах координат.
Прямим наслідком законів Бойля – Маріотта, Гей-Люсака та Шарля (а фактично законів Бойля – Маріотта та Гей-Люсака), є закон який називають об’єднаним газовим законом. Об’єднаний газовий закон – це закон, в якому стверджується: для постійної маси будь якого газу, відношення добутку тиску газу на його об’єм до абсолютної температури газу, залишається незмінним. Іншими словами: якщо m=const, то pV/T=const або pV/(t+273)=const.
. p1V1/T1 = p2V2/T2 = p3V3/T3 = p4V4/T4
Мал.30. При будь яких термодинамічних процесах що відбуваються з певною масою газу, виконується співвідношення pV/T=const.
В 1834 році французький фізик Бенуа Клапейрон (1799–1864) записав об’єднаний газовий закон у вигляді, який прийнято називати законом Клапейрона (рівнянням Клапейрона). Закон Клапейрона – це закон, в якому стверджується: для одного моля будь якого газу виконується співвідношення pVмоль/Т=R, де R – постійна величина, яка називається універсальною (молярною) газовою сталою. Значення цієї величини визначається експериментально і становить R=8,31Дж/К∙моль. Універсальна (молярна) газова стала (R=8,31Дж/К∙моль), це постійна величина, яка показує на скільки джоулів зміниться загальна кінетична енергія одного моля газу, при зміні його температури на один кельвін.
В 1874 році російський хімік Дмитро Іванович Менделєєв (1834–1907) записав рівняння Клапейрона у вигляді, який дозволяє визначати величину співвідношення рV/Т для будь якої кількості молей газу: pV/T=(m/M)R, де m – загальна маса газу, M – молярна маса цього газу. Дану форму запису об’єднаного газового закону називають законом (рівнянням) Менделєєва – Клапейрона. Закон Менделєєва – Клапейрона – це закон, в якому стверджується: для довільної кількості молей будь якого газу, виконується співвідношення pV/T=(m/M)R, де m – загальна маса газу, M – молярна маса цього газу.
В 1811 році італійський фізик Амадео Авогадро (1776–1856), на основі аналізу багатьох експериментальних фактів, дійшов висновку: за однакових термодинамічних умов, в рівних об’ємах різних газів міститься однакова кількість молекул. Після того, як було сформульовано закон Клапейрона та визначено величину молярної газової сталої, закон Авогадро набув вигляду: Закон Авогадро – це закон, в якому стверджується: за нормальних умов (р=101,3кПа, Т=273К) один моль будь якого газу займає об’єм 22,4 літра (22,4∙10–3м3).
В 1801 році англійський вчений Джон Дальтон (1766–1844) сформулював закон, який прийнято називати законом Дальтона. В цьому законі стверджується: тиск суміші хімічно не взаємодіючих газів, дорівнює сумі тих парціальних тисків які створюють окремі складові цієї суміші, тобто р = р1 + р2 + … + рn . Наприклад, сухе повітря на 78% складається з азоту (N2) на 21% з кисню (О2) і на 1% з інших газів. При цьому, загальний тиск повітряної суміші можна представити як суму тих окремих (парціальних) тисків, які створюються складовими частинами цієї суміші.
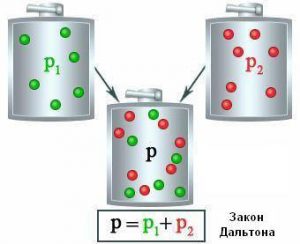
Мал.31. Тиск суміші газів, дорівнює сумі тисків окремих складових цієї суміші.
На завершення зауважимо, що газові закони в точності виконуються лише для так званого ідеального газу. Якщо ж мова йде про реальні гази (О2, N2, H2, He, Ne, Ar), то для них газові закони достатньо точно виконуються в області не надто високих тисків (р ˂ 20атм) і не надто низьких температур (t ˃ –100ºС).
Задача 1. Який об’єм займе газ при 77°С, якщо при 27°С його об’єм 5л ?
Загальні зауваження. В умові даної задачі чітко не вказано на те, що мова йде про ізобаричний процес (р1=р2). В подібних випадках потрібно приймати таке рішення яке дозволяє розв’язати відповідну задачу. А в даному випадку, однозначне рішення можливе лише за умови ізобаричного процесу (m = const, р1 = р2).
Дано:
m = const
р1 = р2
t1 = 27°С, Т = 300К
t2 = 77°С, Т = 350К
V1 = 5л
V2 = ?
Рішення. Оскільки при ізобаричному процесі (m = const, р1 = р2) V1/T1 = V2/T2, V2 = V1(T2/T1) = 5л(350К/300К) = 5,8л
Відповідь: V2 = 5,8л.
Задача 2. В балоні міститься газ при температурі 17°С і тиску 1,5МПа. На скільки зміниться тиск, коли температура знизиться до –23°С ?
Дано:
t1 = 17°С, Т1 = 290К
p1 = 1,5МПа
t2 = –23°С, Т2 = 250К
∆р = ?
Рішення. Будемо виходити з того, даний процес ізохоричний (m = const, V1 = V2), і що тому р1/Т1 = р2/Т2, звідси р2 = р1(Т2/Т1) = 1,5МПа(250К/290К) = 1,3МПа. Таким чином ∆р = р2 – р1 = 1,3МПа – 1,5МПа = –0,2МПа, де знак «–» вказує на те, що в результаті даного ізопроцесу тиск газу зменшився.
Відповідь: ∆р = –0,2МПа.
Задача 3. Визначити густину водню при температурі 17°С і тиску 204кПа.
Дано:
Н2
t=17°C, Т = 290К
p=204Па = 204·103Па
ρ = ?
Рішення. За визначенням ρ = m/V. Оскільки згідно з законом Менделєєва-Клапейрона pV/T=(m/M)R, то m/V = pM/TR. Таким чином, густину газу можна визначити за формулою ρ= pM/TR, де R=8,31Дж/К∙моль, М(Н2)= 2г/моль = 2·10–3 кг/моль.
Розрахунки: [ρ] = (Па·кг/моль)/(Дж/К·моль)К = Па·кг/Дж = Н·кг/м2·Н·м= кг/м3;
ρ= pM/TR = (204·103·2·10–3)/(290·8,31) = 0,17кг/м3.
Відповідь: ρ = 0,17кг/м3.
Задача 4. Який об’єм повітря вийде з кімнати, при підвищенні температури в ній з 15ºС до 25ºС? Об’єм кімнати 120м3.
Дано:
tп=15°C, Т = 288К
tк=25°C, Т = 298К
V=120м3
ΔV = ?
Рішення. Будемо виходити з того, що тиск повітря в кімнаті до та після нагрівання залишається незмінним (р1=р2) і рівним атмосферному. В такій ситуації об’єднаний газовий закон (р1V1/T1= р2V2/T2) набуває вигляду V1/T1= V2/T2. Враховуючи, що V2=V1+ΔV, можна записати. V1/T1=(V1+ΔV)/T2. Звідси V1+ΔV = V1T2/T1, звідси ΔV = V1[(T2/T1) – 1].
Розрахунки: ΔV = V1[(T2/T1) – 1] = 120м3[(298К/288К) – 1] = 4,17м3.
Відповідь: ΔV = 4,17м3.
Контрольні запитання.
1. На що вказує те, що середня кінетична енергія молекул газу набагато більша за енергію їх взаємодії? Які факти це підтверджують?
2. Які величини характеризують фізичний стан певної маси газу?
3. Які процеси називаються а) термодинамічними; б) ізопроцесами?
4. В чому історична важливість газових законів?
5. Якого вигляду набуває об’єднаний газовий закон для: а) ізобаричного процесу; б) ізохоричного процесу; в) ізотермічного процесу?
6. Що показує універсальна газова стала?
7. Що стверджується в законі Менделєєва-Клапейрона?
8. Що стверджується в законі Авогадро?
9. Яка обов’язкова умова є спільною для всіх газових законів?
Вправа 11.
1. При температурі 0ºС тиск газу в закритій посудині 101кПа. Яким буде цей тиск при температурі 40ºС?
2. Об’єм газу при температурі 27°С і тиску 1,5атм становить 10л, яким буде цей об’єм за нормальних умов?
3. Визначити масу вуглекислого газу в балоні ємністю 40л при температурі 17°С і тиску 50атм.
4. Визначити густину кисню при температурі 17°С і тиску 204кПа.
5. В посудині об’ємом 5л знаходиться 10г кисню і 20г азоту. Який тиск суміші цих газів при температурі 27ºС?
6. При ізобаричному нагрівання газу, його густина збільшилась вдвічі. Як і у скільки разів змінилась абсолютна температура газу?
7. В балоні міститься газ при температурі 17°С і тиску 1МПа. На скільки знизиться тиск газу при його охолодженні до –23°С?
8. На якій глибині радіус повітряної бульбашки зменшиться вдвічі, порівняно з її радіусом біля поверхні води?
.
§12. Газові закони, як прямі наслідки (передбачення) молекулярно-кінетичної теорії.
В попередньому параграфі ми сформулювали вісім газових законів, кожен з яких є узагальненням відповідних експериментальних досліджень. Законів, для експериментального відкриття яких знадобились зусилля багатьох поколінь видатних вчених. Сьогодні ж, коли зусиллями цих вчених створено струнку систему знань, яка називається молекулярно-кінетичною теорією, все різноманіття газових законів можна «відкрити» буквально за 10 хвилин. Зробивши ці відкриття, ви безумовно переконаєтесь в тому, яким потужним та інформативним джерелом знань є наукова теорія.
Перш за все зауважимо, що при теоретичному описанні властивостей будь якого реального об’єкту, цей реальний об’єкт завжди замінюють певною, спрощеною (ідеалізованою) моделлю цього об’єкту. Моделлю, яка враховує всі суттєво важливі обставини і не враховує ті обставини, які в умовах даної задачі є не суттєвими. Скажімо, реальний газ, це надзвичайно складна система, яка складається з неймовірно величезної кількості молекул, кожна з яких має надзвичайно складний внутрішній устрій. При цьому, кожна молекула безперервно та безладно рухається і складним чином взаємодіє з іншими молекулами. Ясно, що бездоганно точно описати поведінку цієї надскладної системи практично не можливо. Цю поведінку можна теоретично описати лише в тому випадку, якщо реальний газ замінити певним чином спрощеною (ідеалізованою) моделлю цього газу. Впроваджуючи таку модель, враховують наступні властивості реальних газів.
По перше. За нормальних умов, будь який реальний газ достатньо сильно стискається. А це означає, що відстані між молекулами газу є відносно великими і що тому, індивідуальними особливостями форми цих молекул можна знехтувати, та вважати ці молекули відповідними кульками.
По друге. Будь який реальний газ займає увесь наданий йому об’єм. А це означає, що в процесі взаємодії, молекули газу ведуть себе як пружні кульки: в процесі пружного удару, кінетична енергія кульки спочатку зменшується до нуля, а потім збільшується до початкової величини. В такій ситуації, загальна поведінка молекул газу практично не залежить від величини їх потенціальної енергії і тому цією енергією можна знехтувати, тобто вважати що для газу Еп=0. Звичайно, це не означає що потенціальна енергія молекул газу дійсно дорівнює нулю. Адже потенціальна енергія, це надзвичайно складний вид прихованої енергії, прояви якої можуть бути надзвичайно різноманітними. Тому, коли ми стверджуємо, що потенціальна енергія молекул газу дорівнює нулю, то маємо на увазі лише факт того, що загальний вплив цієї енергії на кінематичну поведінку молекул газу є практично нулевим.
В третіх. Тиск газу в усіх напрямках є практично однаковим. А це означає, що при хаотичному русі молекул, кожний напрям руху є однаково імовірним, і що тому, в будь який момент часу, в сторону будь якої стінки куба, рухається одна шоста частина тих молекул що знаходяться в цьому кубі.
Враховуючи вище сказане, при теоретичних дослідженнях, реальний газ можна замінити його спрощеною фізичною моделлю, яку прийнято називати ідеальним газом. Ідеальний газ – це спрощена (ідеалізована) модель реального газу, в якій: 1) молекули – ідеально круглі пружні кульки; 2) енергія взаємодії молекул дорівнює нулю (Еп=0); 3) в сторону будь якої стінки куба, в будь який момент часу рухається 1/6 частина наявних молекул.
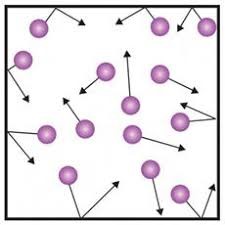
Мал.32. Ідеальний газ – це спрощена модель реального газу.
Ілюструючи суть теоретичних досліджень та узагальнюючу інформативність молекулярно-кінетичної теорії, розв’яжемо наступну задачу.
Задача. Спираючись на розуміння суті того що називають тиском, температурою, об’ємом, кількістю речовини, концентрацією молекул, тощо, «відкрити» все різноманіття газових законів, тобто тих співвідношень які існують між об’ємом (V), тиском (р) та температурою (Т) певної маси (m=const) ідеального газу.
Дано: ідеальний газ, m = const, V = SΔℓ, p = F/S, T = Ek/(3/2)k, Ek = m0v2/2,
k = 1,38·10–23Дж/К, NA = 6,022·10231/моль, n0 = N/V, F = ma, a = ∆v/∆t, ν = m/M. Відкрити газові закони.
Рішення: Аналізуючи визначальні рівняння тих фізичних величин, які є предметом наших теоретичних досліджень (V=SΔℓ; p=F/S; T = Ek/(3/2)k), не важко збагнути, що в даному переліку величин, ключовою є тиск. Адже саме в визначальному рівнянні тиску (p = F/S), опосередковано приховані як об’єм (V=ƒ(S)), так і температура (тиск залежить від сили ударів молекул, яка в свою чергу пов’язана з їх кінетичною енергією, а отже – з температурою газу). Виходячи з цих міркувань, наші теоретичні дослідження почнемо з аналізу того що називають тиском, тобто з аналізу рівняння р = F/S.
З’ясовуючи ті обставини від яких залежить тиск газу, потрібно врахувати наступне. 1) Загальна силова дія газу (F) на задану поверхню, є результуючою силової дії окремих молекул цього газу, величину якої можна визначити за формулою F = NудF0, де Nуд – загальна кількість ударів молекул по заданій поверхні; F0 – сила удару однієї молекули. 2) В процесі пружного удару, швидкість молекули (v) спочатку зменшується до нуля, а потім – збільшується до початкової величини. А це означає, що за час пружного удару (∆t) швидкість молекули газу змінюється на величину ∆v=2v. 3) Оскільки в заданому напрямку рухається лише 1/6 частина молекул, то кількість тих ударів які отримує поверхня площею S за гранично малий час Δt, можна визначити за формулою Nуд = (1/6)∆N = (1/6)n0∆V = (1/6)n0S∆ℓ = (1/6)n0Sv∆t, де ΔN – кількість молекул в приповерхневому шарі газу об’ємом ΔV=SΔℓ, n0 – концентрація молекул газу.
Зважаючи на вище сказане, та враховуючи що за визначенням F0=m0a; a=∆v/∆t, можна записати: p = F/S = NудF0/S = Nудm0a/S = Nудm0∆v/S∆t = Nудm02v/S∆t = (1/6)n0S∆ℓm02v/S∆t = (1/3)n0m0vΔℓ/Δt= (1/3)n0m0v2, тобто р=(1/3)n0m0v2, або р=(2/3)n0Ек (1)
Таким чином, ми отримали рівняння яке кількісно відображає факт того, що тиск газу залежить від концентрації його молекул (n0) та величини їх середньої кінетичної енергії (Ек=m0v2/2). Рівняння р=(1/3)n0m0v2, або р=(2/3)n0Ек називають основним рівнянням молекулярно-кінетичної теорії газів. Така назва повністю відповідає тій винятково важливій ролі, яку відіграє дане рівняння в молекулярно-кінетичній теорії. Достатньо сказати, що на основі елементарного математичного аналізу рівняння р=(2/3)n0Ек, можна вивести (теоретично відкрити) все різноманіття відомих газових законів. Дійсно. Зважаючи на те що Ек=(3/2)kT; n0=N/V, можна записати: р=(2/3)n0Ек=(2/3)(N/V)(3/2)kT=NkT/V. Звідси: pV/T=Nk (2).
Із аналізу рівняння (2) ясно, що величина співвідношення pV/T залежить від кількості молекул (N) в наявному об’ємі газу. Визначаючи цю кількість можна виділити три ситуації:
1.В заданому об’ємі міститься невідома, але постійна кількість газу (m=const). Ясно, що в такій ситуації кількість молекул газу залишається незмінною (N=const) і тому рівняння (2) можна записати у вигляді pV/T=const (об’єднаний газовий закон). І не важко збагнути, що прямими наслідками об’єднаного газового закону є:
– закон Бойля – Маріотта: якщо m=const, T=const то pV=const;
– закон Гей-Люсака: якщо m=const, p=const, то V/T=const;
– закон Шарля: якщо m=const, V=const, то p/T=const.
2. В заданому об’ємі міститься постійна кількість газу (m=const) і величина цієї кількості 1моль. В такій ситуації: N=NA=6,022·1023 молекул. А це означає, що рівняння (2) набуває вигляду pVмоль/T=NAk= 6,02∙1023(1/моль)·1,38∙10–23Дж/К = 8,31Дж/К·моль= R (закон Клапейрона).
3. В заданому об’ємі міститься постійна кількість газу (m=const) і величина цієї кількості ν=m/M (моль). В такій ситуації, кількість молекул газу становить: N=νNA=(m/M)NA, де М – молярна маса газу. А це означає, що рівняння (2) набуває вигляду pV/T=(m/M)R (закон Менделєєва-Клапейрона).
Якщо ж говорити про закони Дальтона та Авогадро, то і вони є прямими наслідками рівняння (2). Дійсно. Для одного моля газу, рівняння (2) набуває вигляду pVмоль/T= R. При цьому, за нормальних умов, тобто при температурі Тн=273К і тиску рн=1,01·105Па: Vмоль=RТн/рн=22,4∙10–3м3=22,4л. Висновок: за нормальних умов, один моль будь якого газу (ідеального газу) займає об’єм 22,4 літра (закон Авогадро).
Для суміші різних, хімічно не взаємодіючих газів, загальну кількість молекул (N) можна визначити за формулою N=N1+N2+…+Nn , де N1, N2,… Nn – кількість молекул кожної складової частини суміші. А це означає, що для суміші газів, рівняння (2) можна записати у вигляді p = N(kT/V) = (N1+N2+…+Nn)(kT/V) = p1+p2+…+pn . Висновок: тиск суміші хімічно не взаємодіючих газів, дорівнює сумі тих парціальних тисків які створюють окремі складові цієї суміші (закон Дальтона).
Результати наших теоретичних міркувань можна представити у вигляді наступної узагальнюючої таблиці.
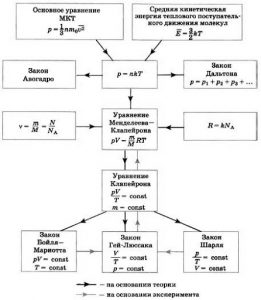
Мал.33. Газові закони, як прямі наслідки (передбачення) молекулярно-кінетичної теорії.
Факт того, що газові закони, з одного боку є узагальнюючим результатом експериментальних фактів, а з іншого – передбаченнями молекулярно-кінетичної теорії, безумовно вказує на те, що відповідна теорія є правильною. Крім того, факт того що в широкому діапазоні тисків та температур, ті газові закони які описують властивості реальних газів, практично в точності співпадають з тими законами які описують властивості ідеального газу, безумовно вказує на те, що наша модель ідеального газу є надзвичайно вдалою.
Задача 1. Визначити середню квадратичну швидкість молекул газу, густина якого 1,8кг/м3, а тиск 1,5атм.
Дано:
ρ=1,8кг/м3
р=1,5атм=1,5∙105Па
v = ?
Рішення. У відповідності з основним рівнянням м.к.т. газів р=(1/3)n0m0v2. З іншого боку, за визначенням ρ=m/V=m0N/V=m0n0. А це означає, що між тиском газу (р) та його густиною (ρ) існує співвідношення р=(1/3)ρv2. Звідси випливає v=√(3p/ρ).
Розрахунки: [v]=[√(3p/ρ)] = √(Па/кг/м3) =√(кг·м3/кг·м·с2) = √(м2/с2) = м/с;
v=√(3p/ρ) = √(3·15·104/1,8) = 500м/с.
Відповідь: v = 500м/с.
Задача 2. В посудині об’ємом 1л знаходиться 2г кисню і 4г азоту. Який тиск суміші цих газів при температурі 27ºС?
Дано:
V=1л=1·10–3м3
m1= m(O2)=2г
m2= m(N2)=4г
t=27°C, Т = 300K
p = ?
Розрахунки. Згідно з законом Дальтона р = р1 + р2. Згідно з законом Менделєєва–Клапейрона pV/T=mR/M, звідси p=mRT/MV = (RT/V)(m/M) Таким чином р = p1 + p2 = RT(m1/M1 + m2/M2)/V, де M1 = M(O2) = 28(г/моль), M2 = M(N2) = 32(г/моль).
Розрахунки: р=8,31·300∙(2/32 + 4/28)/1·10–3 = 5,1·105Па.
Відповідь: р = 5,1·105Па.
Задача 3. В циліндрі під поршнем площею 100см2 знаходиться 20г азоту при температурі 0ºС. На яку висоту підніметься поршень при нагріванні газу на 100ºС? Маса поршня 100кг. Атмосферний тиск 100кПа.

Дано:
S=100см2=1·10–2м2
m(N2)=20г=20·10–3кг
t1=0°C, Т = 273К
t2=100°C, Т=373К
m=100кг
pа=100кПа=1·105Па
Δh = ?
Рішення. Виконуємо малюнок який відображає фізичний зміст задачі. Будемо виходити з того, що в обох ситуаціях газ знаходиться під тиском, що дорівнює сумі атмосферного тиску та того тиску який поршень, р1 = р2 = ра + mg/S = 1·105 + 100·10/1·10–2= 2·105Па. Оскільки згідно з законом Менделєєва–Клапейрона pV/T=mR/M, то V1=m(N2)RТ1/M(N2)р1 = 20·10–3·8,31·273/28·10–3·2·105= 8,1·10–3м3;
V2=m(N2)RТ2/M(N2)р2 = 20·10–3·8,31·373/28·10–3·2·105= 11,1·10–3м3.
Таким чиним, різниця об’ємів газу становить ΔV=V2–V1=3,0·10–3м3. А враховуючи, що ΔV=SΔh, можна записати Δh=ΔV/S= 3,0·10–3м3/1·10–2м2= 0,3м.
Відповідь: Δh = 0,3м.
Контрольні запитання.
1. Який газ – водень (Н2) чи гелій (Не), за однакових умов більш схожий на ідеальний? Чому?
2. Яка властивість реальних газів дозволяє стверджувати, що енергія взаємодії їх молекул дорівнює нулю? Чи означає це, що відповідна енергія дійсно дорівнює нулю?
3. Що називають ідеальним газом?
4. Чому, теоретично з’ясовуючи ті зв’язки які існують між об’ємом, тиском та температурою, в якості ключової величини обирають тиск?
5. Чим схожі і чим відрізняються стала Больцмана та універсальна газова стала?
6. Наведіть приклади ситуацій, в яких тиск газу збільшується за рахунок збільшення: концентрації молекул; б) швидкості руху молекул.
7. Виходячи з визначального рівняння тиску, виведіть основне рівняння молекулярно-кінетичної теорії.
8. На основі аналізу основного рівняння м.к.т. визначте залежність тиску газу від його густини.
Вправа 12.
1. Густина газу при тиску 100кПа становить 1,43кг/м3. Визначте середню квадратичну швидкість молекул цього газу.
2. Визначте концентрацію молекул газу при температурі 27ºС і тиску в одну атмосферу. Чи залежить ця концентрація від сорту газу?
3. Посудина ємністю 20 літрів наповнена азотом, тиск якого 2атм, а температура 27ºС. Визначте масу азоту в посудині.
4. Визначте густину вуглекислого газу при температурі 17°С і тиску 5атм.
5. При ізохоричному нагріванні газу, його температура зросла від 10ºС до 20ºС. У скільки разів збільшився тиск газу?
6. В лабораторних умовах при температурі 20ºС створено глибокий вакуум який відповідає тиску 1,33∙10–9Па. Скільки молекул залишатиметься при цьому в кожному см3 даного вакууму?
7. Герметично закрита посудина повністю заповнена водою при температурі 27°С. Яким став би тиск в посудині, якби сили взаємодії між молекулами води зникли?
8. Дві посудини об’ємом V1 i V2 з’єднані трубкою з краном. Посудини наповнені газами однакової температури Т і тиском відповідно р1 і р2. Яким буде тиск р в посудинах після відкривання крану? Гази в хімічні реакції не вступають.
.
§13. Розв’язування задач. Тема: термодинамічні процеси в графіках.
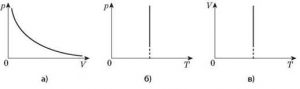
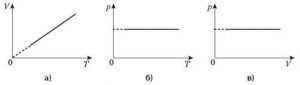
Загальну суть ізотермічного (m=const, T=const), ізобаричного (m=const, p=const) та ізохоричного (m=const, V=const) процесів, можна представити у вигляді відповідної ізотерми (мал.34а), ізобари (мал.34б) та ізохори (мал.34в).
При цьому, потрібно мати на увазі, що в різних системах координат ізотерми, ізобари та ізохори виглядають по різному (мал.34г).

Мал.34.Загальні вигляди ізотерм, ізобар та ізохор в різних системах координат.
Рішення переважної більшості тих задач в яких термодинамічні процеси представлені у вигляді певного графіку, по суті зводиться до того, що на основі аналізу відповідного графіку та об’єднаного газового закону (якщо m=const, то pV/T=const), або похідних від нього законів Бойля-Маріотта, Гей-Люсака, Шарля, визначаються невідомі величини. А оскільки нема кращого способу навчитися розв’язувати задачі, аніж той при якому ці задачі практично розв’язуються, то власне цим способом і будемо послуговуватись.
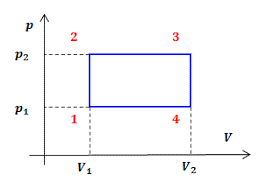
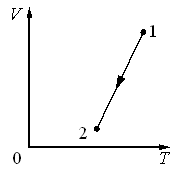
Задача 1. На малюнку зображено дві ізобари, побудовані для однієї і тієї ж маси газу. Порівняйте тиски цих газів. Зробіть узагальнюючий висновок.
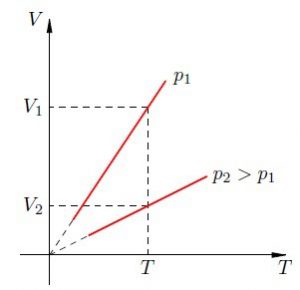
Рішення. Оскільки мова йде про одну і ту ж масу газу, то можна стверджувати, що згідно з об’єднаним газовим законом p1V1/T1=p2V2/T2. Із аналізу графіків видно, що при одній і тій же температурі (Т1=Т2) гази мають різні об’єми. При цьому, V1 ˃ V2. А це означає що р1 ˂ р2. Дійсно, якщо Т1=Т2 і V1˃V2, то із p1V1/T1=p2V2/T2 випливає, що р1 ˂ р2.
Висновок. Нахил ізобари залежить від тиску газу: чим більший тиск, тим
менший нахил (відносно осі температур).
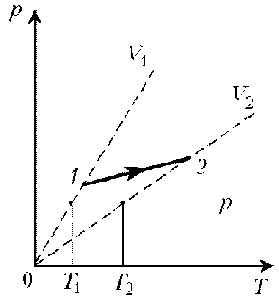
Задача 2. На малюнку зображено дві ізотерми, побудовані для однієї і тієї ж маси газу. Порівняйте температури цих газів.
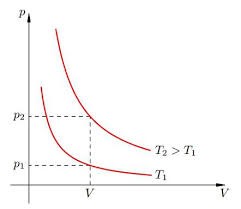
Рішення. Оскільки мова йде про одну і ту ж масу газу, то можна стверджувати, що згідно з об’єднаним газовим законом p1V1/T1=p2V2/T2. Із аналізу графіків видно, що при одному і тому ж об’ємі газу (V1=V2) гази мають різні тиски. При цьому, р2˃р1. А це означає що Т2>Т1. Дійсно, якщо V1=V2 і р2˃р1, то із p1V1/T1=p2V2/T2 випливає, що Т2>Т1.
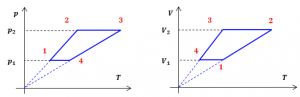
Задача 3. За представленим на малюнку графіком зміни стану ідеального газу в координатах р-V, побудувати відповідні графіки в координатах р-Т і V-T.
Рішення. Із аналізу заданого графіку ясно, що процеси які відповідають переходам 1→2 і 3→4 є ізохоричними (V=const). А це означає, що в координатах р-Т цим переходам відповідають певні ізохори, тобто прямі які проходять через точку Т=0. При цьому кут нахилу ізохори залежить від величини об’єму газу: чим більший об’єм, тим менший кут нахилу. Зважаючи на вище казане, будуємо відповідний графік в координатах р-Т. (Оскільки числові значення об’ємів, тисків та температур не задані, то відповідний графік має загальний вигляд).
Із аналізу заданого графіку ясно, що процеси які відповідають переходам 2→3 і 4→1 є ізобаричними. А це означає, що в координатах V-Т цим переходам відповідають певні ізобари, тобто прямі які проходять через точку Т=0. При цьому кут нахилу ізобари залежить від величини тиску газу: чим більший тиск, тим менший кут нахилу. Зважаючи на вище казане, будуємо відповідний графік в координатах V-Т. (Зауваження: на графіку точки 2 і 4 потрібно поміняти місцями).
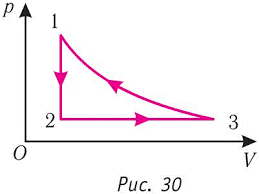
Задача 4. За заданим графіком термодинамічного процесу опишіть цей процес (ділянка 1-2 є ізотермою).
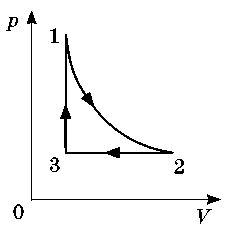
Рішення. На основі почергового аналізу кожної ділянки заданого графіку та застосування об’єднаного газового закону (рV/T=const) можна зробити наступні висновки.
На ділянці 1-2 газ ізотермічно (Т=const) розширюється (V↑). А це означає, що на цій ділянці виконується закон Бойля-Маріотта (рV=const) і тому тиск газу зменшується р↓. Таким чином на ділянці 1-2:
– температура газу не змінюється (Т=const),
– об’єм газу збільшується (V↑),
– тиск газу зменшується (р↓),
– виконується співвідношення рV=const.
На ділянці 2-3, тиск газу залишається незмінним (р=const), а його об’єм зменшується (V↓). А це означає, що на цій ділянці виконується закон Гей-Люсака (V/T=const) і тому газ ізобарично охолоджується. При цьому:
– тиск газу не змінюється (р=const)
– об’єм газу зменшується (V↓),
– температура газу зменшується (Т↓),
– виконується співвідношення V/T=const.
На ділянці 3-1, об’єм газу залишається незмінним (V=const), а його тиск збільшується (р↑). А це означає, що на цій ділянці виконується закон Шарля (р/T=const) і тому газ ізохорично нагрівається (Т↑). При цьому:
– об’єм газу не змінюється (V=const),
– тиск газу збільшується (р↑),
– температура газу збільшується (Т↑),
– виконується співвідношення р/T=const.
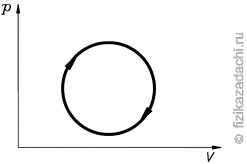
Задача 5. Графік термодинамічного процесу в координатах V-Т має вигляд кола. На якій ділянці цього графіку тиск газу збільшується а на якій зменшується?
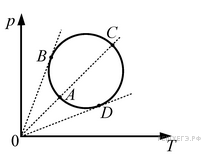
Рішення. Розв’язуючи задачу 1, ми з’ясували, що кут нахилу ізобари (α) залежить від тиску газу: при зростанні тиску (р↑) цей нахил зменшується (α↓) і навпаки. А це означає, що для даного колового процесу, найбільший тиск буде в тій точці через яку пройде ізобара з найменшим нахилом, тобто в точці В. А найменший тиск буде в тій точці через яку пройде ізобара з найбільшим нахилом, тобто в точці D. Із вище сказаного ясно, що на ділянці B→C→D тиск зростає, а на ділянці D→A→B – падає.
Задача 6. За заданим графіком термодинамічного процесу, визначити характер зміни об’єму газу (маса газу незмінна).
Рішення. Оскільки лінія заданого теплового процесу не проходить через точку Т=0К, то ця лінія не є ізохорою (V≠const). Для з’ясування того, як в заданому термодинамічному процесі змінюється об’єм газу, виконуємо декілька додаткових побудов. По перше, через точки 1 і 2 проводимо дві ізохори (V1=const, V2=const). По друге, проводимо довільну ізобару (р=const) яка перетинає обидві ізохори.
Із аналізу проведених побудов видно, що при р=const: Т2˃Т1. А це означає, що згідно з законом Гей-Люсака (V1/Т1=V2/Т2), об’єм газу в точці 1 має бути меншим за його об’єм в точці 2: V1 ˂ V2 . Таким чином, в заданому термодинамічному процесі об’єм газу збільшується.
Зауваження: розв’язуючи дану задачу, замість довільної ізобари можна провести довільну ізотерму, та застосовуючи закон Бойля-Маріотта, зробити аналогічний висновок.
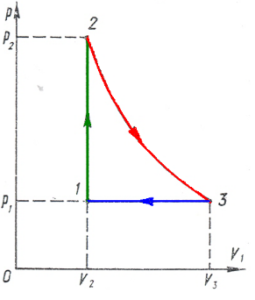
Задача 7. За заданим графіком термодинамічного процесу, визначити температуру газу в точках 2, 3, 4, якщо відомо, що в точці 1 ця температура становить Т0. Маса газу незмінна.
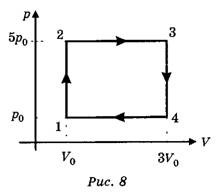
Рішення. Оскільки на ділянці 1→2 об’єм газу залишається незмінним (V=const)то згідно з законом Шарля: р1/Т1=р2/Т2 або Т2=Т1р2/р1 . Враховуючи, що Т1=Т0 , р1=р0, р2=5р0 , можна записати Т2=Т0(5р0/р0)=5Т0 .
Оскільки на ділянці 2→3 тиск газу залишається незмінним (р=const), то згідно з законом Гей-Люсака: V2/T2=V3/T3 звідси T3=T2(V3/V2). Враховуючи що T2=5T0, V2=V0, V3=3V0 , можна записати : T3=5T0(3V0/V0)=15T0.
Оскільки на ділянці 3→4 об’єм газу залишається незмінним (V=const), то згідно з законом Шарля: р3/Т3=р4/Т4, звідси Т4=Т3(р4/р3). Враховуючи що Т3=15Т0, р3=5р0 , р4=р0 , можна записати: Т4=15Т0(р0/5р0)=3Т0 .
Відповідь: Т1=Т0 ; Т2=5Т0 ; Т3=15Т0 ; Т4=3Т0.
Вправа 13.
1. На графіку зображено дві ізохори (мал.а) побудовані для однієї і тієї ж маси газу. Порівняйте об’єми цих газів. Зробіть узагальнюючий висновок.
2. За заданим графіком термодинамічного процесу (мал.б) опишіть цей процес.
3. За заданим графіком термодинамічного процесу (мал.в) опишіть цей процес (ділянка 3-1 є ізотермою).
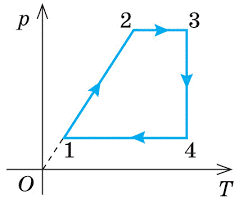
. а) б) в)
4. За представленим на малюнку (г) графіком зміни стану ідеального газу в координатах р-V, побудувати відповідні графіки в координатах р-Т і V-T.
5. Графік термодинамічного процесу в координатах р-V (мал.д) має вигляд кола. На якій ділянці цього графіку температура газу збільшується, а на якій зменшується?
6. За заданим графіком термодинамічного процесу (мал.е), визначити характер зміни тиску газу (маса газу незмінна).
. г) д) е)
.
§14. Пари та їх властивості. Насичені і ненасичені пари. Випаровування та кипіння.
Нагадаємо. Парами називають такі газоподібні речовини, які знаходяться при до критичних температурах (t ˂ tкр). Це означає що: а) середня кінетична енергія молекул пару не набагато більша за їх середню потенціальну енергію (Ек > Еп); б) пар можна перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Процес який відбувається з поглинанням енергії та супроводжується переходом речовини з рідкого стану в газоподібний, називається пароутворенням. Зворотній процес, тобто процес який відбувається з виділенням енергії та супроводжується переходом речовини з газоподібного стану в рідкий називають конденсацією (від лат. condensatio – згущення, ущільнення).
Загально відомо, що в герметично закритій посудині, рівень рідини з плином часу залишається незмінним. А це означає, що між рідиною і тим паром що знаходиться над нею, існує певна динамічна рівновага, тобто такий стан кругообігу їх молекул, при якому інтенсивність випаровування рідини дорівнює інтенсивності конденсації її пару. Пар, що знаходиться в стані динамічної рівноваги зі своєю рідиною називають насиченим паром.
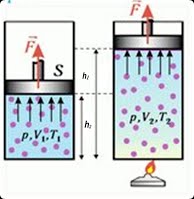
На відміну від газів, густина і тиск насиченого пару не змінюється шляхом його стиснення чи розширення. І це закономірно. Адже при зменшені об’єму системи пар-рідина (мал.35а), певна частина пару перетворюється на рідину. А при збільшені цього об’єму (мал.35б), певна частина рідини перетворюється на пару. По суті це означає, що стосовно насичених парів, газові закони не виконуються. Адже не виконується основна вимога цих законів: маса газу має бути постійною.
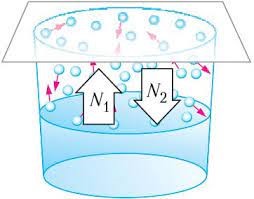

Мал.35. Тиск насиченого пару не можна змінити шляхом зміни його об’єму.
Дослідження показують, що тиск, а отже і густина насиченого пару визначальним чином залежать від двох обставин: індивідуальних властивостей відповідної рідини та температури системи рідина–пар. При цьому, в процесі підвищення температури, тиск насиченого пару збільшується, а при зниженні температури – зменшується. Однак, якщо в процесі ізохоричного (V=const; m=const) нагрівання газу, його тиск зростає лінійно і відносно повільно (при нагріванні від 0ºС до 273ºС тиск газу збільшується вдвічі, мал.36а), то в процесі відповідного нагрівання системи рідина–пар, тиск насиченого пару зростає параболічно швидко. (мал.36б).
а) б)
б)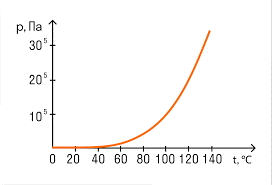
Мал.36. В процесі нагрівання тиск газу збільшується лінійно, а тиск пару – параболічно.
Залежність густини та тиску насиченого пару загалом і водяного пару зокрема від температури, важко представити у вигляді певного математичного співвідношення. Зазвичай цю залежність визначають експериментально і записують у відповідну таблицю, наприклад таку.
Таблиця 1. Залежність густини та тиску насиченого водяного пару від температури.
| t (°С) | pн (кПа) | ρн (г/м3) | t (°С) | pн (кПа) | ρн (г/м3) |
| 0 | 0,61 | 4,8 | 80 | 47,33 | 293 |
| 10 | 1,23 | 9,4 | 90 | 70,12 | 424 |
| 20 | 2,33 | 17,3 | 100 | 101,3 | 588 |
| 30 | 4,24 | 30,3 | 120 | 200 | 1102 |
| 40 | 7,37 | 51,2 | 140 | 361 | 1894 |
| 50 | 12,33 | 83,0 | 160 | 618 | 3092 |
| 60 | 19,92 | 130,0 | 180 | 1002 | 4792 |
| 70 | 31,18 | 198,0 | 200 | 1555 | 7121 |
Чому ж в процесі підвищення температури, тиск насичених парів зростає нелінійно і набагато швидше аніж тиск газів? Щоб відповісти на це запитання, давайте згадаємо що таке тиск і від чого він залежить. З точки зору молекулярно кінетичної теорії, тиск газоподібної речовини, це результат ударів молекул цієї речовини по відповідній поверхні. При цьому, згідно з основним рівнянням м.к.т. газів (p=(1/3)n0m0v2=(2/3)n0Ek), величина цього тиску залежить від концентрації молекул (n0) та їх середньої кінетичної енергії (Ek). І не важко збагнути, що при ізохоричному (V=const) нагріванні газу, збільшення тиску відбувається лише за рахунок збільшення кінетичної енергії його молекул (Ек↑). Адже при такому нагріванні концентрація молекул газу (n0=N/V) залишається незмінною (n0=const). При аналогічному ж нагріванні насиченого пару, тиск збільшується як за рахунок збільшення кінетичної енергії молекул, так і за рахунок збільшення їх концентрації (Ек↑; n0↑). При цьому, в процесі зростання температури, роль другого чинника (n0↑) стає все більш і більш визначальною.
Пари можуть бути не лише насиченими, а й ненасиченими. Наприклад, якщо після повного випаровування рідини, об’єм пару збільшити, то цей пар стане ненасиченим, тобто таким густина якого менша за густину відповідного насиченого пару (ρ ˂ ρн). Іншими словами, ненасиченим паром називають такий пар, густина якого менша за густину відповідного за температурою насиченого пару.
В загальних рисах, спрогнозувати поведінку ненасиченого пару не важко. Дійсно. Якщо пар ненасичений, то будь яка зміна його об’єму не призводить до перетворення пару на рідину. Тому, коли об’єм ненасиченого пару збільшується, то його тиск (а відповідно і густина) зменшується. А коли цей об’єм зменшується, то тиск (густина) відповідно збільшується. Звичайно до тих пір поки пар не стане насиченим.
Враховуючи факт того, що в процесі зміни як об’єму так і температури, маса ненасиченого пару залишається незмінною, можна передбачити, що термодинамічна поведінка ненасиченого пару має описуватись газовими законами. Однак, дослідження показують, що дане передбачення не є безумовно правильним, і що газові закони лише приблизно відображають реальні властивості ненасичених парів. Даний факт пояснюється тим, що для парів, кінетична енергія молекул не настільки сильно перевищує енергію їх взаємодії, щоб останню можна було не враховувати. По суті це означає, що молекули пару не надто схожі на пружні кульки. Вони скоріш нагадують кульки виготовлені з липкої гуми. При взаємодії такі кульки можуть як відскакувати одна від одної (якщо їх швидкості достатньо великі), так і прилипати одна до одної (якщо їх швидкості відносно малі).
Втім, при наближених розрахунках прийнято вважати, що ненасичені пари підпорядковуються газовим законам. Виходячи з цього будемо вважати, що для ненасичених парів виконуються співвідношення pV/T = const; pV/T = (m/M)R; р = (1/3)n0m0v2, тощо.
Розрізняють дві різновидності пароутворення: випаровування та кипіння. Випаровування, це таке пароутворення, яке відбувається при будь якій температурі рідини і при якому перехід речовини з рідкого стану в газоподібний здійснюється лише з вільної поверхні рідини. Інтенсивність випаровування залежить від сорту рідини та її температури: з підвищенням температури, інтенсивність випаровування збільшується і навпаки.
Дослідження показують, що в процесі випаровування температура рідини знижується, а в процесі конденсації – підвищується. І це закономірно. Адже температура характеризує середню кінетичну енергію теплового руху молекул. А це означає, що при одній і тій же температурі, в будь якій речовині зустрічаються молекули, кінетична енергія яких як значно більша так і значно менша за середню величину. Ясно, що в процесі випаровування, рідину покидають найбільш енергійні (найбільш «гарячі») молекули. При цьому загальний енергетичний рівень тих молекул які залишаються в рідині стає відповідно меншим. А отже меншою стає і температура рідини. З іншого боку, в процесі конденсації, ті молекули пару які «падають» в рідину, в процесі падіння отримують певну кількість додаткової енергії, а отже стають відповідно більш «гарячими». Це аналогічно тому, як підняте над землею нерухоме («холодне») тіло, в процесі падіння збільшує свою кінетичну енергію і падає на землю відповідно більш «гарячим».
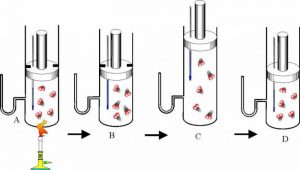
Факт того, що в процесі випаровування, температура речовини знижується, а в процесі конденсації – підвищується, корисно застосовується в багатьох технічних приладах, зокрема в холодильниках (мал.38).
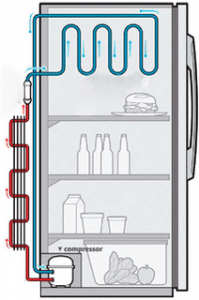
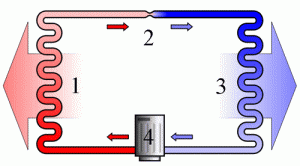
Мал.38. Загальний устрій та принципова схема холодильника.
Холодильна установка представляє собою замкнуту герметичну систему, заповнену речовиною яка легко переходить з газоподібного стану в рідкий і навпаки. Зазвичай, цією речовиною є фреон (фреони – технічна назва групи фторовмісних речовин, які мають відносно низьку температуру кипіння, наприклад для фреону СF2Cℓ2 ця температура становить –29ºС). Основними технічними елементами холодильника є компресор (4), капілярна трубка (2), конденсатор-теплообмінник (1), випаровувач-морозильна камера (3).
Принцип дії холодильника полягає в наступному. Компресор у поєднанні з капілярною трубкою, створює в системі теплообмінника зону підвищеного тиску (≈1,6атм), а в системі морозильної камери – зону зниженого тиску (≈0,6атм). В такій ситуації, та рідина, яка через вузьку капілярну трубку потрапляє в систему морозильної камери (випаровувач) швидко випаровується і охолоджується до температури –20ºС. Проходячи трубками морозильної камери, холодний пар охолоджує навколишній простір і за рахунок отриманої від нього енергії, нагрівається до температури –5ºС (вказані числові значення тисків та температур є усередненими). Потрапляючи через компресор в зону підвищеного тиску (в систему теплообмінника), цей пар швидко конденсується. При цьому виділяється велика кількість енергії, за рахунок якої сконденсована рідина нагрівається до температури +50ºС. Проходячи трубками теплообмінника, гаряча рідина частину своєї енергії віддає навколишньому середовищу і охолоджується до температури +20ºС. Ця охолоджена рідина, через капілярну трубку знову потрапляє в систему морозильної камери. Знову випаровується, охолоджується і т.д.
Таким чином, в процесі замкнутого кругообігу, робоче тіло холодильника, в одному місці охолоджується, а в іншому – нагрівається. При цьому холодильник, з одного боку є джерелом холоду, а з іншого – джерелом тепла. Не важко збагнути, що розмістивши морозильну камеру холодильника в одній кімнаті, а його теплообмінник в іншій, можна змусити один і той же прилад виконувати дві корисні роботи. І ці дві послуги коштуватимуть нам як одна. Втім, потенціальні можливості холодильника не завжди співпадають з нашими практичними потребами. До числа тих приладів принцип дії яких є аналогічним принципу дії холодильника, відносяться різноманітні кондиціонери та так звані теплові насоси.
Випаровування, це відносно спокійний вид пароутворення при якому утворення пару відбувається лише з вільної поверхні рідини, тобто з тієї поверхні яка контактує з навколишнім газоподібним середовищем. Однак утворення пару може відбуватись і в усьому об’ємі рідини. Це інтенсивне пароутворення називають кипінням.
Кипіння – це таке інтенсивне пароутворення, яке відбувається при певній постійній температурі (температурі кипіння) і при якому утворення пару відбувається в усьому об’ємі рідини. Візуальною ознакою кипіння є утворення наповнених паром бульбашок. І потрібно зауважити, що той процес який ви спостерігаєте при відкриванні газованих напоїв і який також супроводжується виділенням бульбашок, не є кипінням. Адже цей процес пов’язаний не з пароутворенням рідини, а з фактом того, що відповідну рідину під певним надлишковим тиском, примусово перенаситили вуглекислим газом, який при зменшенні зовнішнього тиску, виділяється у вигляді бульбашок.
Не заглиблюючись в деталі процесу кипіння, зауважимо. Активна фаза кипіння починається тоді, коли температура рідини в місці її контакту з поверхнею нагріву стає такою, при якій тиск насиченого пару (рн) мінімально перевищує зовнішній тиск (р0). При цій температурі, об’єм тих мікро бульбашок які неминуче присутні на поверхні нагріву, починає швидко збільшуватись. Збільшуватись за рахунок того пару що інтенсивно заповнює їх внутрішній простір. У підсумку, заповнена насиченим паром об’ємна бульбашка відривається від поверхні нагріву, а на її місці залишається нова мікро бульбашка.

Мал.39. Кипіння супроводжується утворенням заповнених паром рідини бульбашок.
Коли ми стверджуємо, що кипіння відбувається при певній постійній температурі, то маємо на увазі факт того, що величина цієї температури не залежить ні від тривалості процесу кипіння ні від його інтенсивності. Скажімо, якщо ви збільшите інтенсивність того вогню що підтримує процес кипіння води, то це не призведе до підвищення температури кипіння. Просто інтенсивність процесу кипіння стане більшою.
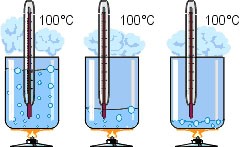
Мал.40 Температура кипіння практично не залежить ні від тривалості процесу кипіння, ні від інтенсивності цього процесу.
З іншого боку, твердження про те, що кипіння відбувається при певній постійній температурі, зовсім не означає що ця температура є абсолютно незмінною. Адже кипіння відбувається при тій температурі, при якій тиск насиченого пару рідини дорівнює зовнішньому тиску на її поверхню. А це означає, що зменшуючи зовнішній тиск, ми створюємо умови за яких кипіння відбувається при меншій температурі. І навпаки, збільшуючи зовнішній тиск, ми створюємо умови, за яких кипіння відбувається при більш високій температурі. Тому, коли ми стверджуємо, що вода кипить при температурі 100ºС, то маємо на увазі, що це кипіння відбувається за нормального атмосферного тиску. Якщо ж тиск над поверхнею води змінювати, то відповідно змінюватиметься і температура її кипіння. Наприклад, під тиском 2атм вода кипить при температурі 120ºС, під тиском 20атм – при температурі 211ºС, під тиском 0,5атм – при температурі 80ºС, а під тиском 0,01атм – при температурі 6,7ºС.
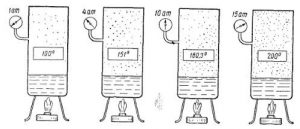
Мал.41. Температура кипіння певним чином залежить від величини зовнішнього тиску.
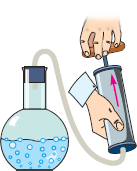
Факт залежності температури кипіння речовини від величини зовнішнього тиску, корисно застосовується в приладах які називаються автоклавами. Автоклав – це прилад, в якому ті чи інші технологічні процеси відбуваються при тисках більших атмосферного та відповідно більш високих температурах кипіння рідини. Автоклав представляє собою герметично закриту посудину, яка обладнана запобіжним клапаном і в якій міститься певна кількість рідини (мал.42). Принцип дії цієї системи полягає в наступному. В процесі нагрівання рідини, тиск того пару що знаходиться над нею автоматично збільшується. При цьому рідина не закипає при все біль і більш високих температурах. Коли ж температура, а відповідно і тиск, системи рідина-пар досягає певної критичної величини, спрацьовує запобіжний клапан, який випускає частину пару, запобігаючи тим самим перегріву та руйнації системи. Автоклави застосовуються в медицині, харчовій, хімічній та інших галузях промисловості. Побутовою версією автоклаву є так звані скороварки.
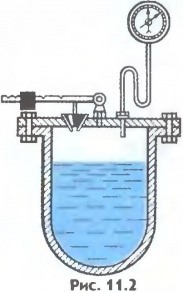
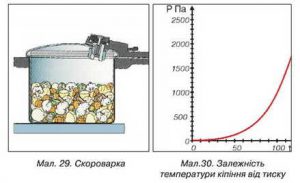
Мал.42. Схема загального устрою автоклава.
Температура кипіння рідини залежить не лише від зовнішнього тиску, а й від фізичних властивостей самої рідини. Скажімо, за нормального атмосферного тиску етиловий ефір кипить при температурі 35ºС, етиловий спирт – при температурі 78ºС, а рідкий кисень – при температурі –183ºС.
Факт того, що різні речовини мають різні температури кипіння, широко застосовується в багатьох технологічних процесах. Зокрема тих, які дозволяють із суміші речовин, виділити потрібну складову. Наприклад нафта, це складна суміш великої кількості хімічно різних компонентів (фракцій). При цьому, різні фракції цієї суміші мають суттєво різні температури кипіння. А це означає, що в процесі нагрівання нафти, спочатку випаровуватимуться фракції з найменшою температурою кипіння. Потім, фракції з більш високою температурою кипіння і т.д. При цьому, фізично однорідна нафта, розділяється на бензин, лігроїн, гас, газойль та мазут.
Задача 1. Тиск водяного пару при 15°С дорівнює 1200 Па, а його об’єм 5,7л. Яким буде тиск пару, якщо температуру підвищили до 27°С, а об’єм збільшили до 8,0л ?
Дано:
t1 = 15°С, Т = 288К
p1 = 1200 Па
V1 = 5,7л
t2 = 27°С, Т = 300К
V2 = 8,0л
р2 = ?
Рішення. Оскільки даний пар є явно ненасиченим (адже навіть при 10°С рн = 1230 Па), то будемо виходити з того, що для такого пару виконується співвідношення p1V1/T1 = p2V2/T2, p2 = p1V1T2/T1V2 = 1200Па∙5,7л∙300К/8,0л∙288К = 890 Па.
Відповідь: р2 = 890 Па.
Задача 2. В циліндрі під поршнем при температурі 30°С ізотермічно стискають 0,9г ненасиченого водяного пару. Яким буде об’єм пару в момент початку конденсації?
Дано:
m = 0,9г = 0,9∙10–3кг
t = 30°C, T = 303К
V = ?
Рішення. Оскільки пар ненасичений, то для нього виконується закон Менделєєва-Клапейрона pV/T = (m/M)R, звідси V = mТR/Мр, де R=8,31(Дж/К∙моль), М(Н2О) = 18∙10–3(кг/моль). Оскільки в момент початку конденсації р = рн(30°С) = 4240 Па, то можна записати V = mТR/Мр = 0,9∙10–3кг∙303К∙8,31(Дж/К∙моль)/18∙10–3(кг/моль)∙ 4240 Па = 30∙10–3(Дж/Па = Н∙м/Н/м2 = м3) = 30л.
Відповідь: V = 30л.
Задача 3. Визначити густину ненасиченого водяного пару при температурі 15°С, якщо величина його тиску 1200 Па.
Дано:
t = 15°C, T = 288K
р = 1200 Па
ρ = ?
Рішення. Будемо виходити з того, що для ненасиченого пару виконуються газові закони, в тому числі і закон Менделєєва-Клапейрона pV/T=(m/M)R, звідси m/V = pM/TR. Таким чином, густину ненасиченого пару можна визначити за формулою ρ= pM/TR, де R=8,31Дж/К∙моль, М(Н2О)= 18г/моль = 18·10–3 кг/моль.
Розрахунки: [ρ] = (Па·кг/моль)/(Дж/К·моль)К = Па·кг/Дж = Н·кг/м2·Н·м= кг/м3;
ρ= pM/TR = (120·103·18·10–3)/(288·8,31) = 0,90кг/м3.
Відповідь: ρ = 0,90кг/м3 = 900 г/м3.
Задача 4. На малюнку представлені графіки залежності тиску від температури та тиску від об’єму одного і того ж пару. Поясніть ці графіки. Чи не суперечать вони один одному?
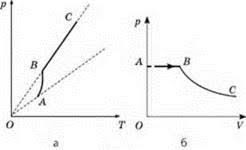
Рішення. Аналізуючи графік (а), можна сказати наступне. Ділянка АВ є графіком залежності тиску насиченого пару від його температури: при збільшенні температури, тиск параболічно збільшується. При температурі яка відповідає точці В, рідина повністю випаровується і в процесі подальшого нагрівання (ділянка ВС), пар буде ненасиченим і тому залежність тиску від температури буде майже лінійною.
Аналізуючи графік (б), можна сказати наступне. Ділянка АВ є графіком залежності тиску насиченого пару від його об’єму: при збільшенні об’єму, тиск пару залишається незмінним. При об’ємі який відповідає точці В, рідина повністю випаровується і в процесі подальшого розширення (ділянка ВС), пар буде ненасиченим і тому залежність тиску від об’єму буде майже лінійною.
Висновок: жодних суперечностей між графіками (а) і (б) нема.
Контрольні запитання.
- Який пар називають насиченим?
- Чому в процесі зменшення об’єму, густина насиченого пару не збільшується? Від чого залежить ця густина?
- Чому в процесі збільшення температури тиск газу збільшується лінійно, а тиск насиченого пару – параболічно?
- Чому в процесі випаровування температура рідини знижується, а в процесі конденсації – зростає?
- Поясніть загальний устрій та принцип дії холодильника (мал.38).
- Що мають на увазі коли стверджують, що кипіння відбувається при певній постійній температурі? Від чого залежить ця температура?
- При відкриванні посудини з газованою водою відбувається інтенсивне виділення бульбашок. Чи означає цей факт що вода кипить? Поясніть дане явище.
- Поясніть загальний устрій та принцип дії автоклава (мал.42)
- Чому по відношенню до насиченого пару газові закони не виконуються взагалі, а по відношенню до ненасиченого пару – лише частково?
Вправа 14.
- За наданими в таблиці 1 даними, побудуйте графік залежності тиску насиченого пару від температури, для інтервалу температур від 0°С до 100°С.
- За наданими в таблиці 1 даними, побудуйте графік залежності густини насиченого пару від температури, для інтервалу температур від 0°С до 100°С.
- Тиск водяного пару при 27°С дорівнює 2300 Па, а його об’єм 4,5л. Яким буде тиск пару, якщо температуру знизили до 17°С, а об’єм збільшили до 7,0л ?
- Насичений водяний пар з температурою 20°С відділили від рідини і при постійному об’ємі нагріли до 30°С. Визначте тиск цього пару.
- Визначити густину ненасиченого водяного пару при температурі 35°С, якщо величина його тиску 2500 Па.
- Визначити тиск ненасиченого водяного пару при температурі 50°С, якщо його густина при цій температурі 50 г/м3.
- 276мг ненасиченого водяного пару, ізотермічно стискають. Коли об’єм пару зменшився до 12л, почалася його конденсація. При якій температурі відбувалося стиснення?
- В котел об’ємом 1м3 налили 3кг води і нагріли її до 180°С. Визначити масу, густину та тиск водяного пару.
.
§15. Критичний стан речовини. Діаграма стану речовини.
Нагадаємо. Парами називають такі газоподібні речовини, які знаходяться при докритичній температурі (t ˂ tкр). Газами називають такі газоподібні речовини, які знаходяться при закритичній температурі (t ˃ tкр). Що ж це за магічна температура яку називають критичною? Відповідаючи на це запитання можна сказати наступне.
По суті різниця між рідиною та її насиченим паром полягає в суттєвій різниці їх густини. Скажімо при температурі 4ºС густина води 1,0∙103кг/м3, а густина її насиченого пару 6,4∙10–3кг/м3. Візуальним відображенням цієї різниці густин є та межа, яка називається поверхнею рідини і яка відділяє рідину від її пару (мал.43а). З іншого боку відомо, що в процесі нагрівання рідини розширюються і тому їх густина зменшується. Відомо і те, що густина насиченого пару залежить від температури, і що з підвищенням температури ця густина збільшується. А якщо в процесі нагрівання, густина рідини зменшується, а густина її насиченого пару збільшується, то логічно передбачити, що за певних умов ці густини зрівнюються, і що при цьому різниця між рідиною та її насиченим паром зникне (мал43б). Власне ту температуру при якій різниця між рідиною та її насиченим паром зникає і називають критичною.
а)  б)
б) 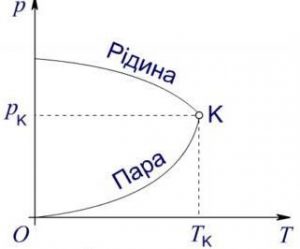
Мал.43. Різниця між рідиною та її паром в суттєвій різниці їх густини. При критичній температурі різниця між рідиною та її насиченим паром повністю зникає.
Перевіряючи зроблені нами теоретичні передбачення звернемось до експерименту. З цією метою, спеціальну скляну ампулу з певною кількістю етилового ефіру помістимо в невеличку металеву скриньку з скляним віконцем (мал.44а). Нагріваючи скриньку, а отже і ту ампулу що в ній знаходиться, ви побачите наступне (мал.44б). В процесі нагрівання, та рідина що знаходиться в ампулі буде поступово розширюватись. При цьому її густина буде відповідно зменшуватись, а густина насиченого пару, збільшуватись. У підсумку, при температурі 194ºС, та видима межа, що розділяє рідину і її насичений пар повністю зникає і в ампулі залишається однорідна прозора речовина. Припинивши подальше нагрівання і дочекавшись того моменту коли газоподібна речовина охолоне до температури 194ºС, ви побачите, що при цій температурі, в ампулі швидко утвориться густий туман конденсованого ефіру, і що після розсіювання цього туману, з’являються дві чітко окреслені фази речовини: рідина та її пар.
а)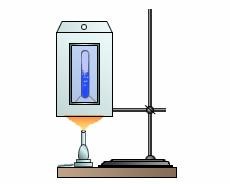 б)
б)
Мал.44. Прилад для ілюстрації критичного стану речовини.
Таким чином, експериментальні дослідження показують, що при певній температурі та їй відповідному тиску, густина рідини (ρр) і густина її насиченого пару (ρн) стають чисельно рівними. При цьому, будь які відмінності між рідиною та її насиченим паром повністю зникають. Той стан нестійкої рівноваги між рідиною та її насиченим паром, при якій густина рідини та густина пару стають чисельно рівними і при якому будь які відмінності між рідиною та її паром зникають, називають критичним станом речовини. Критичному стану речовини, відповідає певна критична температура (Ткр або tкр), певний критичний тиск (ркр) та певна критична густина (ρкр). Числові значення критичних параметрів деяких речовин представлені в наступній таблиці.
Критичні параметри та температури кипіння деяких речовин.
| Речовина | Критичні параметри | Температура
кипіння (ºС) |
||
| tкр (ºС) | ркр (атм) | ρкр (кг/м3) | ||
| вода | 374,2 | 218,5 | 320 | 100,0 |
| спирт етиловий | 243,1 | 63,0 | 270 | 78,4 |
| ефір етиловий | 193,8 | 35,5 | 260 | 34,6 |
| аміак | 132,4 | 111,5 | 240 | –33,3 |
| вуглекислий газ | 31,0 | 72,9 | 470 | –78,5 |
| кисень | –118,4 | 50,0 | 410 | –183,0 |
| азот | –147,0 | 33,5 | 310 | –195,8 |
| водень | –240,0 | 12,8 | 31 | –252,8 |
| гелій | –267,9 | 2,25 | 70 | –268,9 |
Дослідження показують, що для води критична температура становить 374,2ºС. На перший погляд, така температура не є занадто високою. Адже нагріти шматок заліза до температури 300ºС, 500ºС ба навіть 1000ºС не є складною задачею. Інша справа, нагрівання води. Адже при температурі 100ºС вода закипить і скільки б ви її не гріли і на якому б потужному полум’ї не нагрівали, вона гарячішою не стане. Для того щоб нагріти воду до більш високої температури, її потрібно нагрівати в герметично закритій посудині. При цьому в процесі нагрівання, тиск в цій посудині неухильно зростатиме і при температурі 374,2ºС досягне позначки 218,5 атмосфер. А це еквівалентно тому тиску який створює стовп з 218,5 бетонних блоки масою по 10,3тони кожний, спираючись на поверхню площею 1м2. Ясно, що в побутовій практиці тих каструль які б витримували такий шалено великий тиск не існує. Тому в умовах повсякденного життя, ви ніколи не зустрінете воду нагріту до критичної, а тим більше закритичної температури.
Критична температура є надзвичайно важливим параметром будь-якої хімічно простої речовини. Адже саме ця температура є тією чітко визначеною межею, яка розділяє газоподібний стан речовини на дві суттєво різні різновидності цього стану: при t ˂ tкр – пар, при t ˃ tкр – газ. По суті, при докритичних температурах (t ˂ tкр) речовина може бути в трьох агрегатних станах: твердому, рідкому та газоподібному. При закритичних температурах (t ˃ tкр), речовина може знаходитись лише в одному агрегатному стані – газоподібному, а точніше, в стані газу. Вона стає газом навіть в тому випадку, якщо при докритичній температурі була рідиною. Наприклад вода, при закритичній температурі (t ˃ 374,2ºС) перестає бути рідиною і автоматично стає газом відповідної густини. Інша справа, що нагріти воду до закритичних температур надзвичайно складно.
Оскільки ті газоподібні речовини які знаходяться при закритичній температурі (t ˃ tкр) називаються газами, а ті які знаходяться при докритичній температурі (t ˂ tкр) – парами, то ясно, чому за наявних земних умов (–50ºC ˂ t ˂ 50ºC), газоподібний кисень(tкр= –118,4°С), газоподібний азот(tкр= –147,0°С) та газоподібний водень (tкр= –240,0°С) називають газами, а газоподібну воду (tкр=374,2°С), газоподібний спирт (tкр=243,1°С) та газоподібний аміак (tкр= 132,4°С), називають парами. До речі, якщо виходити «з букви закону», то потрібно визнати, що в області помірних температур (до 31ºС), назва «вуглекислий газ» не є правильною. Адже вуглекислий газ фактично стає газом лише при температурах вищих за 31ºС. При нижчих температурах, цей газ фактично є паром вуглекислоти (СО2).
Тепер, коли ви знаєте про суть тих відмінностей що існують між паром та газом, не важко збагнути, що для перетворення газу на відповідну рідину, цей газ спочатку потрібно охолодити до певної докритичної температури (тобто перетворити на пар), а лише потім сконденсувати у відповідну рідину. Наприклад для того, щоб отримати рідкий кисень, його потрібно охолодити до температури нижчу за –118,4ºС. Однак, якщо ви захочите отримати таку рідину яку можна зберігати при нормальному атмосферному тиску, то її потрібно охолодити до температури нижчої за температуру кипіння відповідної рідини. Наприклад для кисню ця температура становить –183ºС. Власне при таких наднизьких температурах і зберігають рідкий кисень.
Напевно ви погодитесь з тим, що фізичний стан хімічно простої речовини, визначальним чином залежить від її температури та зовнішнього тиску. Цю залежність можна представити у вигляді відповідного графіку, який прийнято називати діаграмою стану речовини або фазовою діаграмою. Діаграма стану речовини будується на основі експериментальних досліджень і є індивідуальною для кожної конкретної речовини. Та не дивлячись на все різноманіття індивідуальних особливостей, загальні обриси подібних діаграм є схожими. Ці статистично усереднені обриси представлені на мал.45.
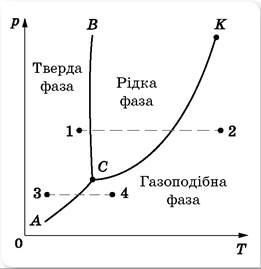
Мал.45. Статистично усереднена фазова діаграма хімічно простої речовини.
Аналізуючи діаграму стану речовини, можна відповісти на ряд важливих запитань, зокрема: в якому фазовому стані буде знаходитись речовина за тих чи інших умов; як буде змінюватись стан речовини при тій чи іншій зміні умов; що необхідно зробити для того, щоб речовина набула певних властивостей; тощо. Наприклад, за тих умов які відповідають точці 1 (мал.45), дана речовина знаходиться в твердому стані. А за тих умов, які відповідають точці 2 – в газоподібному. Якщо ж зовнішнім умовам відповідає та точка що належить лінії фазового переходу (лінії АС, СВ, СК) то речовина знаходиться в так званій фазовій рівновазі. Це означає що за відповідних умов речовина може бути в двох фазових станах. Наприклад за умов які відповідають точці перетину відрізку 1–2 та лінії СВ, речовина може бути як твердою так і рідкою. При цьому, в залежності від того отримує речовина енергію чи втрачає, вона або плавиться або кристалізується.
Аналізуючи діаграму стану речовини, не важко бачити, що за певних тисків та температур, тверді речовини можуть безпосередньо перетворюватись на газоподібні і навпаки. Процес безпосереднього переходу речовини з твердого стану в газоподібний називають сублімацією. Зворотній процес, тобто процес безпосереднього переходу речовини з газоподібного стану в твердий називають десублімацією. Потрібно зауважити, що подібно до процесу пароутворення, який за різних температурно-тискових умов може бути як повільним (випаровування) так і швидким (кипіння), процес сублімації також має дві фази – повільну та інтенсивну. При цьому, за тих умов які відповідають точці перетину відрізка 3–4 з лінією АС, відбувається інтенсивна фаза сублімації, яка є певним аналогом процесу кипіння.
Звичайно, скоріш за все, вам не доводилось спостерігати за активною сублімацією речовини. Адже переважна більшість речовин, активно сублімує при надзвичайно низьких тисках та практично недоступних температурах. Наприклад, інтенсивна сублімація льоду відбувається при тиску, який не перевищує 0,006 атмосфер. А це означає, що активну фазу сублімації льоду, можна спостерігати лише в спеціально створених умовах. Якщо ж говорити про повільну сублімацію льоду, то її можна спостерігати і в повсякденному житті. Скажімо на морозі, випрана білизна швидко замерзає, та перетворюється на відповідний твердий матеріал. Однак, через певний час, наявний в тканині лід випаровується (сублімує) і білизна стає практично сухою.
Прикладом речовини яка активно сублімує при нормальному атмосферному тиску та доступних температурах, є так званий «сухий лід», тобто кристалічна фаза вуглекислого газу (СО2). Характерною особливістю цього «льоду» є те, що при нормальному атмосферному тиску і температурі –78,5ºС, він не плавиться а сублімує, тобто безпосередньо перетворюється на відповідну газоподібну речовину – вуглекислий газ.
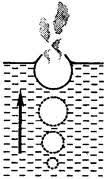
На діаграмі стану речовини можна виділити дві характерні точки: точка С, яку називають потрійною точкою і точка К, яку називають критичною. Про параметри критичної точки та їй відповідного критичного стану ви вже знаєте. Тому стисло охарактеризуємо точку потрійну. Не важко бачити, що за тих умов які відповідають параметрам потрійної точки (для води рс=0,006атм; tc=0,01°C), речовина може бути твердою, рідкою та газоподібною одночасно. В природних земних умовах, жодна речовина в подібному стані не зустрічається. Тому нам важко повірити, що такий стан речовини взагалі можливий.
І тим не менше, речовина дійсно може бути твердою, рідкою і газоподібною одночасно. В цьому не важко переконатись, якщо у вашій фізичній лабораторії знайдеться зображена на мал.46 вакуумна установка та достатньо потужний вакуумний насос. Поставивши під ковпак цієї установки склянку холодної води, та інтенсивно знижуючи тиск під ковпаком, ви досягнете того що вода закипить. При цьому, в процесі кипіння і подальшого зниження тиску, вода буде охолоджуватись і в кінцевому підсумку, при температурі 0ºС і тиску 0,006атм, вона в киплячому стані почне перетворюватись на лід. Саме цей стан і відповідає параметрам потрійної точки води.

Мал.46. При певній температурі і тиску речовина може бути твердою, рідкою та газоподібною одночасно.
Оскільки потрійна точка характеризується однозначно та точно визначеними параметрами температури і тиску, то її часто використовують як базову (еталонну) точку відліку температур. Наприклад температура потрійної точки води, наряду з температурою абсолютного нуля, є тими базовими точками за якими визначають основну одиницю вимірювання температури – кельвін. Кельвін (К) – це одиниця вимірювання температури, яка дорівнює 1/273,16 частині інтервалу температур між температурою абсолютного нуля (–273,15°С) та температурою потрійної точки води (0,01°С).
Контрольні запитання.
1. Якщо вода та її пари складаються з одних і тих же молекул, то чим відрізняється вода-рідина від води-пару?
2. Які параметри характеризують критичний стан речовини?
3. Який факт вказує на те, що в процесі нагрівання густина рідини зменшується?
4. Чи можна вуглекислий газ при кімнатній температурі (20ºС) перетворити на відповідну рідину?
5. Що потрібно зробити для того, щоб отримати такий рідкий кисень, який можна зберігати при атмосферному тиску?
6. На основі зображеної на мал.45 діаграми стану речовини, охарактеризувати ті процеси які відбуваються при переході речовини: а) з точки 1 в точку 2; б) з точки 2 в точку 1; в) з точки 3 в точку 4.
7. Що називають сублімацією та десублімацією речовини?
8. Охарактеризуйте стан речовини в потрійній точці.
9. Поясніть, чому в зображеній на мал.46 експерименті, в процесі кипіння та зниження тиску, вода охолоджується і у підсумку замерзає?
.
§16. Вологість повітря та способи її вимірювання.
В атмосферному повітрі неминуче міститься певна кількість водяного пару. І це закономірно. Адже більша частина поверхні земної кулі вкрита водою, яка як відомо випаровується. І випаровується її надзвичайно багато. Дослідження показують, що на Землі щорічно в пар перетворюється близько 450 000км3 води (450·1012 тон). А це більше ніж її міститься в 1750 Азовських морів. При цьому абсолютно очевидно, що атмосферна волога знаходиться в постійному кругообігу. Адже паралельно з процесом випаровування неминуче відбувається і зворотній процес – процес конденсації. А це означає що ті 450 трильйонів тон води які щорічно випаровуються з поверхні Землі, неминуче повертаються на цю поверхню у вигляді дощу, снігу, роси, туману, тощо.
Кількість того водяного пару (вологи) що міститься в атмосферному повітрі, прийнято характеризувати двома величинами: абсолютна та відносна вологість повітря.
Абсолютна вологість повітря – це фізична величина, яка характеризує фактичну густину того водяного пару що міститься в повітрі і яка дорівнює цій густині.
Позначається: ρа
Визначальне рівняння: ρа = m(H2O)/V
Одиниця вимірювання: [ρа]=кг/м3, або [ρа]=г/м3.
З точки зору наших відчуттів, абсолютна вологість не є надто зручною величиною. Ця незручність полягає в тому, що при одній і тій же абсолютній вологості повітря, наші відчуття можуть бути суттєво різними. Наприклад, якщо абсолютна вологість повітря становить 6г/м3, то при температурі 5ºС це повітря ми будемо сприймати як надмірно вологе, а при температурі 25ºС – як надмірно сухе. Пояснюючи такий стан речей можна сказати наступне.
Наше сприйняття вологості є реакцією організму на результуючу двох споріднених процесів: процесу випаровування та процесу конденсації. При цьому, якщо кількість тієї вологи яку втрачає організм в процесі випаровування, значно перевищує ту кількість вологи яку він отримує в процесі конденсації, то відповідне повітря викликає у нас відчуття сухості. Якщо ж кількість випаруваної та конденсованої вологи приблизно однакова, то таке повітря ми сприймаємо як надмірно вологе.
По суті це означає, що наші відчуття визначальним чином залежать не від абсолютної вологості повітря, а від того наскільки ця вологість відрізняється від максимально можливої для даної температури вологості. Іншими словами, з точки зору наших відчуттів, більш вдалою характеристикою вологості повітря є не його абсолютна вологість, а величина яка дорівнює відношенню абсолютної вологості повітря до густини відповідного даній температурі насиченого пару. Цю величину прийнято називати відносною вологістю повітря.
Відносна вологість повітря – це фізична величина яка характеризує відносну вологість повітря і яка дорівнює відношенню фактичної густини того пару що знаходиться в повітрі (абсолютної вологості повітря), до його максимально можливої при даній температурі густини (густини насиченого пару).
Позначається: В
Визначальне рівняння: В = (ρа/ρн)100%
Одиниця вимірювання: [В] = % .
Дослідження показують, що для організму людини, максимально комфортною є ситуація при якій відносна вологість повітря знаходиться в межах від 40 до 60 відсотків. При цьому повітря, відносна вологість якого менша 40% вважається в тій чи іншій мірі сухим. А повітря, відносна вологість якого більша 60%, вважається в тій чи іншій мірі надмірно вологим.
Зважуючи на ці обставини та враховуючи факт того, що в процесі зростання температури, густина насиченого пару збільшується (дивись табл.) не важко пояснити чому, одне і те ж повітря (ρа=const) при різних температурах сприймається по різному. Дійсно. Якщо абсолютна вологість повітря 6,0г/м3, то при температурі 5ºС (для цієї температури ρн=6,8г/м3) його відносна вологість 88%, а при температурі 25ºС (для цієї температури ρн=23,0г/м3) – всього 26%.
Таблиця. Густина насиченого водяного пару при різних температурах.
| t (ºC) | ρн (г/м3) | t (ºC) | ρн (г/м3) | t (ºC) | ρн (г/м3) |
| 0 | 4,8 | 12 | 10,7 | 24 | 21,8 |
| 1 | 5,2 | 13 | 11,4 | 25 | 23,0 |
| 2 | 5,6 | 14 | 12,1 | 26 | 24,4 |
| 3 | 6,0 | 15 | 12,8 | 27 | 25,8 |
| 4 | 6,4 | 16 | 13,6 | 28 | 27,2 |
| 5 | 6,8 | 17 | 14,5 | 29 | 28,7 |
| 6 | 7,3 | 18 | 15,4 | 30 | 30,3 |
| 7 | 7,8 | 19 | 16,3 | 40 | 51,2 |
| 8 | 8,3 | 20 | 17,3 | 50 | 83,0 |
| 9 | 8,8 | 21 | 18,3 | 60 | 130,0 |
| 10 | 9,4 | 22 | 19,4 | 80 | 293 |
| 11 | 10,0 | 23 | 20,6 | 100 | 598 |
Потрібно зауважити, що відносна вологість вдало характеризує зволоженість атмосферного повітря, не лише з точки зору наших суб’єктивних відчуттів, а й з точки зору переважної більшості тих природних процесів, які так чи інакше пов’язані з випаровуванням та конденсацією води. Наприклад інтенсивність процесу висушування білизни, деревини, фруктів та інших об’єктів, визначальним чином залежить не від абсолютної вологості повітря, а від його відносної вологості. Або, наприклад, поява конденсованої атмосферної вологи (туману, роси, інею, тощо) відбувається не тоді, коли абсолютна вологість повітря є надто високою, а тоді коли його відносна вологість дещо перевищує 100%.
Дійсно. Припустимо, що в сонячний літній день, при температурі 25ºС абсолютна вологість повітря становить 16,3г/м3, що відповідає відносній вологості 71%. Припустимо також, що вночі температура повітря знизилась до 15ºС, тобто до температури при якій в одному кубічному метрі повітря може знаходитись не більше 12,8 грамів води. Ясно, що за таких умов, в кожному кубічному метрі повітря буде знаходитись 16,3–12,8=3,5г надлишкової вологи. Вологи, яка неминуче конденсується в росу, туман чи інші види опадів.
Температуру, при якій повітря в процесі охолодження стає насиченим водяними парами, прийнято називати точкою роси. Іншими словами, точка роси (позн. tр) це така температура, при якій абсолютна вологість повітря (ρа) в процесі охолодження стає рівною густині відповідного цій температурі насиченого пару (ρа = ρн(tр)). Скажімо, в умовах вище наведеного прикладу (t=25ºС; ρа=16,3г/м3), точкою роси є температура 19ºС (ρн(19ºС)=16,3г/м3).
Абсолютну та відносну вологість повітря вимірюють різними приладами, більшість з яких прийнято називати гігрометрами (від грец. hygros – волога, та metreo – вимірюю). До числа таких приладів відносяться: ваговий гігрометр, конденсаційний гігрометр, волосяний гігрометр та психрометр.
Ваговий гігрометр – це прилад, який дозволяє визначати абсолютну вологість повітря шляхом прямого вимірювання маси того пару що знаходиться в певному об’ємі повітря. Ваговий гігрометр (мал.47) представляє собою систему U-подібних трубок заповнених гігроскопічною речовиною. Принцип дії такої системи дуже простий. Через ваговий гігрометр, за допомогою насосу проганяється певна відома кількість атмосферного повітря. При цьому наявна в повітрі волога поглинається гігроскопічною речовиною і стає відповідно важчою. Визначивши масу гігрометра до і після експерименту, а також знаючи об’єм того повітря що пройшло через гігрометр, не важко визначити відповідну абсолютну вологість повітря: ρа =∆m/V.
Мал.47. Загальний вигляд вагового гігрометра.
Конденсаційний гігрометр – це прилад, який дозволяє визначати абсолютну та відносну вологість повітря шляхом експериментального вимірювання точки роси. Принцип дії конденсаційного гігрометра базується на наступних засадах. За визначенням В = (ρа/ρн)100%. Визначити густину насиченого пару (ρн) не важко. Для цього достатньо виміряти температуру повітря і за відповідною таблицею визначити відповідну цій температурі густину насиченого пару.
Якщо ж говорити про густину того пару що фактично знаходиться в повітрі і яку називають абсолютною вологістю, то в загальному випадку ця густина є на відомою (ρа=?). Натомість відомо, що в процесі охолодження, пар рано чи пізно стає насиченим, тобто таким фактична густина якого дорівнює густині насиченого пару. А це означає, що визначивши ту температуру при якій повітря стає насиченим водяними парами (цю температуру називають точкою роси tр), ми за тією ж табл. можемо визначити абсолютну вологість повітря, яка фактично дорівнює густині насиченого пару для точки роси: ρа=ρн(tр).
Таким чином, для визначення абсолютної вологості повітря, необхідно експериментально визначити його точку роси. Власне для цього і призначений конденсаційний гігрометр. Цей прилад (мал.48а) представляє собою спеціальну ємність, передня металева стінка якої відполірована до дзеркального блиску. В верхній частині цієї ємності є невеличкий отвір, через який заливається рідина з високою інтенсивністю випаровування (зазвичай – етиловий ефір) і в який вставляється відповідних розмірів термометр. Крім цього, ємність з’єднана з гумовою грушою, за допомогою якої пари рідини виштовхуються назовню.
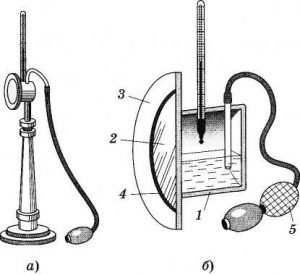
Мал.48. Загальний вигляд (а) та внутрішній устрій (б) конденсаційного гігрометра. Побутовий (в) та лабораторний (г) психрометри.
Принцип дії конденсаційного гігрометра полягає в наступному. В процесі інтенсивного випаровування, рідина (ефір), а разом з нею і відполірована поверхня гігрометра охолоджуються. При цьому охолоджується і те повітря що знаходиться в безпосередньому контакті з відповідною поверхнею. Коли температура цього повітря стане трішки нижчою за точку роси, наявний в ньому пар стане перенасиченим і почне конденсуватися. При цьому відполірована поверхня запітніє. Зафіксувавши температуру при якій починається це запітніння, ми по суті визначаємо точку роси для даного повітря. А знаючи точку роси, за відповідною таблицею визначаємо і їй відповідну абсолютну вологість повітря: ρа = ρн(tр).
Таким чином, знаючи температуру повітря і визначивши його точку роси, можна визначити як абсолютну так і відносну вологість цього повітря. Наприклад, якщо температура повітря 20ºС, а його точка роси 12ºС, то ρн(20ºС)=17,3г/м3; ρа=ρн(12ºС)=10,7г/м3; В=ρн(12ºС)/ρн(20ºС)=(10,7/17,3)100% = 62%.
Психрометр (від грец. psicros – холодний) – це прилад, який дозволяє визначати відносну вологість повітря на основі показань сухого та зволоженого термометрів. Будова психрометра гранично проста (мал.48в). Він складається з двох однакових термометрів, термочутливий елемент одного з яких обгорнутий шматком змоченої у воді тканини. Принцип дії цієї простої системи полягає в наступному. Відомо, що в процесі випаровування, температура рідини знижується, а в процесі конденсації – підвищується. При цьому, не важко збагнути, що інтенсивність процесу конденсації певним чином залежить від вологості повітря: при високій вологості, кількість конденсованих молекул буде великою, а при низькій – малою. По суті це означає, що та різниця температур (∆t) яка існує між показаннями сухого і зволоженого термометрів, певним чином залежить від температури та відносної вологості повітря. Дослідивши цю залежність вчені склали відповідну таблицю за допомогою якої і визначають відносну вологість повітря.
Потрібно зауважити, що зображений на мал.48(в) психрометр, має той недолік, що визначена на його основі відносна вологість, практично завжди є дещо завищеною. І це закономірно. Адже в тому місці де знаходиться зволожений термометр, вологість повітря дещо вища за її фактичну величину. Вища тому, що саме там і відбувається процес випаровування. А це означає, що зволожений термометр фактично реагує не на ту вологість яка є в кімнаті, а на ту яка існує в місці його знаходження. Запобігаючи цьому недоліку, в сучасних лабораторних психрометрах (мал.48г) передбачено примусове перемішування повітря, яке здійснюється за допомогою спеціального механічного або електричного вентилятора.
Вагові гігрометри, конденсаційні гігрометри та лабораторні психрометри, це прилади достатньо точні, надійні та об’єктивні. Однак їх практичне застосування потребує наявності певних знань та вмінь. Крім цього, дані прилади є приладами опосередкованої (непрямої) дії. Адже визначаючи вологість повітря, ми фактично вимірюємо не вологість, а інші, з нею пов’язані величини (масу, об’єм, температуру). Сама ж вологість визначається на основі відповідних вимірювань та відомих співвідношень. Ясно, що для побутової практики, такий опосередкований спосіб вимірювань є мало прийнятним.
В побутовій практиці, відносну вологість повітря зазвичай вимірюють гігрометрами прямої дії. Принцип дії цих гігрометрів базується на тому, що певні властивості деяких об’єктів, певним чином залежать від відносної вологості повітря. Наприклад, в сухому повітрі, клітини втрачають вологу і зменшуються в розмірах (всихають), а в вологому повітрі вони цю вологу накопичують і відповідно збільшуються в розмірах (набухають). А це означає, що лінійні розміри тих об’єктів які мають клітинну структуру, певним чином залежать від відносної вологості повітря. Дослідивши цю залежність можна створити відповідний прилад прямої дії. Одним з таких приладів є так званий волосяний гігрометр.
Волосяний гігрометр – це прилад, який дозволяє вимірювати відносну вологість повітря за допомогою знежиреного волосся. Основним волого чутливим елементом волосяного гігрометра є знежирена волосина (або пучок таких волосин) яка певним чином з’єднана з рухомою стрілкою приладу (мал.49). Принцип дії такої системи полягає в наступному. При зміні відносної вологості повітря, довжина волосини певним чином змінюється. При цьому, стрілка приладу відхиляється і вказує на відповідну величину відносної вологості.
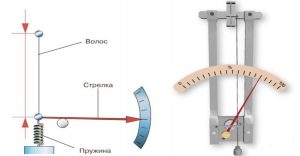

Мал.49. Загальний вигляд волосяних гігрометрів.
З точки зору побутової зручності, волосяний гігрометр є надзвичайно вдалим приладом. Однак з точки зору наукової об’єктивності, він не є тим приладом, показанням якого можна безумовно довіряти. Адже в процесі експлуатації, волого чутливий елемент волосяного гігрометра практично неминуче змінює свої властивості, наприклад за рахунок того, що покривається тонким шаром жирів. А це означає, що користуючись волосяним гігрометром, потрібно періодично звіряти його показання з показаннями інших, більш надійних приладів, скажімо тих же конденсаційних гігрометрів чи психрометрів.
Контрольні запитання.
1. Чому, з точки зору наших відчуттів, абсолютна вологість повітря не є зручною величиною.
2. Чому при зниженні температури в повітрі відчувається вогкість.
3. Як пояснити появу роси та туману?
4. Поясніть будову та принцип дії конденсаційного гігрометра.
5. Чим конденсаційний гігрометр схожий на холодильник.
6. Чому температура вогкого термометра практично завжди менша за температуру сухого? За яких умов ці температури будуть однаковими?
7. Поясніть будову та принцип дії психрометра.
8. Поясніть будову та принцип дії волосяного гігрометра.
Вправа 16.
1. Яка абсолютна і відносна вологість повітря, якщо його температура 18ºС, а точка роси 10ºС.
2. Абсолютна вологість повітря при 28ºС становить 14г/м3, а при 2ºС – 4г/м3. В якому випадку за відчуттями, повітря буде більш вологим?
3. При 25ºС відносна вологість повітря становить 70%. Скільки вологи виділиться з кожного кубічного метра повітря, при його охолоджені до 16ºС ?
4. У вечері при температурі 18ºС відносна вологість повітря становить 75%. При якій вранішній температурі можна очікувати появу туману?
5. При зниженні температури від 27ºС до 10ºС з кожного кубічного метру повітря виділилось 8г води. Якою була відносна вологість повітря при 27ºС?
6. При 15ºС в приміщенні розмірами 6×4×3 (м3), відносна вологість повітря 80%. Скільки вологи виділиться із повітря при зниженні температури до 10ºС? На скільки градусів треба нагріти повітря щоб його відносна вологість становила 60%?
7. В складському приміщенні об’ємом 1500м3 при температурі 12ºС відносна вологість повітря 75%. Що потрібно зробити для того, щоб при температурі 22ºС вологість повітря становила 60%?
8. В приміщення потрібно подати 104м3 повітря з температурою 18ºС і відносною вологістю 60%. Що потрібно зробити з зовнішнім повітрям (його температура 10% , а відносна вологість 60%) щоб виконати поставлену задачу?
9. За заданою густиною насиченого водяного пару (дивись таблицю) визначте його тиск при температурі 20°С, 50°С, 100ºС.
10. Певна маса повітря при температурі 22°С та відносній з вологості 75% займає об’єм 1200л. Якою буде відносна вологість цього повітря, якщо температуру підвищити до 100°С, а об’єм зменшити до 48л?
.
§17. Атмосфера Землі.
Термін атмосфера походить від двох грецьких слів atmos – пар; sphaira – куля, сфера. Атмосфера – це газова оболонка планети, яка обертається разом з нею як єдине ціле. Атмосфера Землі представляє собою суміш газів, яку прийнято називати повітрям. До складу цієї суміші входять: азот (78,08%), кисень (20,95%), аргон (0,93%), вуглекислий газ (0,03%) та певна кількість інших газів, зокрема гелію, неону, водню, метану, озону, криптону, ксенону, тощо. Вагомою складовою атмосферного повітря є водяний пар, кількість якого в різних географічних частинах атмосфери є різною і знаходиться в межах від 3% (для тропічних широт) до 0,00002% (для полярних областей). Крім цього, невід’ємною складовою атмосфери є певна кількість мікроскопічних домішок, починаючи від частинок земного та космічного пилу і закінчуючи вірусами та спорами рослин.
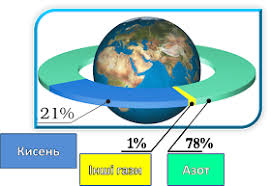
Мал.50. Основними складовими атмосфери Землі є азот (78%) та кисень (21%).
Точно оцінити лінійні розміри атмосфери практично не можливо. Адже не існує тієї чітко визначеної межі, яка відділяє те що можна назвати атмосферою, від того що прийнято називати космічним простором. Тому коли ви чуєте, що пілотований космічний корабель вийшов за межі земної атмосфери, то маєте знати що це не зовсім відповідає дійсності. Адже подібні кораблі літають на висотах від 250км до 500км над рівнем світового океану. Ознаки ж земної атмосфери можна знайти і на висоті 1000км, і навіть на висоті 10 000км. Зазвичай, в науковій практиці умовною межею земної атмосфери прийнято вважати висоту 400км над рівнем світового океану. На цій висоті молекули зустрічаються настільки рідко, що довжина їх вільного пробігу становить близько 60км. Втім, якщо говорити з практичної точки зору, то межею атмосфери Землі можна вважати висоту 100км над рівнем світового океану.
Основними фізико-хімічними характеристиками атмосферного повітря є його густина, тиск, температура, хімічний склад, тощо. Дослідження показують, що по мірі збільшення висоти, густина і тиск атмосферного повітря спочатку повільно, а потім все швидше і швидше зменшуються. Скажімо на висоті 2км густина повітря лише в 1,2 рази менша аніж на рівні світового океану. На висоті 20км, це зменшення становить вже майже 14 разів, а на висоті 100км – більш як 3 000 000 разів. (В математиці подібну залежність називають експоненціальною). Та не зважаючи на таку експоненціальну залежність, густина атмосферного повітря, а разом з нею і його тиск, змінюються прогнозовано плавно. І в цьому сенсі, атмосфера Землі є достатньо однорідною.
Зовсім по іншому веде себе температура. Вона то зменшується, то збільшується, то залишається незмінною, то знову зменшується і знову збільшується. І в цьому відношенні, атмосфера Землі нагадує слоєний пиріг, в якому повітряні шари де температура знижується, чергуються з шарами де вона зростає (мал.51). За характером зміни температури, атмосферу Землі умовно розділяють на п’ять ділянок: тропосфера, стратосфера, мезосфера, термосфера та екзосфера.
Мал.51. За характером зміни температури, атмосферу Землі умовно розділяють на п’ять ділянок.
Нижній шар атмосфери називають тропосферою (від грец. tropos – поворот, зміна напрямку). В тропосфері зосереджено 80% загальної маси атмосферного повітря, майже всі запаси водяного пару і основна частина механічних домішок. Характерною ознакою тропосфери є те, що в ній температура повітря поступово знижується (приблизно на 6ºС на кожний кілометр висоти). Це зниження відбувається до висот від 10км над полюсами до 18км над екватором. Простір обмежений поверхнею Землі та цими висотами і є тропосферою. Температура повітря на верхній межі тропосфери, в залежності від географічної широти знаходиться в межах від –55ºС (над полюсами) до –75ºС (над екватором).
За верхньою межею тропосфери, температурні параметри атмосфери Землі роблять свій перший «поворот». При цьому тропосфера плавно переходить в стратосферу (від лат. stratum – настил). В стратосфері, температура повітря спочатку залишається стабільно низькою (до висоти 20–30км), а потім поступово збільшується і досягає свого максимуму (приблизно 0ºС) на висоті близькій до 55км. Ця висота і є верхньою межею стратосфери.
В наступному атмосферному шарі – мезосфері (від грец. mezos – проміжний), температура знову знижується і на його верхній межі (80км над рівнем світового океану) досягає позначки –100ºС. В стратосфері та мезосфері зосереджено ще майже 20% загальної маси атмосферного повітря.
За мезосферою, температура робить свій черговий зиґзаґ і знову починає зростати. При цьому мезосферу змінює новий атмосферний шар, який прийнято називати термосферою (від грец. therme – тепло). На верхній межі термосфери (приблизно 600км над рівнем світового океану) температура «повітря» досягає 1000ºС. Об’єм термосфери майже в десять разів перевищує загальний об’єм всіх попередніх атмосферних шарів. Але той газ що утворює термосферу настільки розріджений, що його маса не перевищує 0,05% від загальної маси атмосферного повітря.
Характерною особливістю термосфери є те, що в ній фізико-хімічний склад атмосферного повітря суттєво змінюється. Головними причинами цих змін є жорстке сонячне випромінювання та велика кінетична енергія теплового руху частинок розрідженого газу. Під дією цих енергетичних факторів, молекули атмосферних газів по перше розпадаються на окремі атоми, а по друге, втрачаючи валентні електрони перетворюються на відповідні іони. А це означає, що термосфера представляє собою певну суміш молекул, атомів, позитивних іонів та вільних електронів. Наявність великої кількості вільних заряджених частинок, крім всього іншого кардинально змінює електромагнітні властивості термосфери. Констатуючи цей факт, термосферу часто називають іоносферою.
Над термосферою є ще певна кількість поодиноких атомів (головним чином атомів гелію, водню та їх іонів), які обертаються разом з Землею і утворюють зовнішню атмосферну оболонку яку називають екзосферою (від грец. ekzo – зовнішній). В екзосфері, температура того надзвичайно розрідженого газу, який майже не відрізняється від космічного вакууму, залишається практично незмінною і чисельно рівною 1000ºС.
Потрібно зауважити, що коли ми говоримо: «температура того розрідженого газу який утворює термо- та екзо- сфери Землі близька до 1000ºС», то термін «температура» застосовуєм досить умовно. Адже мова йде лише про те, що у відповідних областях навколоземного простору, середня кінетична енергія наявних атомів відповідає температурі 1000ºС, тобто становить 2,6·10–20Дж. При цьому ви маєте розуміти, що на тих висотах де частинки зустрічаються настільки рідко, що довжина їх вільного пробігу вимірюється десятками і сотнями кілометрів, навіть надзвичайно енергійні атоми суттєво нагріти будь яке макротіло практично не здатні.
Скажімо, якби ви опинились в термосфері, де температура «повітря» близька до 1000ºС, то без спеціального захисту, швидко перетворились би на шматок льоду. (Звичайно за умови що ваше тіло не нагрівалось би прямими сонячними променями). Перетворились би тому, що організм людини досить інтенсивно випромінює невидиме інфрачервоне (теплове) світло, і не менш інтенсивно випаровує вологу. При цьому, інтенсивність тих теплових процесів які призводять до втрати теплової енергії (випромінювання та випаровування) в сотні разів перевищують ту інтенсивність з якою енергійні але поодинокі атоми поповнюють енергетичний запас організму. Тому, коли вам трапиться чути про космічний холод, то майте на увазі, що цей холод може мати надзвичайно високу температуру. І навпаки. Не поспішайте температуру в 1000ºС завжди асоціювати з неймовірною спекою. Бо ця спека може виявитись надзвичайно холодною.
Напевно ви задаєтесь питанням: «а чому температура земної атмосфери змінюється таким дивним чином?» Сучасна наука знає відповідь на це запитання. Але для того щоб ця відповідь була зрозумілою, ви маєте дещо знати про світло та про деякі властивості атомів. Молекулярна фізика не є тим розділом фізики в якому вивчаються та пояснюються загальні властивості світла і тих об’єктів які називаються атомами, молекулами, іонами, тощо. Тому обмежимся лише тією мінімально необхідною, тезисною інформацією, яка допоможе вам зрозуміти суть тих обставин які визначальним чином впливають на формування атмосферного «слоєного пирога».
В свій час ви дізнаєтесь, що світло – це потік електромагнітних хвиль, які випромінюються і поглинаються певними порціями, фотонами. Що Сонце, окрім фотонів видимого світла випромінює величезну кількість фотонів світла невидимого, серед яких є фотони як з більшою енергією (ультрафіолетове випромінювання) так і з меншою енергією (інфрачервоне випромінювання). Ви дізнаєтесь, що кожна різновидність атомів і кожна різновидність молекул поглинає лише фотони певних параметрів і що при цьому енергія їх теплового руху збільшується. Власне здатність атомів (молекул) поглинати лише ті фотони які мають певні параметри і є основною причиною того, що атмосфера Землі має температурно шаристу структуру. Спрощено пояснюючи механізм формування цієї структури, можна сказати наступне.
Сонце випромінює фотони всього можливого спектру параметрів. Коли ця фотонна суміш зустрічається з молекулами атмосфери, то при взаємодії з ними, фотони певних параметрів поглинаються. При цьому кінетична енергія (температура) відповідних молекул збільшується. Власне за рахунок енергії тих фотонів які поглинаються молекулами екзосфери, температура цього зовнішнього атмосферного шару підтримується стабільно високою.
В екзосфері концентрація молекул надзвичайно низька. І тому більшість придатних для поглинання фотонів долітають до термосфери і віддають свою енергію молекулам цього атмосферного шару. Однак в термосфері концентрація молекул поступово збільшується, а кількість придатних для поглинання фотонів – зменшується. Тому, в цьому атмосферному шарі, температура розрідженого газу поступово знижується. Зауважимо, що в даному випадку ми аналізуємо характер зміни атмосферної температури в процесі наближення до поверхні Землі. А це означає, що там де рухаючись вгору ми стверджували: «температура підвищується», тепер говоримо: «температура знижується» і навпаки.
На висоті 80 км зниження температури припиняється і вона починає зростати. Звідки ж взялася та енергія що підігріває мезосферу? А джерелом цієї енергії є ті процеси що відбуваються в стратосфері. Справа в тому, що на висотах від 20км до 60км, тобто в тій частині атмосфери Землі яку прийнято називати стратосферою, складаються такі умови при яких утворюється значна кількість молекул озону (О3). Ці молекули мають одну надзвичайно важливу та корисну властивість – вони інтенсивно поглинають фотони ультрафіолетового випромінювання. При цьому саме ті, які не поглинаються іншими атмосферними газами. Це тим більш важливо, що саме цих фотонів Сонце випромінює надзвичайно багато, і саме ці фотони є надзвичайно шкідливими для організму людини та інших живих структур. Поглинаючи згубну для життя ультрафіолетову радіацію, молекули озону відповідно збільшують свою кінетичну енергію (температуру) та нагрівають те повітря що міститься в стратосфері, а заодно і підігрівають той розріджений газ що знаходиться в мезосфері.
Після стратосфери, в спектрі сонячного світла залишаються лише ті фотони, які практично не поглинаються молекулами повітря і які, ясна річ, не можуть розігріти масивну тропосферу. Цей нижній атмосферний шар повітря, нагріває сама поверхня Землі. Адже як би там не було, а більша частина фотонів видимого світла досягає поверхні Землі і нагріває цю поверхню. При цьому, нагріта земна поверхня, за рахунок конвекційних процесів, процесів випаровування–конденсації та теплового випромінювання, інтенсивно нагріває повітря тропосфери.
Потрібно зауважити, що ті процеси результатом яких є формування температурних атмосферних шарів, відбуваються лише на освітленій (денній) стороні планети. В нічний же час, всі температурні шари поступово охолоджуються, а межі між ними стають більш розмитими. Однак за ніч, температурні відмінності між атмосферними шарами не встигають зникнути і тому шариста структура атмосфери зберігається цілодобово. Лише в тих приполярних областях де панує полярна ніч, температурна структура атмосфери суттєво змінюється.
Потрібно мати на увазі і те, що вище змальована картина розподілу атмосферної температури, відображає лише статистично усереднені показники цього розподілу. Адже атмосфера Землі, це надзвичайно складний організм в якому відбувається безліч динамічних процесів, кожен з яких так чи інакше впливає на атмосферні параметри, в тому числі і на температурні. Наприклад в період сонячної активності (магнітних бурь), температурні параметри верхніх шарів атмосфери зазнають суттєвих змін.
Останнім часом, все більш і більш активним фактором впливу на атмосферні процеси стає техногенна діяльність людини. Результатом цієї діяльності є суттєве збільшення в атмосферному повітрі кількості вуглекислого газу (СО2). Вуглекислий газ має ту особливість, що практично безперешкодно пропускає те світло яке випромінюється Сонцем і не пропускає те інфрачервоне світло, джерелом якого є нагріта поверхня Землі. Іншими словами, вуглекислий газ створює так званий парниковий ефект. А це означає, що той надлишковий вуглекислий газ джерелом якого є техногенна діяльність людини, суттєво змінює існуючий на землі енергетичний баланс. При цьому змінює в надзвичайно небезпечному напрямку. Достатньо сказати, що головною причиною еволюційного самозародження та саморозвитку життя на Землі, є енергетична доцільність цього процесу. А одна з складових цієї доцільності полягала в тому, щоб зменшити кількість вуглекислого газу в атмосферному повітрі. Реалізуючи цю доцільність, життя, в процесі свого кругообігу, величезну кількість вуглецю вилучило з атмосферного повітря і у вигляді вугілля, нафти, торфу, сланців та горючих газів, надійно сховало у підземних кладових.
І от коли сьогодні, людина надмірно та бездумно черпає те, що за всіма законами Природи має знаходитись під землею, то вона діє всупереч законам Природи. Тобто всупереч тим законам, згідно з якими створено Всесвіт, Сонячну систему, Землю та нас з вами. Втім, будемо сподіватись, що у людства вистачить мудрості і мужності змінити глобально небезпечний хід подій.
Завершуючи розмову про атмосферу Землі, доречно сказати і про те як «зважують» атмосферу та її фрагменти. А «зважити» атмосферу зовсім не важко. Дійсно. Загально відомо, що атмосферне повітря створює тиск величина якого р0=101325Па. Але ж тиск характеризує ту силу, що діє на одиницю площі поверхні (р=F/S). В даному випадку, цією площею є площа поверхні Землі (S=4πR2), а тією силою що тисне на цю поверхню є вага атмосферного повітря (Р=Fт=mag). Таким чином: p0=mag/4πR, де ma – загальна маса атмосфери; g=9,81м/с2 – прискорення вільного падіння на Землі; R=6,37·106 – радіус Землі. Зважаючи на вище сказане, можна записати: ma=4πRp0/g=5,15·1018кг. 5,15·1018кг, це приблизно в 226 разів менше за загальну масу тієї води що міститься на Землі. І набагато більше того, що можна собі уявити.
Контрольні запитання.
1. Де і чому більше атмосферної вологи: в тропічних чи полярних широтах?
2. Що означає твердження: «по мірі збільшення висоти над поверхнею землі, густина та тиск атмосферного повітря експоненціально зменшуються»?
3. Чи можна на основі того, як з висотою змінюється густина повітря стверджувати, що атмосфера має шаристу структуру?
4. На якій підставі атмосферу Землі розділяють на певні шари?
5. Чому термосферу часто називають іоносферою?
6. Чому в стратосфері по мірі збільшення висоти температура повітря збільшується?
7. В чому суть парникового ефекту?
8. Чому надмірний видобуток та спалювання природних горючих копалин, може призвести до глобально негативних наслідків?