· А.М.Карбівничий
Фізика 8 клас


Передмова
В минулому навчальному році, ви ознайомилися з загальними основами того важливого розділу фізики, який називається механікою. Розділу, в якому вивчають параметри, закономірності та причини механічного руху тіл в усіх його проявах. В процесі вивчення механіки, ви отримали певний набір важливих теоретичних знань. Отримали навички розв’язування задач, а по суті – навички застосування теоретичних знань на практиці. Отримали навички виконання лабораторних робіт, а по суті – навички експериментальної перевірки достовірності чи недостовірності теорій.
В нинішньому навчальному році, спираючись на ті знання і навички які були отримані в процесі вивчення механіки, ви ознайомитеся з загальними основами ще чотирьох розділів фізики: молекулярна фізика, електродинаміка, оптика, фізика атома та атомного ядра.
Починаючи вивчення фізики, ми наголошували на тому, що ця наука така всеосяжна і багатогранна, що її не можливо вивчити інакше, як тільки у вигляді цілісної системи взаємоповязаних та взаємодоповнюючих знань. Важливою складовою цієї системи, є строго визначений порядок вивчення базових розділів фізики: механіка → молекулярна фізика → електродинаміка → оптика → фізика атома та атомного ядра → теорія відносності → космологія. І цей порядок обумовлений не лише логікою вивчення тих фізичних теорій які лежать в основі кожного розділу, а й логікою пізнання внутрішнього устрою речовини.
Наприклад вивчаючи механіку, ми не цікавилися внутрішнім устроєм тих тіл (речовин) механічний рух яких описували та пояснювали. Натомість вивчаючи молекулярну фізику, яка пояснює механічні і теплові властивості речовин, ми будемо виходити з того, що ці речовини складаються з надзвичайно дрібненьких частинок (молекул, атомів), які хаотично рухаються та певним чином взаємодіють між собою. Коли ж ми почнемо пояснювати різноманіття електромагнітних явищ, тобто те, що є предметом вивчення електродинаміки, то неминуче з’ясується, що ці явища не можливо пояснити без розуміння того, що атоми складаються з позитивно заряджених ядер та негативно заряджених електронів. Якщо ж ви захочите пояснити різноманіття тих явищ які є предметом вивчення фізики атома і атомного ядра, то неодмінно з’ясуєте, що для пояснення більшості з них потрібно знати внутрішній устрій атомних ядер та властивості тих елементарних частинок з яких ці ядра складаються.
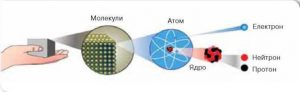
Мал.1. Послідовність вивчення розділів фізики значною мірою обумовлена логікою пізнання внутрішнього устрою речовини.
Ще один закономірний наслідок багатогранності та всеосяжності фізики полягає в тому, що в межах програми загальноосвітньої школи, фізику вивчають у два етапи. При цьому на першому етапі (7 – 8 клас) учні знайомляться з загальними основами фізики, а точніше тих її розділів, які називаються механікою, молекулярною фізикою, електродинамікою, оптикою, фізикою атома та атомного ядра. На другому етапі (9, 10, 11 клас), попередньо отримані знання, доповнюються новими знаннями, узагальнюються, систематизуються та представляються у вигляді цілісної системи знань, яка і називається фізикою – наукою про Природу.
І не варто говорити про те, що перший етап вивчення фізики, є надзвичайно важливим. Бо саме на цьому етапі закладається той фундамент на базі якого і постане та цілісна система знань, яка називається фізикою. Тому поставтеся до вивчення фізики у 7-8 класах з максимально можливою відповідальністю. При цьому маю надію, що в процесі навчання, ви не лише отримаєте глибокі знання, а й щиро полюбите цю найвеличнішу і найпрекраснішу з наук.
.
Зміст
§0. Основи математичної грамотності.
Розділ 2. Загальні основи молекулярної фізики.
Тема 2.1. Основи молекулярно-кінетичної теорії.
§1. Основні положення молекулярно кінетичної теорії.
§2. Загальні відомості про температуру.
§3. Загальні відомості про тверді, рідкі та газоподібні речовини.
Тема 2.2. Теплові явища.
§4. Про внутрішню енергію тіла. Теплообмін. Види теплообміну.
§5. Кількість теплоти. Рівняння теплового балансу.
§6. Нагрівання–охолодження. Питома теплоємність речовини.
§7. Загальні відомості про тверді тіла. Плавлення–кристалізація.
§8. Пароутворення–конденсація. Питома теплота пароутворення.
§9. Горіння–фотосинтез. Питома теплота згорання.
§10. Розв’язування задач. Тема: Закон збереження енергії в механічних і теплових процесах.
§11. Теплові двигуни.
Розділ 3. Загальні основи електродинаміки.
§12. Введення в електродинаміку.
Тема 3.1. Основи електростатики.
§13. Загальні відомості про електростатичні явища.
§14. Деякі досліди з електростатики та їх наукове пояснення.
§15. Закон Кулона.
§16. Загальні відомості про поля.
§17. Електричне поле та його характеристики
Тема 3.2. Основи електродинаміки постійних струмів.
§18. Загальні відомості про електричний струм та його прояви.
§19. Сила струму. Основні елементи електричного кола. Електрична напруга.
§20. Закон Ома. Електричний опір.
§21. Резистор. Послідовне з’єднання резисторів.
§22. Паралельне з’єднання резисторів. Закони Кірхгофа.
§23. Змішане з’єднання резисторів. Метод еквівалентних схем.
§24. Робота та потужність електричного струму.
§25. Закон Джоуля-Лєнца. Шляхи зменшення втрат в лініях електропередач.
§26. Розв’язування задач. Тема: Закон збереження енергії в електричних, механічних та теплових процесах.
§27. Електричний струм в металах.
Тема 3.3. Основи електродинаміки магнітних явищ.
§28. Загальні відомості про магнітні явища. Основи теорії Ампера.
§29. Магнітне поле та його характеристики.
§30. Сила Ампера.
§31. Застосування сили Ампера.
Розділ 4. Основи геометричної оптики.
§32. Загальні відомості про світло. Світлові промені. Джерела світла.
§33. Закон прямолінійного поширення світла.
§34. Закон відбивання світла. Дзеркальне та розсіюване відбивання світла.
§35. Загальні відомості про дзеркала.
§36. Заломлення світла. Закон заломлення світла.
§37. Повне внутрішнє відбивання світла. Загальні відомості про оптичні призми та оптичні волокна.
§38. Загальні відомості про лінзи та параметри тих зображень які вони формують.
§39. Графічне та алгебраїчне визначення параметрів тих параметрів які формують лінзи. Формула лінзи.
§40. Оптичні прилади.
§41. Око як природний оптичний прилад. Дефекти зору.
Розділ 5. Фізика атома та атомного ядра.
§42. З історії наукових поглядів на загальний устрій атома.
§43. Природна радіоактивність.
§44. Будова атомного ядра. Ізотопи.
§45. Радіація: джерела, дози, ризики.
.
§0. Основи математичної грамотності.
Розв’язування задач фізики нерозривно пов’язано з трансформацією загально відомих формул, та з виконанням математичних дій над числами представленими в стандартному вигляді. Сподіваюсь, минулого навчального року ви досягли певних успіхів у цьому напрямку. Однак буде не зайвим, якщо і цей навчальний рік ми почнемо з повторення того, як потрібним чином трансформуються (змінюються) математичні формули та як додаються, віднімаються, множаться і діляться числа представлені в стандартному вигляді.
Буде незайвим нагадати і те, що навчитися розв’язувати задачі, а в даному випадку математичні приклади, можливо лише в тому випадку, якщо ці задачі розв’язувати самостійно. А це означає, що на основі тих прикладів які наведені в даному параграфі, ви маєте самостійно розв’язати не меншу кількість аналогічних, бажано вами придуманих прикладів.
.
- Математичні трансформації (перетворення) формул.
В фізиці надзвичайно важливим вмінням, є вміння математично трансформувати (змінювати) задану формулу, а по суті, за заданою формулою визначати невідому величину. Загальне правило подібних трансформацій дуже просте: при перенесенні будь якої величини через знак дорівнює, пов’язана з цією величиною математична дія змінюється на протилежну: додавання змінюється на віднімання, віднімання змінюється на додавання, множення змінюється на ділення, а ділення змінюється на множення. При цьому відповідні величини переносять таким чином, щоб невідома величина (х) мала знак «+» і знаходилася в чисельнику.
Застосовуючи вище сформульоване правило, розглянемо низку конкретних ситуацій. А достовірність отриманого результату перевіримо на конкретних прикладах.
Загальні зауваження. Прагнучи максимально візуалізувати процес трансформації формули, цей процес на перших етапах бажано супроводжувати графічними ілюстраціями: та величина яка переноситься через знак « = », обводиться в кружечок і стрілкою вказується напрямок перенесення.
Зверніть увагу і на те, що в ситуаціях коли невідома величина має знак мінус (–х), або знаходиться в знаменнику (1/х), то трансформація формули здійснюється таким чином, щоб невідома величина була зі знаком плюс і в чисельнику.
Задача. За заданою формулою визначити невідому величину (х).
якщо х + а = b то x = b – a, дійсно, якщо х + 3 = 8, то x = 8 – 3 = 5;
якщо х – а = b то x = b + a, дійсно, якщо х – 3 = 8, то x = 8 + 3 = 11;
якщо а – х = b то x = a – b, дійсно, якщо 10 – х = 4, то x = 10 – 4 = 6;
якщо a = b – x то x = b – a, дійсно, якщо 5 = 20 – x, то x = 20 – 5 = 15;
якщо a·x = b то x = b/a, дійсно, якщо 5·x = 10, то x = 10/5 = 2;
якщо a/x = b то x = а/b, дійсно, якщо 20/x = 5, то x = 20/5 = 4;
якщо а = b/x то x = b/a, дійсно, якщо 5 = 10/x, то x = 10/5 = 2;
якщо ax/b = с то x = bc/a, дійсно, якщо 2·x/3 = 6, то x = 6·3/2 = 9;
якщо a/bx = с то x = a/bc, дійсно, якщо 6/3x = 2, то x = 6/3·2 =1;
якщо (a + x)/b = c, то 1) a+x = cb, 2) x = cb – a;
якщо a/(b – x) = c, то 1) b – x = a/c, 2) x = b – a/c;
якщо I = U/R, то U = I·R, R = U/I;
якщо v = s/t, то s =v·t, t = s/v;
якщо F = m∙a, m = F/a, a = F/m;
якщо x = x0 + vt, то vt = x – x0, звідси v = (x – x0)/t;
якщо s = at2/2, то a = 2s/t2,
якщо s = at2/2, то t2 = 2s/a, звідси t = √(2s/a);
якщо Q = I2Rt, то R = Q/I2t;
якщо Q = I2Rt, то I2 = Q/Rt, звідси I = √(Q/Rt).
.
- Представлення чисел в стандартному вигляді.
Оскільки: 103 = 10·10·10 = 1000; 105 = 10·10·10·10·10 = 100000 і т.д, то
4·105 = 400 000;
4,5·105 = 450 000;
28·104 = 280 000;
2,8·104 = 28 000.
І навпаки:
3 800 000 = 38·105 = 3,8·106;
125 000 000 = 125·106 = 12,5·107 = 1,25·108.
.
Оскільки: 10–3 = 1/103 = 0,001; 10–5 = 1/105 = 0,00001, то
4·10–3 = 0,004;
5·10–5 = 0,00005;
3,5·10–7 = 0,00000035.
І навпаки:
0,0002 = 2·10–4;
0,0000075 = 7,5·10–6 = 75·10–7;
0,000125 = 1,25·10–4 = 12,5·10–5 = 125·10–6.
.
- Математичні дії над числами представленими в стандартному вигляді.
Оскільки: 105·103 = (10·10·10·10·10)·(10·10·10) = 105+3 = 108,
105·10–3 = (10·10·10·10·10) / (10·10·10) = 105 –3 = 10–2,
то в загальному випадку 10х·10у = 10х+у. Наприклад:
2·104·4·106 = 2·4·104+6 = 8·1010;
5·106·3·103 = 5·3·106+3 = 15·109;
7·108·5·10–4 = 7·5·108–4 = 35·104;
4,4·10–5·2·10–3 = 4,4·2·10–5–3 = 8,8·10–8.
.
Оскільки: 1/103 = 1/1000 = 1·10–3; 1/10–3 = 1/0,001 =1·103, то в загальному випадку 1/10у = 10–у, 1/10–у = 10у (при перенесення степеню числа з чисельника до знаменники чи навпаки, знак степеню змінюється на протилежний). Наприклад:
2/10–5 = 2∙105 = 200000;
2/105 = 2∙10–5 = 0,00002;
2∙10– 5 = 2/105 = 0,00002.
.
В загальному випадку 10х/10у = 10х–у. Наприклад:
8·106/4·104 = (8/4)106–4 = 2·102;
12·105/3·10–4 = (12/3)105+4 = 4·109;
5·10–4/2·108 = (5/2)10–4–8 = 2,5·10–12;
15·103/3·108 = (15/3)103–8 = 5·10–5.
.
Оскільки (103)4 = (10·10·10)∙(10·10·10)∙(10·10·10)∙(10·10·10) = 103·4 = 1012, то в загальному випадку (10х)у = 10х·у. Наприклад:
(5·103)2 = 52·103·2 = 25·106;
(2·105)4 = 24·105·4 = 16·1020;
(4·10–3)2 = 42·10–3·2 = 16·10–6;
(3·10–4)3 = 33·10–4·3 = 27·10–12.
.
- Математичні дії над числами представленими у змішаному вигляді.
В науковій практиці загалом і в фізиці зокрема, виконуючи математичні дії над числами записаними в нестандартному або змішаному вигляді, ці числа спочатку представляють в стандартному вигляді, а вже потім виконують відповідні математичні дії. Наприклад:
500 000 · 0,003 = 5·105·3·10–3 = (5·3)·105–3 = 15·102;
0,00025·2·104 = 2,5·10–4·2·104 = (2,5·2)·10–4+4 = 5·100 = 5 (нагадаємо, будь яке число в нульовій степені дорівнює одиниці: 100 = 1);
12·104/0,0003 = 12·104/3·10–4 = (12/3)104+4 = 4·108;
0,00048/2·103 = 48·10–5/2·103 = (48/2)10–5–3 = 24·10–8.
.
- Визначення квадратного кореня числа.
Квадратним коренем числа а (позначається √а) називають таке число х, квадрат якого дорівнює числу а. Іншими словами: якщо х2 = а, то √а = х. Наприклад:
√4 = 2, бо 22 = 4;
√9 = 3, бо 33 = 9;
√16 = 4, бо 42 = 16;
√25 = 5, бо 52 = 25;
√100 = 10, бо 102 = 100;
√2 ≈ 1,41, бо 1,412 ≈ 2.
.
Можна довести: якщо мова йде про числа вигляду 10n, то √10n = 10n/2.
Наприклад: √104 = 104/2 = 102; √108 = 108/2 = 104; √10–6 = 10–6/2 = 10–3.
Можна довести, що √(а·b) = √а·√b. Наприклад:
√(25·106) = √25√106 = 5·103;
√(49·108) = √49√108 = 7·104;
√(16·10–4) = √16√10–4 = 4·10–2;
√(2,5·105) = √(25·104) = √25√104 = 5·102;
√(0,09·108) = √(9·106) = √9√106 = 3·103;
√(4,9·10–3) = √(49·10–4) = √49√10–4 = 7·10–2.
Задача. Маса однієї молекули води 3·10–20кг. Визначте масу 400 млн. молекул води.
Дано:
m1 = 3·10–20кг
N = 400 000 000 = 4∙108
m = ?
Рішення. Ясно, якщо маса однієї молекули m1, то загальна маса N таких молекул становитиме m = N∙m1.
Розрахунки: m = N∙m1 = 3·10–20кг∙4∙108 = (3∙4)∙10–20+8 = 12∙10–12кг.
Відповідь: m = 12∙10–12кг.
Вправа №0.
- За заданою формулою визначити невідому величину:
якщо V = S∙h, то h =
якщо a = F/m, то F =
якщо s = at2/2, то a =
якщо R = ρℓ/S, то S =
якщо R = ρℓ/S, то ℓ =
якщо Q = I2Rt, то R =
якщо S = πR2, то R =
якщо x = x0 – vt, то v =
якщо a = (v – v0)/t, то v =
- Задані числа представити в стандартному вигляді: 800000; 540000; 2540000; 0,000004; 0,00075; 0,00000128.
- Виконати математичні обчислення: 3·104·4·103; 6·10-5·3·104; 8·108·0,5·10–3; 2,8·10–4·2·10–3.
- Виконати математичні обчислення: 9·108/3·104; 45·10–3/5·105; 18·10–4/3·10–8; 3·106/2·10–4.
- Виконати математичні обчислення: (4·103)2; (2·10–4)4; (3·10–5)3; (8·106)2.
- Виконати математичні обчислення: 400000·3·105; 0,000025·2·10–5; 18·106/0,0006.
- Визначити корінь квадратний: √49; √81; √106; √(36·104); √(9·104); √(4·10– 4).
- Маса однієї бактерії 5·10–12кг. Визначте масу 400 млн. бактерій.
- Маса однієї кімнатної мухи 0,15г. Визначте масу 400 млн. мух.
.
Розділ 2. Загальні основи молекулярної фізики.
Молекулярна фізика – це розділ фізики, в якому вивчають і пояснюють загальні властивості твердих, рідких і газоподібних речовин та ті теплові процеси які відбуваються з ними. Іншими словами, предметом вивчення молекулярної фізики є речовини та різноманіття тих теплових процесів які відбуваються з ними.
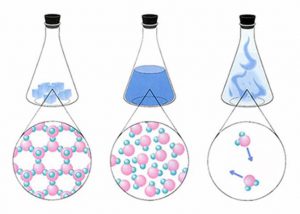
Мал.1 Молекулярна фізика вивчає загальні властивості речовин та ті теплові процеси які відбуваються з ними.
Нагадаємо, речовинами називають такі матеріальні об’єкти, які складаються з тих чи інших частинок і мають масу. В загальному сенсі речовинами є не лише хімічно прості об’єкти, як то залізо, вода, сіль, вапно чи нітрат амонію, і не лише хімічно складні полімери, а й об’єкти органічного походження як то деревина, шкіра, бавовна, а з рештою і самі живі структури. Однак, в молекулярній фізиці ми будемо вивчати загальні властивості лише тих хімічно простих речовин які складаються з атомів, молекул, іонів або їх сумішей.
Ви можете запитати: «А чому наука про загальні властивості речовин, називається молекулярною фізикою?» Відповідь на це слушне запитання очевидно проста. В молекулярній фізиці, властивості твердих, рідких і газоподібних речовин, та ті теплові процеси які з ними відбуваються, пояснюють виходячи з того, що ці речовини складаються з надзвичайно дрібних частинок, які прийнято називати молекулами.
Звісно, хімічно прості речовини можуть складатись не лише з молекул, а й з атомів, іонів або певної суміші цих частинок. Однак, в межах молекулярної фізики, ми без нагальної потреби не будемо заглиблюватись в деталі внутрішнього устрою тих структурних одиниць з яких складається та чи інша конкретна речовина. Ми будемо виходити з того, що всі речовини складаються з надзвичайно дрібних, невидимих частинок. І давайте домовимося, називати ці частинки молекулами.
.
Тема 2.1. Основи молекулярно-кінетичної теорії.
§1. Основні положення молекулярно – кінетичної теорії.
Пояснюючи загальні властивості твердих, рідких і газоподібних речовин, та ті теплові процеси які відбуваються з ними, ми будемо спиратися на ті знання які ви отримали в процесі вивчення механіки, та три базові твердження, які називаються основними положеннями (твердженнями) молекулярно-кінетичної теорії. А ці положення є наступними.
- Всі речовини складаються з молекул (молекул, атомів, іонів).
- Молекули в речовині безперервно та безладно (хаотично) рухаються.
- На невеликих відстанях (~10–9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
Про те, що тіла складаються з дрібних, невидимих частинок, люди здогадувались дуже давно. Ще за 400 років до нашої ери, давньогрецький філософ Демокрит стверджував, що всі тіла складаються з надзвичайно дрібненьких, неподільних частинок, які неперервно рухаються та певним чином взаємодіють між собою. Ці частинки давньогрецькі вчені називали атомами, що в буквальному перекладі означає «неподільний» (від грец. atomos – неподільний).
Однак, гіпотезі про молекулярну (атомарну) будову речовини, доля приготувала складний та тернистий шлях. Шлях довжиною в понад два тисячоліття. Лише в 1908 році ця гіпотеза стала безумовно доведеною науковою теорією.
Ви можете запитати: «А як це може бути, щоб ті люди які не мали бодай елементарного наукового обладнання, з такою впевненістю говорили про ті речі, факт існування яких був науково доведений лише в 1908 році?» Відповідаючи на це запитання можна сказати наступне. По суті, люди кардинально відрізняються від інших живих істот лише одним – здатністю логічно мислити. Власне ця здатність і дозволяє людям «бачити» те, чого вони ніколи не бачили і чого наочно побачити взагалі не можливо.
Скажімо, ми говоримо про те існують молекули чи не існують. Відповідаючи на це запитання зовсім не обов’язково мати надскладне обладнання та проводити надскладні експерименти. Цілком достатньо уважно придивитись до навколишнього світу і проаналізувати ті події які в ньому відбуваються.
Наприклад, ви берете склянку води і кладете у воду шматочок цукру. При цьому цукор швидко зникає (розчиняється). Ви можете скільки завгодно роздивлятись воду під мікроскопом в надії відшукати видимі частинки цукру і не знайдете їх. І тим не менше цукор нікуди не зник. Адже збереглась його визначальна смакова ознака відома кожному з вас. Чи не говорить даний експериментальний факт про те, що цукор складається з надзвичайно дрібненьких частинок? Частинок, які настільки дрібні, що їх не видно навіть в найпотужніший оптичний мікроскоп і про факт існування яких говорить те, що після розчинення та візуального зникнення цукру, зберігається його визначальна смакова, а по суті хімічна властивість.
Або скажімо, ви наливаєте в склянку певну кількість води і помічаєте, що з плином часу цієї води стає все менше і менше. Ви можете скільки завгодно придивлятися до того що ж відбувається і не помітите нічого, окрім факту того, що води стає все менше і менше. Чи не говорить даний експериментальний факт про те, що вода складається з надзвичайно дрібненьких частинок, які непомітно вилітають (випаровуються) зменшуючи тим самим загальну кількість води?
Або наприклад, той факт що крапля пахучої рідини поступово зникає, а натомість ви відчуваєте відповідний запах у всіх куточках кімнати. Чи не говорить даний факт про те, що відповідна рідина складається з надзвичайно дрібненьких частинок які є носіями певних властивостей цієї рідини і що ці частинки рухаються?
Або скажімо, факт того, що в процесі охолодження повітря, в ньому та на тих предметах що в цьому повітрі знаходяться, з’являються (конденсуються) крапельки води. Чи не говорить цей факт про те, що вода й до того знаходилася у повітрі і що ми її не помічали тільки тому, що відповідні мікрочастинки води є неймовірно маленькими?
А хімічні реакції? А процес горіння? А електроліз? А факт того, що атмосфера Землі представляє собою однорідну суміш різних газів? Чи не вказують ці та їм подібні явища і факти на те, що речовини складаються з дрібненьких частинок які постійно рухаються?
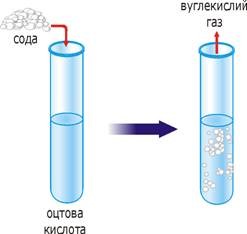
. розчинність випаровування хімічні реакції
Мал.2 Деякі факти, які вказують на молекулярну структуру речовини.
Звичайно, вище наведені факти не є такими, що безумовно доводять факт існування молекул. Однак вони безумовно вказують на те, що гіпотеза про молекулярну будову речовини є науково обгрунтованою. Якщо ж говорити про ті експериментальні дослідження які науково доводять факт існування молекул, то вони тісно пов’язані з явищем, яке було відкрите та описане англійським ботаніком Робертом Броуном (1773–1858).
В 1827 році, намагаючись за допомогою мікроскопа розгледіти будову квіткового пилку, Броун звернув увагу на те, що у водному розчині окремі пилинки постійно рухаються. Він розумів, що пилинки не є тими об’єктами які можуть самостійно рухатися. І тим не менше вони рухались. Дослідивши цей рух Броун з’ясував, що рух пилинок є безперервним та безладним і що його інтенсивність залежить від розмірів пилинок: чим дрібніші пилинки, тим інтенсивніше вони рухаються. Однак Броун так і не зумів пояснити причини відкритого ним явища.
Певний час причини броунівського руху були незрозумілими. Цей рух намагалися пояснити тремтінням того стола на якому стоїть мікроскоп; впливом того світла яким опромінюють ті об’єкти що знаходяться під мікроскопом; конвекційними потоками тієї рідини в якій плавають броунівські частинки, тощо. Однак експериментальні факти вказували на те, що ці та їм подібні обставини практично не впливають на поведінку броунівських частинок. На цю поведінку суттєво впливали лише розміри частинок та температура того середовища яке їх оточує (чим більша температура, тим більша інтенсивність броунівського руху і навпаки).
Поступово вчені дійшли висновку, що єдиним обгрунтованим поясненням броунівського руху є хаотичний рух молекул того середовища яке оточує броунівські частинки: невидимі молекули середовища, барабанять дрібні частинки речовини, а ті, реагуючи на ці хаотичні удари, відповідним чином рухаються. Броунівський рух – це безладний рух дрібних, видимих мікрочастинок речовини, причиною якого є хаотичний (тепловий) рух молекул навколишнього середовища.
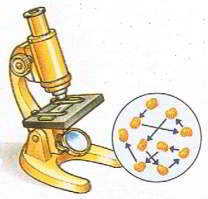
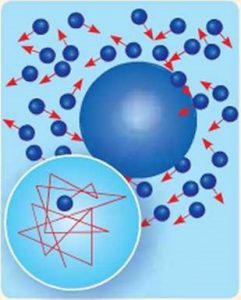
Мал.3. Хаотичний рух видимих мікрочастинок речовини (броунівський рух), є прямим наслідком хаотичного руху молекул навколишнього середовища.
Варто зауважити, що коли говорять про броунівський рух, то мають на увазі хаотичний рух тих візуально невидимих, але видимих у мікроскоп частинок речовини, причиною якого є хаотичний рух молекул того середовища яке оточує броунівські частинки. Якщо ж говорити про хаотичний рух самих молекул, то його називають тепловим рухом.
Тепловий рух – це безладний (хаотичний) рух молекул речовини. Він називається тепловим тому, що інтенсивність цього руху залежить від температури відповідної речовини: чим більша температура, тим інтенсивніший тепловий рух молекул і навпаки.
Броунівський рух не лише вказує на те, що молекули речовини рухаються, а й несе в собі певну кількісну інформацію про рух молекул. А це означає, що знаючи геометричні та вагові параметри броунівських частинок і кількісно аналізуючи їх поведінку, можна визначити параметри руху невидимих молекул. Наукову теорію броунівського руху розробив в 1905 році видатний німецький фізик Альберт Ейнштейн (1879–1955). Виходячи з того, що рух броунівських частинок є результатом хаотичного руху тих молекул які їх оточують, Ейнштейн теоретично описав закономірності руху цих частинок.
Ейнштейнівська теорія броунівського руху була експериментально перевірена і підтверджена в 1908 році французьким фізиком Жаном Переном (1870–1942). Власне лише після експериментів Перена, реальність існування молекул стала науково доведеним фактом.
До числа тих явищ які вказують на факт хаотичного руху молекул, відноситься дифузія. Дифузія (від лат. diffusion – розповсюдження, поширення) – це явище, суть якого полягає в тому, що в процесі хаотичного руху, молекули однієї речовини перемішуються з молекулами іншої речовини. При цьому, кожна різновидність молекул прагне до того, щоб концентрація цих молекул в усьому доступному об’ємі була однаковою.
Загально відомими прикладами дифузії є поширення запахів у повітрі і факт того, що та вода в яку потрапляє цукор чи сіль, з плином часу стає однаково солодкою чи солоною у всьому об’ємі води. Або якщо наприклад в стакан води капнути краплю барвника, чи скажімо вкинути кристалик марганцівки, то через певний час забарвлення води стане однаковим у всьому її об’ємі. І не важко збагнути, що дані факти пояснюється тим, що в процесі хаотичного руху, молекули різних речовин перемішуються.

Мал.4. Дифузія, це процес перемішування різнорідних молекул, причиною якого є хаотичний рух цих молекул.
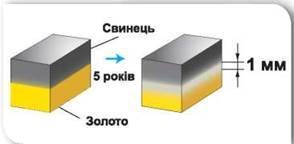
Дифузія відбувається не лише в рідинах та газах, а й в твердих тілах. Щоправда, в твердих тілах дифузійні процеси відбуваються надзвичайно повільно. Наприклад в одному з експериментів, дзеркально відполіровані пластини золота і свинцю поклали одна на одну і навантажили зовнішньою силою. Коли ж через п’ять років дані пластини спробували роз’єднати, то з’ясувалось, що вони в буквальному сенсі зрослися. При цьому, на межі контакту двох речовин утворився міліметровий шар суміші їх молекул.
Варто зауважити, що в твердженні: «кожна різновидність молекул прагне до того, щоб їх концентрація в усьому доступному об’ємі була однаковою», – термін «прагне», зовсім не означає, що молекули мають певні прагнення та бажання. Просто, у відповідності з законами природи, одним з наслідків хаотичного руху частинок, є факт їх перемішування. І тому, якщо в одному місці певних молекул багато, а в іншому мало, то через певний час, концентрація цих молекул в усьому їм доступному об’ємі виявиться однаковою.
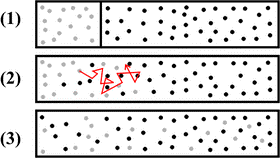
Мал.5. Дифузія, це наслідок хаотичного руху молекул.
Дифузія відіграє важливу роль в багатьох життєво важливих процесах. Наприклад завдяки дифузії, атмосфера Землі є однорідною сумішшю різних газів. Завдяки дифузії, розчини різних речовин є однорідними. В легенях тварин, завдяки дифузії молекули кисню потрапляють в кровоносні судини. Завдяки дифузії відбувається обмін речовин в клітинах. Дифузійні процеси лежать в основі роботи напівпровідникових приладів, технології дифузійного зварювання, різноманітних технологій покращення якості поверхонь деталей машин, тощо.
Сукупність вище наведених та багатьох інших фактів, безумовно вказує на те, що всі речовини складаються з молекул, і що ці молекули безперервно та безладно рухаються. Однак, чому ми вирішили що молекули взаємодіють між собою, та ще й таким дивним чином, що в залежності від міжмолекулярної відстані, притягуються або відштовхуються?
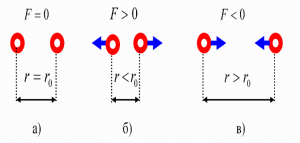
Втім, переконатися в факті того, що молекули дійсно взаємодіють і взаємодіють таким чином, що в залежності від міжмолекулярної відстані притягуються або відштовхуються, зовсім не складно. Достатньо взяти в руки будь яке тверде тіло, будь то лінійка, олівець, ручка чи гвіздок і запитати себе: «Якщо це тіло складається з молекул які рухаються, то чому ці молекули не розлітаються, а утворюють єдине ціле?».
Більше того, якщо ви спробуєте розтягнути тіло, а отже збільшити відстань між його молекулами, то неминуче відчуєте, силову протидію, яка означає що молекули притягуються. Якщо ж ви спробуєте стиснути тіло, тобто зменшити відстань між його молекулами, то з не меншою неминучістю відчуєте, що молекули відштовхуються. Висновок очевидний: молекули прагнуть розташуватися на певній відстані одна від одної. При цьому, якщо ця відстань збільшується, то молекули починають притягуватись, а якщо зменшується – відштовхуватись.
І не важко переконатися в тому, що сили міжмолекулярної взаємодії суттєво проявляють себе лише на дуже маленьких відстанях. Адже якщо ви розіб’єте чашку, або зламаєте брусочок крейди, а потім спробуєте об’єднати фрагменти раніше цілого, то нічого путнього з цього не вийде. Не вийде тому, що для молекул, навіть візуально мікроскопічна тріщинка між наявними фрагментами є нездоланною прірвою.
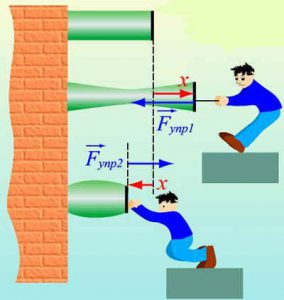
Мал.6. Механічні властивості твердих тіл безумовно вказують на те, що молекули взаємодіють між собою, і що в залежності від відстані – притягуються, або відштовхуються.
Дослідження показують, що та сила яку прийнято називати силою міжмолекулярної взаємодії є результуючою багатьох сил які так чи інакше впливають на поведінку молекул. Сьогодні ми не будемо говорити про природу та механізм дії цих сил. Сьогодні ми просто констатуємо той факт, що сила міжмолекулярної взаємодії представляє собою результуючу складної комбінації електромагнітних та квантово-механічних сил, з властивостями та проявами яких ми поговоримо у відповідних розділах фізики.
Таким чином, величезна кількість фактів безумовно вказують на те, що:
- Всі речовини складаються з молекул.
- Молекули в речовині безперервно та безладно (хаотично) рухаються.
- На невеликих відстанях (~10–9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
Виходячи з цих базових тверджень, ми і будемо пояснювати різноманіття тих явищ які є предметом вивчення молекулярної фізики, і в першу чергу тих, які прийнято називати тепловими явищами.
Контрольні запитання.
- Наведіть приклади тих явищ та фактів які вказують на те, що речовини складаються з молекул і що ці молекули рухаються.
- Поясніть, чому думаючі люди, ще з прадавніх часів стверджували, що всі тіла складаються з надзвичайно дрібненьких частинок?
- Що називають броунівським рухом? Від чого залежить інтенсивність цього руху?
- Що називають тепловим рухом? Від чого залежить інтенсивність цього руху?
- Чим схожі і чим відрізняються броунівський та тепловий рухи?
- Який внесок в розвиток молекулярно-кінетичної теорії зробив А. Ейнштейн?
- Що називають дифузією? Чи зустрічались ви з проявами дифузії у повсякденному житті?
- Наведіть докази того, що молекули взаємодіють між собою і що в залежності від міжмолекулярної відстані вони можуть як притягуватись так і відштовхуватись.
- Наведіть докази того, що молекули взаємодіють на надзвичайно малих відстанях.
- Чому частинки зламаного твердого тіла не об’єднуються в єдине ціле? Що можна зробити для того щоб з’єднати ці частинки?
.
§2. Загальні відомості про температуру.
Однією з базових фізичних величин молекулярної фізики є температура. В перекладі з латинської, слово «температура» означає «суміш». Така назва обумовлена фактом того, що колись вчені вважали, що температура тіла залежить від того, в яких пропорціях в цьому тілі змішані відповідна речовина та особлива теплова матерія яку називали теплецем. Згодом з’ясувалося, що ніякого теплецю не існує і від ідеї суміші теплецю з речовиною відмовились. А от слово «температура» залишилось, і сьогодні, як і сотні років тому характеризує ступінь нагрітості тіла. Втім, температура, це та фізична величина, яка має що найменше чотири різні наукові визначення. При цьому вчені так і не дійшли згоди відносно того, а яке ж з цих визначень є найбільш правильним.
Говорячи про температуру, доречно зауважити, що температуру тіла визначають не за суб’єктивними відчуттями людини, а за показаннями спеціального приладу який називається термометром. А якщо ви думаєте, що температуру можна визначити за своїми відчуттями, то проведіть наступний простий експеримент.
Візьміть сталеву ложку і шматок пінопласту, та приклавши їх до своїх щік, оцініть ступінь нагрітості цих тіл. Скоріш за все, ваші відчуття скажуть що ложка є холодною, а пінопласт – теплим. І це при тому, що температура цих тіл є абсолютно однаковою. Звичайно за умови, що пінопласт і ложка знаходилися в одному і тому ж місці і що температура цього місця суттєво менша за температуру вашого тіла.
Або наприклад, праву руку занурте у холодну воду, а ліву – в помірно гарячу. Після того як руки звикнуть до наявних температур, занурте їх у помірно теплу (літню) воду. При цьому права рука «скаже» що вода тепла, а ліва – що вона прохолодна.

Мал.7. Температуру потрібно визначати не за нашими суб’єктивними відчуттями, а за показаннями спеціального приладу – термометра.
Пояснюючи дані факти можна сказати наступне. Наш організм фактично реагує не на температуру, а на те як швидко втрачає або отримує теплову енергію. При цьому, втрачаючи енергію ми відчуваємо холод, а отримуючи енергію – теплоту. Припустимо, що в нашій ситуації температура металевої ложки та пінопласту є однаковою і чисельно рівною 17ºС. Оскільки теплопровідність металу є великою, то при контакті з металом наш організм, температура якого близька до 37°С, швидко втрачає енергію і відчуває холод. Теплопровідність же пінопласту гранично мала. А це означає, що при контакті з ним, теплові втрати організму будуть гранично малими і тому відчуття холоду будуть мало помітними.
Крім цього, наше сприйняття температури суттєво залежить від стану самого організму. Скажімо для тієї руки яка попередньо перебувала в холоді, тепла вода здається гарячою, а для тієї що перебувала в надмірному теплі, та ж вода здається прохолодною.
Отже, температура тіла оцінюється не за суб’єктивними відчуттями людини, а за показаннями спеціального приладу який називається термометром. При цьому важливою складовою процесу вимірювання температури є температурна шкала, тобто та система відліку в якій задано початок відліку температури (нульова точка), одиниця її вимірювання та еталонний метод цього вимірювання.
З побутової точки зору найбільш зручною та поширеною температурною шкалою є шкала Цельсія. Цю шкалу запровадив в 1742 році шведський вчений Андерс Цельсій (1701–1744). В температурній шкалі Цельсія за початок відліку температур прийнято температуру плавлення води (льоду); за одиницю вимірювання – градус Цельсія; за еталонний метод вимірювання – вимірювання температури ртутним термометром.
Будова сучасного побутового термометра загально відома (мал.8). Його основною деталлю є висока скляна колба, частково заповнена певною рідиною (зазвичай ртуттю або забарвленим спиртом). Напевно ви здогадуєтесь і про те, як градуюють термометр?! Правильно. Його спочатку опускають у суміш води і льоду, і відповідний рівень термометричної рідини позначають 0°С. Потім термометр опускають в окріп і наявний рівень рідини позначають 100°С. Після цього, відстань між отриманими точками ділять на сто рівних чистин і термометр готовий до застосування.
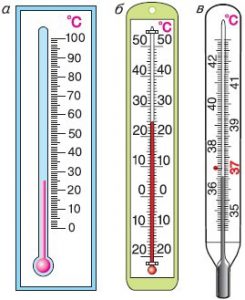
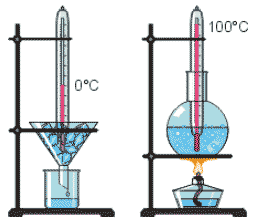
Мал.8. Загальний устрій та спосіб градуювання термометра.
З точки зору повсякденної практики безумовно найзручнішим є наступне наукове визначення температури. Температура – це фізична величина, яка характеризує ступінь нагрітості речовини (тіла), виміряну термометром за температурною шкалою Цельсія.
Позначається: t
Визначальне рівняння: нема, нема тому, що у відповідності з даним визначенням, температура є абсолютно автономною (незалежною від інших) величиною;
Одиниця вимірювання: [t] = °C, градус Цельсія.
Градус Цельсія (°С) – це одиниця вимірювання температури, яка дорівнює одній сотій інтервалу температур між точкою плавлення та точкою кипіння чистої води, визначеними при нормальному атмосферному тиску.
Визначення, температура – це фізична величина, яка характеризує ступінь нагрітості тіла виміряну термометром, має два суттєвих недоліки. По перше, воно не пояснює ні фізичної суті того що називають нагрітістю тіла, ні фізичної суті того що називається температурою. Це визначення лише констатує факт того, що певні параметри певних речовин, зокрема ртуті, певним чином залежать від ступеню нагрітості цих речовин (від їх температури), і що цей факт дозволяє певним чином вимірювати цю ступінь нагрітості.
По друге, дане визначення вводить температуру як абсолютно автономну величину, яка жодним чином не пов’язана з іншими величинами. Сучасна ж наука стоїть на тому, що Природа – це єдиний цілісний організм, в якому все взаємопов’язано та взаємообумовлено. І якщо ми прагнемо об’єктивно відобразити устрій цього цілісного організму, то маємо спиратися на відповідну систему взаємопов’язаних фізичних величин.
Крім цього, починаючи вивчення молекулярної фізики ми домовилися, що загальні властивості речовин та ті теплові процеси які відбуваються з ними, будемо пояснювати виходячи з трьох базових тверджень:
1) всі речовини складаються з молекул;
2) молекули в речовині безперервно та безладно рухаються;
3) на невеликих відстанях, молекули взаємодіють між собою.
А це означає, що в молекулярній фізиці, визначення тієї величини яка називається температурою, потрібно пов’язати з фактом того, що речовини складаються з молекул які рухаються та взаємодіють між собою. І не важко збагнути, що температура (нагрітість тіла) певним чином пов’язана з інтенсивністю хаотичного руху молекул. На цей зв’язок з усією очевидністю вказує той факт, що в процесі збільшення температури, інтенсивність дифузії, випаровування, броунівського руху та інших подібних явищ, збільшується і навпаки.
Аналізуючи величезну сукупність явищ та експериментальних фактів, вчені дійшли висновку: температура, це не просто міра нагрітості тіла, а величина, яка характеризує середню кінетичну енергію теплового (хаотичного) руху молекул.
Сьогодні ми не будемо говорити про той кількісний зв’язок який існує між температурою (t) речовини та середньою кінетичною енергією її молекул (Ек). Ми просто констатуємо факт того, що температура – це фізична величина яка характеризує ступінь нагрітості речовини та є мірою середньої кінетичної енергії її молекул (t ~ Ек). При цьому будемо вважати, що якщо температура речовин однакова (t1 = t2), то відповідно однаковими є і середні кінетичні енергії їх молекул (Ек1 = Ек2). Якщо t1 > t2, то Ек1 > Ек2, якщо t1 < t2, то Ек1 < Ек2.
Нагадаємо, Енергія – це фізична величина, яка є загальною мірою всіх видів рухів та взаємодій і яка характеризує здатність тіла, частинки або поля виконати роботу, тобто певну енергозатратну дію.
Позначається: Е
Визначальне рівняння: різні, в залежності від виду енергії;
Одиниця вимірювання: [E] = Дж = Н∙м = кг∙м2/с2, джоуль.
Енергія невичерпно різноманітна у своїх проявах. Різноманітна в тій же мірі як і самі явища природи. Наприклад говорять про енергію гравітаційних, електричних, електромагнітних та інших полів. Про енергію механічну, теплову, звукову, світлову, хімічну, біологічну, електричну, магнітну, електромагнітну, ядерну, внутрішню. Про енергію піднятого тіла та енергію пружно деформованого тіла, про енергію нагрітого тіла та енергію тіла що горить, про енергію хімічних реакцій та енергію термоядерного синтезу. І навіть те що не називають енергією, як то температура, кількість теплоти, робота чи маса, фактично характеризує ті чи інші прояви енергії.
Не дивлячись на все різноманіття видів енергії, практично будь яку її різновидність можна представити як певну комбінацію двох складових: енергії руху (кінетична енергія) та енергії взаємодії (потенціальна енергія).
Кінетична енергія (енергія руху) – це та енергія, яку має фізичний об’єкт за рахунок того, що він рухається і яка дорівнює половині добутку маси об’єкту на квадрат його швидкості.
Позначається: Ек
Визначальне рівняння: Ек = mv2/2
Одиниця вимірювання: [Ек] = кг∙м2/с2 = Н∙м = Дж.
Кінетична енергія є явною, очевидною, активною формою енергії, наявність і величину якої легко встановити: якщо той чи інший фізичний об’єкт, будь то камінь, планета, атом, молекула, чи що завгодно, маючи масу m рухається з швидкістю v, то цей об’єкт має кінетичну енергію величина якої визначається за формулою Ек = mv2/2.
Потенціальна енергія (енергія взаємодії) – це та енергія, яку має фізичний об’єкт за рахунок того, що він так чи інакше взаємодіяє з іншими об’єктами, або за рахунок тих взаємодій які відбуваються всередині цього об’єкту.
Позначається: Еп
Визначальне рівняння: Еп = ? (єдиної, універсальної формули для визначення потенціальної енергії нема)
Одиниця вимірювання: [Еп] = Дж.
Потенціальна енергія, це дуже складний вид прихованої енергії, величину якої в загальному випадку ми не вміємо визначати (Еп = ?). Не вміємо в тому сенсі, що на сьогоднішній день нема тієї універсальної формули, яка б дозволяла визначати потенціальну енергію системи в усьому різноманітті проявів цієї енергії.
Однак це зовсім не означає, що ми не вміємо визначати величину потенціальної енергії в тих чи інших конкретних випадках. Наприклад, в механіці ми вивчали дві різновидності потенціальної енергії, кожна з яких мала своє визначальне рівняння: потенціальна енергія сили тяжіння (Еп = mgh, де m – маса тіла, g =9,8м/с2 – прискорення сили тяжіння, h – та висота на яку піднято тіло) і потенціальна енергія сили пружності (Еп = kΔℓ2/2, де k – жорсткість тіла, Δℓ – абсолютна деформація тіла).
Та як би там не було, а фактом є те, що на сьогоднішній день універсальної формули для визначення потенціальної енергії і зокрема потенціальної енергії молекул речовини, не існує (Еп = ?).
Складність потенціальної енергії полягає не лише у відсутності тієї універсальної формули за якою ця енергія визначається, а й у прихованості проявів цієї енергії. При цьому часто буває так, що за одних обставин потенціальна енергія жодним чином не проявляє себе, а за інших – виникаючи ніби нізвідки, стає очевидно наявною. Зважаючи на це, не дивуйтеся тому, що та потенціальна енергія яка за одних умов вважалася мізерно малою, за інших обставин виявиться надзвичайно великою і навпаки.
Контрольні запитання.
- Слово «температура» в перекладі з латинської означає «суміш». Чому величина яка характеризує ступінь нагрітості тіла, отримала таку назву?
- Поясніть, чому сталева ложка, температура якої 15°С на дотик здається холодною, тоді як пінопласт такої ж температури – теплим?
- Якими будуть наші відчуття, якщо температура сталевої ложки і пінопласту становитиме 50°С?
- За якої температури метал і пінопласт здаватимуться на дотик однаково нагрітими?
- Які недоліки визначення: температура є мірою нагрітості тіла?
- Які факти вказують на те, що температура є мірою кінетичної енергії молекул речовини?
- Що означає твердження: «фізичний об’єкт має енергію»?
- Яка енергія називається кінетичною?
- Яка енергія називається потенціальною?
- Визначальне рівняння потенціальної енергії Еп = ?. Що це означає?
- Що означає твердження «потенціальна енергія є прихованою енергією»?
.
§3. Загальні відомості про тверді, рідкі та газоподібні речовини.
Все різноманіття речовин умовно розділяють на тверді, рідкі та газоподібні. Коли ми стверджуємо, що лід, залізо і пінопласт – тверді, вода, ртуть і олія – рідкі, а водяний пар, повітря та вуглекислий газ – газоподібні, то це означає, що існують певні класифікаційні ознаки, керуючись якими можна чітко визначити, до якої класифікаційної групи відноситься той чи інший об’єкт. І не важко збагнути, що при поділі речовин на тверді, рідкі і газоподібні, базовими класифікаційними ознаками є не густина, не електропровідність, не хімічний склад, не колір, не смак і навіть не твердість чи м’якість, а об’єм (V) та форма (Ф).
Дійсно. Коли ми стверджуємо, що лід, залізо і пінопласт є твердими, то маємо на увазі факт того, що ці абсолютно різні за твердістю, густиною, електропровідністю та іншими ознаками тіла, мають певну сталу форму (Ф = const) і певний сталий об’єм (V = const). Коли ми стверджуємо, що вода, ртуть і олія рідкі, то маємо на увазі, що ці абсолютно різні речовини мають певний сталий об’єм (V = const) але не мають певної сталої форми (Ф ≠ const). Якщо ж мова йде про газоподібні речовини, то їх визначальною ознакою є те, що вони не мають ні певного сталого об’єму, ні певної сталої форми (V ≠ const; Ф ≠ const). Не мають в тому сенсі, що газоподібні речовини займають увесь наданий їм об’єм і приймають форму тієї посудини в якій вони знаходяться.
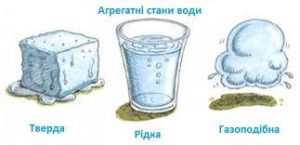
. V = const V = const V ≠ const
. Ф = const Ф ≠ const Ф ≠ const
Мал.9. Форма і об’єм є тими зовнішніми класифікаційними ознаками за якими різноманіття речовин розділяють на тверді, рідкі та газоподібні.
Класифікаційний поділ речовин за ознаками форма–об’єм, по суті відображає зовнішні відмінності між твердими, рідкими та газоподібними речовинами. Молекулярна ж фізика стоїть на тому, що в ній загальні властивості твердих, рідких і газоподібних речовин, в тому числі і ті які визначаються наявністю чи відсутністю певної форми та об’єму, пояснюються виходячи з трьох базових тверджень:
1) речовини складаються з молекул;
2) молекули рухаються;
3) молекули взаємодіють.
І такі пояснення безумовно існують. Дійсно. Оскільки молекули рухаються, то вони мають певну енергію руху, яку прийнято називати кінетичною Ек. Оскільки молекули взаємодіють, то вони мають певну енергію взаємодії, яку прийнято називати потенціальною Еп.
Не важко збагнути, що енергія взаємодії молекул прагне об’єднати ці молекули в єдине ціле. Натомість енергія руху, навпаки – прагне розірвати зв’язки між молекулами і розкидати їх. Ясно, що в такій ситуації агрегатний стан речовини та її загальні фізичні властивості, визначальним чином залежать від того, який енергетичний (а відповідно й силовий) фактор є сильнішим.
Скажімо, якщо тверді тіла мають певну сталу форму і певний сталий об’єм, то напевно це пояснюється тим, що середня потенціальна енергія молекул твердого тіла значно більша за їх середню кінетичну енергію (Еп ˃ Ек). Факт же того, що газоподібні речовини займають увесь наданий їм об’єм, очевидно означає, що та енергія яка прагне розкидати молекули (кінетична енергія Ек), значно більша за ту енергію яка прагне об’єднати молекули (потенціальна енергія Еп). Іншими словами, для газоподібних речовин Еп < Ек. Якщо ж мова йде про рідини, то їх молекули з одного боку тримаються купи (V = const), а з іншого – ця купа є надзвичайно хиткою (Ф ≠ const). І не важко збагнути, що таку ситуацію можна пояснити лише тим, що в рідинах, енергія взаємодії молекул якщо і перевищує енергію їх руху, то лише мінімально (Еп ≥ Ек).
Таким чином, визначаючи ті речовинні об’єкти які називаються твердими, рідкими та газоподібними, можна сказати наступне.
Твердими називають такі речовинні об’єкти, які мають певну сталу форму та певний сталий об’єм і в яких середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію. Іншими словами, для твердих речовин: Ф = const; V = const; Еп ˃ Ек.
Рідинами називають такі речовинні об’єкти, які мають певний сталий об’єм але не мають певної сталої форми і в яких середня потенціальна енергія молекул співрозмірна з їх середню кінетичну енергію. Іншими словами, для рідин: Ф ≠ const; V = const; Еп ≈ Ек.
Газоподібними називають такі речовинні об’єкти, які не мають а ні певної сталої форми, а ні певного сталого об’єму і в яких середня потенціальна енергія молекул значно менша за їх середню кінетичну енергію. Іншими словами, для газоподібних речовин: Ф ≠ const; V ≠ const ; Еп ˂ Ек.

. V=const V=const V≠const
. Ф=const Ф≠const Ф≠const
. Еп > Ек Еп ≈ Ек Еп < Ек
Мал.10. Агрегатний стан речовини залежить від співвідношення між кінетичною та потенціальною енергіями її молекул.
Варто зауважити, що оцінюючи величину та прояви потенціальної енергії молекул, потрібно завжди пам’ятати, що мова йде про дуже складний вид прихованої енергії, яка за одних обставин може практично не проявляти себе, а за інших – бути джерелом величезної кількості явної (кінетичної) енергії.
Наприклад, коли ми стверджуємо: потенціальна енергія молекул газу набагато менша за їх середню кінетичну енергію (Еп < Ек), то маємо на увазі не загальну величину потенціальної енергії молекул газу, а ту її незначну частину яка проявляє себе на енергетичному рівні «газ». А ця енергія дійсно набагато менша за кінетичну енергію молекул газу. Однак це зовсім не означає, що за певних умов, зокрема в процесі переходу речовини з газоподібного стану в рідкий (в процесі конденсації), та прихована потенціальна енергія яка на енергетичному рівня «газ» практично не проявляла себе, виявиться джерелом величезної кількості теплоти, а по суті кінетичної енергії молекул.
Твердження про те, що речовини бувають твердими, рідкими і газоподібними, з одного боку означає, що за одних і тих же умов одні речовини є твердими, інші – рідкими, а треті – газоподібними. Наприклад за звичайних умов дерево тверде, олія рідка, а повітря газоподібне. З іншого ж боку, за певних умов одна і таж речовина може бути твердою, рідкою або газоподібною. Наприклад вода може бути і твердою, і рідкою, і газоподібною. При цьому говорять, що вода може знаходитися в трьох агрегатних станах: твердому, рідкому чи газоподібному.
Звичайно говорячи про те, що речовина може знаходитись в трьох агрегатних станах, мають на увазі, що мова йде про хімічно прості речовини. Адже деревина не буває ані рідкою, ані газоподібною. А якщо і буває, то не у вигляді деревини. Крім цього далеко не всі хімічно прості речовини можуть знаходитись у всіх трьох агрегатних станах. Наприклад, карбонат кальцію (СаСО3), а простіше кажучи звичайна крейда, не буває ні рідкою, ні газоподібною. Не буває тому, що в процесі нагрівання, цей матеріал не досягнувши температури плавлення, розкладається на більш прості речовини: СаО та СО2. Подібне можна сказати і про переважну більшість хімічно складних речовин, як то біологічні матеріали, органічні сполуки, полімери, тощо. Однак, якщо говорити про хімічно прості речовини, то більшість з них за певних умов можуть бути і твердими, і рідкими, і газоподібними.
Якби вас запитали: «від чого залежить агрегатний стан тієї чи іншої речовини?», то скоріш за все ви б сказали, від температури. А подумавши, можливо б добавили – і від тиску. Відповівши таким чином, ви будете абсолютно праві. Адже агрегатний стан речовини дійсно визначальним чином залежить від її температури і зовнішнього тиску. Досліджуючи характер цієї залежності, звернемося до експерименту.
Припустимо, що у вас є шматок льоду, температура якого –20ºС. Нагріваючи лід, ви неодмінно зясуєте, що більшість його фізичних властивостей поступово змінюються. Але вцілому ці зміни можна вважати не суттєвими. Адже і при –20ºС, і при –10ºС, і при –0,1ºС, лід залишається льодом, тобто твердою речовиною з відповідним набором фізичних властивостей.
Коли ж температура льоду досягне 0ºС, то неодмінно з’ясується, що подальше її зростання неможливе без кардинальної, якісної зміни властивостей льоду. Адже при цій температурі лід плавиться і в процесі плавлення впрачає ознаки твердого тіла (наявність певної форми, наявність твердості, міцності, крихкості, тощо) і набуває ознак рідини (відсутність певної форми, наявність в’язкості, поверхневого натягу, тощо). Крім цього, в процесі плавлення, стрибкоподібно змінюються й інші властивості льоду, зокрема його питома теплоємність, густини, діелектрична проникливість, показник заломлення світла, тощо.
Ще однією визначальною ознакою плавлення, є факт того, що цей процес відбувається з поглинанням певної кількості енергії. При цьому, ця енергія йде не на збільшення кінетичної енергії молекул (адже температура речовини залишається незмінною), а на збільшення їх потенціальної енергії.
Після того як при температурі плавлення (0ºС) лід повністю перетвориться на рідину, та теплова енергія яка продовжує надходити до речовини, призведе до нового витка підвищення температури, але вже не твердого льоду, а рідкої води. При цьому в процесі зростання температури фізичні властивості води поступово змінюватимуться. Але вцілому ці зміни можна вважати несуттєвими. Адже і 5ºС і при 25ºС, і при 95ºС, вода залишається водою, тобто певною рідиною з відповідним набором фізичних властивостей.
Але, як тільки температура води досягне позначки 100ºС, неодмінно з’ясується, що подальше підвищення цієї температури неможливе без кардинальної, якісної зміни фізичних властивостей води. Адже при цій температурі вода кипить і в процесі кипіння перетворюється на пару, тобто газоподібну воду з відповідним набором фізичних властивостей. І допоки вода не википить, температура системи вода – пар залишатиметься незмінною і чисельно рівною 100ºС.
Звичайно, коли ми стверджуємо, що температура кипіння води дорівнює 100ºС, то маємо на увазі, що це кипіння відбувається за нормального атмосферного тиску (тиску в одну атмосферу тобто 101325Па ≈ 1·105Па). Адже змінюючи зовнішній тиск, можна досягти того, що вода закипить при 20ºС, або не закипить при 200ºС.
Та як би там не було, а при температурі кипіння, поглинаючи зовнішню енергію та перетворюючи її на потенціальну енергію своїх молекул, рідина переходить до якісно нового агрегатного стану і стає газоподібною. При цьому подальше нагрівання газоподібної речовини буде супроводжуватись відповідним підвищенням її температури та відповідними поступовими змінами фізичних властивостей газоподібної речовини.
Факт того, що зміна агрегатного стану речовини супроводжується різкою, стрибкоподібною зміною багатьох фізичних властивостей цієї речовини та стрибкоподібною зміною потенціальної енергії її молекул, лежить в основі наукового визначення терміну «агрегатний стан речовини».
Агрегатний стан речовини це такий фізичний стан даної речовини, який характеризується певним набором визначальних властивостей (зокрема наявністю або відсутністю форми та об’єму) і перехід до якого супроводжується стрибкоподібною зміною багатьох, в тому числі і визначальних властивостей цієї речовини, а також стрибкоподібною зміною потенціальної енергії її молекул. Розрізняють три агрегатні стани речовини: твердий, рідкий та газоподібний.
Говорячи про можливі стани речовини, варто згадати про ще один. Цей стан рідко зустрічається на Землі і надзвичайно часто у Всесвіті. Його називають плазмою. Пояснюючи суть того що називають плазмою, давайте розглянемо ті події які відбуваються в процесі нагрівання певної речовини, скажімо тієї ж води. Ось вона тверда, потім – рідка і на нарешті – газоподібна. Але що буде з газоподібною водою в процесі її подальшого нагрівання? А буде наступне. При певному рівні температур, молекули води почнуть розпадатись на атоми та групи атомів. А ті в свою чергу, втрачаючи валентні електрони, почнуть перетворюватись на відповідні іони. У підсумку, та речовина яка була водою, тобто такою що складалась з молекул Н2О, перетворюється на певну суміш окремих атомів, позитивних і негативних іонів та вільних електронів. Саме цю суміш і називають плазмою.
Плазмою називають частково або повністю іонізований газ, в якому концентрація вільних позитивно та негативно заряджених частинок є усереднено однаковою. Процес переходу речовини з газоподібного стану в стан плазми, прийнято називати іонізацією газу. Зворотній процес, тобто перехід речовини з стану плазми до стану газу, зазвичай називають рекомбінацією плазми.
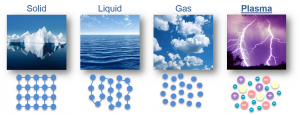
Мал.11. Плазма – це частково або повністю іонізований газ.
Фізичні властивості плазми суттєво відрізняються від властивостей газу. Головна причина цих відмінностей полягає в тому, що гази складаються з електронейтральних (незаряджених) частинок, а плазма – з певної суміші заряджених та не заряджених частинок, або лише з заряджених частинок. А це означає, що плазма проводить електричний струм, що на її поведінку визначальним чином впливають зовнішні електричні та магнітні поля, що її частинки взаємодіють не лише в момент безпосереднього контакту, а й на великих відстанях.
Сукупність цих відмінностей, дозволяє стверджувати, що плазма – це особливий, четвертий стан речовини. Однак з формальної точки зору, цей стан навряд чи правомірно називати четвертим агрегатним станом речовини. По перше тому, що в стані плазми, будь яка речовина не є тією речовиною, якою вона була в твердому, рідкому та газоподібному стані. Адже складовими частинками плазми є не ті атоми чи молекули з яких складалась базова речовина, а певна суміш окремих атомів, іонів та електронів.
По друге, перехід речовини від її газоподібного стану до стану плазми відбувається поступово та без певних стрибкоподібних змін властивостей цієї речовини. А це означає, що формальних підстав вважати плазму четвертим агрегатним станом речовини нема.
Та як би там не було, а при достатньо високих температурах, будь яка речовина набуває якісно нових властивостей, сукупність яких дозволяє стверджувати, що ця речовина перебуває в особливому стані. І цей стан прийнято називати плазмою.
Дослідження показують, що близько 99% наявної у Всесвіті речовини, знаходиться в стані плазми. В стані плазми знаходяться зірки та їх атмосфери, галактичні туманності та міжзоряне середовище. Плазмаю є та частина атмосфери Землі яку називають іоносферою. Плазмою є той розжарений газ який називають блискавкою, електричною дугою, полум’ям, тощо. Але не потрібно думати, що плазмою можуть бути лише високотемпературні гази. Скажімо, температура того розрідженого газу що світиться в лампі денного світла не є надто високою. І тим не менше, цей газ є плазмою. Або, наприклад, температура того газу що забезпечує кольорове зображення так званих плазмових екранів, мало відрізняється від кімнатної. І тим не менше, відповідний газ є плазмою.
Контрольні запитання.
- Які спільні риси шматків льоду, заліза та пінопласту?
- Чому густину не можна вважати тим критерієм, який дозволяє розділити речовинні об’єкти на тверді та рідкі?
- Виходячи з яких міркувань ми стверджуємо, що для твердих тіл Еп ˃ Ек, для рідин Еп ≈ Ек, для газів Еп < Ек?
- Як змінюється кінетична і потенціальна енергія молекул в процесі: а) плавлення; б) кристалізації; в) пароутворення; г) конденсації.
- Які визначальні ознаки переходу речовини з одного агрегатного стану в інший?
- Опишіть ті процеси які відбуваються при нагріванні хімічно простої речовини на її шляху тверде – рідке – газоподібне – плазма.
- Чим плазма відрізняється від звичайного газу? Які основні властивості плазми?
- Чи є формальні підстави вважати плазму четвертим агрегатним станом речовини? Чому?
.