
Розділ 5. Фізика атома та атомного ядра.
§42. З історії наукових поглядів на загальний устрій атома.
§43. Природна радіоактивність.
§44. Будова атомного ядра. Ізотопи.
§45. Радіація: джерела, дози, ризики.
Розділ 5. Фізика атома та атомного ядра.
Вивчаючи фізику, ми постійно наголошували і наводили безліч доказів того, що Природа, це єдиний цілісний організм в якому все взаємопов’язано та взаємообумовлено. Що фізика, це наука, яка є об’єктивним відображенням Природи викладеним у вигляді системи достовірних знань. Одним з проявів цієї системності є та послідовність в якій ми вивчали фізику: механіка – молекулярна фізика – електродинаміка – фізика атома та атомного ядра. Така послідовність є цілком обгрунтованою та закономірною. Закономірною бодай тому, що дозволяє поступово розширюючи наші уявлення про загальний устрій речовини, а відповідно і навколишнього світу, створювати цілісну систему знань. І в цьому сенсі розділ «Фізика атома та атомного ядра» є певним завершальним етапом формування наукової картини загального устрою Всесвіту. Щоправда ця картина, то лише гранично спрощене і максимально стисле відображення тієї фантастичної реальності яка називається Природою. Втім, у вас ще буде можливість значно розширити та поглибити ваші знання про цю фантастичну реальність.
Мал.179. В процесі вивчення фізики ми поступово розширювали наші уявлення про загальний устрій речовини, а відповідно і навколишнього світу.
§42. З історії наукових поглядів на загальний устрій атома.
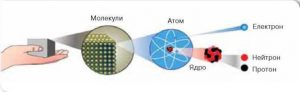
Про те, що всі речовини складаються з надзвичайно дрібненьких, неподільних частинок, давньогрецькі філософи говорили та писали ще за 500 років до нашої ери. Ці частинки вони називали «атомами» тобто «неподільними» (грец. atomos – неподільний). Власне такими неподільними, атоми вважалися до початку двадцятого століття. Лише в 1897 році відбулася подія, яка кардинально змінила історію атома. В цьому році англійський фізик Джозеф Томсон (1856–1940) на основі аналізу багатьох експериментальних фактів, безумовно довів, що до складу будь якої речовини, а отже і до складу її атомів, входять дрібненькі, негативно заряджені частинки, які отримали назву електрони. Іншими словами, в 1897 було відкрито першу елементарну частинку – електрон (m = 9,1·10–31кг; q0 = e = –1,6·10–19Кл). При цьому стало ясно, що атом має певний внутрішній устрій. З’ясовуючи цей устрій, доречно сказати про те, а що ж власне знали вчені про атоми на початок 20-го століття. А знали вони наступне:
- Атоми – частинки електронейтральні, однак такі, що за певних умов можуть перетворюватись на позитивно чи негативно заряджені іони;
- Атоми – частинки стабільні та довговічні;
- До складу атомів входять електрони.
Аналізуючи вище наведені факти та спираючись на закони класичної фізики, Джозеф Томсон в 1902 році запропонував першу, науково обгрунтовану модель атома – модель Томсона. Згідно з цією моделлю, атом представляє собою кулю однорідної, позитивно зарядженої речовини, в якій міститься певна кількість легеньких, негативно заряджених електронів.
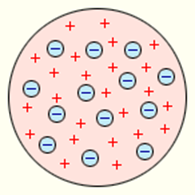
Мал.180. Схема загального устрою атома у відповідності з моделлю Томсона.
Модель Томсона цілком прийнятно (у всякому разі на якісному рівні) пояснювала всі відомі властивості атома. Дійсно. Згідно з цією моделлю, до складу атома входять електрони. За нормальних умов, атом Томсона є електронейтральним, тобто таким в якому загальний позитивний заряд кулястого тіла атома, в точності дорівнює загальному негативному заряду електронів. При цьому, втрачаючи або отримуючи електрони, атом легко перетворюється на відповідний іон. Атом Томсона представляє собою динамічно стійку та довговічну систему. Систему в якій електрони з одного боку взаємно відштовхуються, а з іншого – притягуються до центру атома тією силою яку створює позитивно заряджене тіло атома. В такій ситуації, електрони автоматично розташовуються в тих місцях де діючі на них сили електростатичного притягування та відштовхування зрівноважують ода одну.
Таким чином, запропонована Томсоном модель внутрішнього устрою атома, переконливо пояснювала всі його відомі властивості, і тому не безпідставно претендувала на загальне визнання. Однак наука стоїть на тому, що в ній критерієм істини є експеримент. А це означає, що в науці будь яка гіпотеза, в незалежності від того наскільки переконливою чи сумнівною вона виглядає, має бути експериментально перевіреною і відповідно підтвердженою чи спростованою. Яким же чином можна було перевірити внутрішній устрій атома в ті часи, коли сам факт існування атомів ще був під питанням? (Нагадаємо, що факт існування атомів (молекул) був безумовно доведений лише в 1908 році). Відповідь на це запитання дав англійський фізик Ернест Резерфорд (1871–1931).
В 1899 році, досліджуючи на передодні відкрите явище радіоактивності, Резерфорд експериментально встановив, що складовою частиною радіоактивного випромінювання є так зване α–випромінювання. При цьому він з’ясував, що α–випромінювання представляє собою потік швидких, масивних (m = 4а.о.м.), позитивно заряджених (q0 = +2е) α-частинок. Власне ці α-частинки Резерфорд і вирішив застосувати в якості того інструменту який дозволить дослідити внутрішній устрій атома.
Потрібно зауважити, що в науковій практиці маси атомів, молекул, та інших мікрочастинок, зазвичай вимірюють не в кілограмах, а в значно дрібніших одиницях, які називаються атомними одиницями маси (а.о.м): 1а.о.м = 1,66·10–27кг. Атомна одиниця маси приблизно дорівнює масі найлегшого атома – атома гідрогену (водню). Тому якщо наприклад сказано, що маса α-частинки 4а.о.м. то це по суті означає, що маса цієї частинки приблизно у чотири рази більша за масу атома гідрогену.
Однак, повернемося до Резерфорда. Ідея Резерфорда була гранично простою: якщо на шляху направленого потоку α-частинок поставити тонкий шар речовини, то при взаємодії з атомами цієї речовини, α-частинки будуть змінювати траєкторію свого руху. Аналізуючи ці зміни, можна буде зробити певний висновок щодо внутрішнього устрою атома.
В якості досліджуваної речовини, Резерфорд обрав золото. Такий вибір пояснювався двома обставинами. По перше, атоми золота є достатньо масивними (m = 197а.о.м.), а отже такими які при взаємодії з α-частинкою (m = 4а.о.м.) не будуть «відскакувати» від неї, та додатково не впливатимуть на траєкторію руху цієї частинки. По друге, Резерфорд розумів, що в умовах його експерименту, шар досліджуваної речовини має бути гранично тонким. Адже якщо таких шарів буде багато, то α-частинки багаторазово взаємодіючи з атомами речовини та багаторазово змінюючи траєкторію свого руху, «намалюють» певну усереднену картинку яка не відображатиме закономірностей внутрішнього устрою атома. А золото було саме тим матеріалом, який з незапам’ятних часів вміли виготовляти у вигляді надтонких плівок (плівок, товщина яких близька до одного мікрона, тобто до 0,001мм).
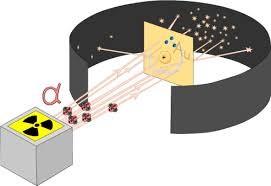
Реалізуючи свої ідеї, Резерфорд в 1906 році створює прилад для дослідження внутрішнього устрою атома (мал.180). Цей прилад представляв собою герметичний корпус в середині якого, в умовах глибокого вакууму знаходяться: контейнер з радіоактивною речовиною; тонкий шар золотої фольги; люмінісцируючий екран, тобто такий екран, фрагменти якого спалахували в тих місцях, куди потрапляли мікрочастинки. Принцип дії цієї системи очевидно простий. З отвору радіоактивного контейнеру вилітають α-частинки. Пролітаючи через тонкий шар золота, вони певним чином взаємодіють з його атомами та потрапляють на люмінісцируючий екран. При цьому у відповідних точках екрану можна побачити певні світлові спалахи.
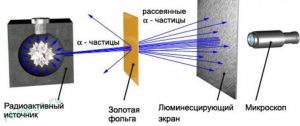
Мал.181. Схема та результати дослідів Резерфорда.
На які ж результати очікував Резерфорд виходячи з того, що модель Томсона є правильною? Перш за все Резерфорд розумів, що надлегкі електрони не можуть суттєво вплинути на поведінку масивних α-частинок, адже маса електрона в 7300 разів менша за масу α-частинки. Ця поведінка визначальним чином залежатиме від взаємодії α-частинки з тією масивною, позитивно зарядженою речовиною яка утворює тіло атома. При цьому можливі три варіанти поведінки α-частинок. 1) Якщо густина тіла атома є гранично малою (умовно кажучи, тіло атома є «газоподібним»), то всі α-частинки практично безперешкодно пролітатимуть через атоми речовини та потраплятимуть в центр екрану. 2) Якщо густина тіла атому є помірно великою (умовно кажучи, тіло атома є «рідким»), то всі α-частинки в процесі проходження через це тіло будуть гальмуватися та відповідним чином розсіюватись. А це означає, що потік α-частинок на екрані утворить однорідну пляму, діаметр якої залежатиме від густини тіла атома (чим більша густина, тим більша площа плями). 3) Якщо ж густина тіла атома є гранично великою (умовно кажучи, тіло атома є «твердим»), то при взаємодії з цим тілом, всі α-частинки відбиватимуться від нього.
Таким чином, якщо виходити з того, що модель Томсона є правильною, то в залежності від густини тієї речовини яка утворює тіло атома, Резерфорд мав би отримати один з наступних результатів: 1) всі α-частинки потрапляють в центр екрану; 2) всі α-частинки рівномірно розсіюються по певній частині екрану; 3) всі α-частинки відбиваються від золотої фольги.
Які ж результати отримав Резерфорд в дійсності? А ці результати були наступними. Переважна більшість α-частинок пролітаючи через фольгу потрапляли в центральну частину екрану. Приблизно десять відсотків α-частинок, пролітаючи через фольгу суттєво відхилялись та розсіювались по екрану. Деякі ж α-частинок (приблизно одна на десять тисяч) відбивалися від фольги так, ніби наштовхувались на масивну тверду перешкоду (мал.182). Дані результати безумовно вказували на те, що модель Томсона є неправильною. Ці результати можна було пояснити лише в тому випадку, якщо виходити з того, що в центрі атома знаходиться невелике за розміром, масивне, позитивно заряджене ядро.

Мал.182. Результати експериментів Резерфорда безумовно доводили, що в центрі атома знаходиться масивне, позитивно заряджене ядро.
Узагальнюючи результати багаторічних експериментальних досліджень, Резерфорд в 1911 році робить висновок: атом представляє собою електромеханічну систему, в центрі якої знаходиться масивне, позитивно заряджене ядро, навколо якого обертається певна кількість електронів. Запропоновану Резерфордом модель загального устрою атома, назвали планетарною моделлю атома. Така назва відображала цілком очевидну аналогію з будовою Сонячної системи. Адже подібно до атома, в центрі Сонячної системи знаходиться відносно маленьке за розміром, надмасивне Сонце, навколо якого обертаються значно дрібніші і легші планети. А потрібна сказати, що в Сонці зосереджено 98% від загальної маси системи, а з орбіти периферійних планет цієї системи, Сонце виглядає як звичайна але дуже яскрава зірка.
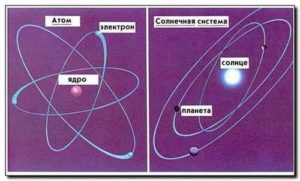
Мал.183. Запропоновану Резерфордом модель атома назвали «планетарною».
В загальних рисах, запропонована Резерфордом планетарна модель атома, зберігає свою актуальність і в наші дні. Адже сьогодні, як і понад сто років тому, ми вважаємо, що в центрі атома знаходиться масивне, позитивно заряджене ядро навколо якого обертаються дрібненькі, негативно заряджені електрони.
Інша справа, що в процесі еволюційного розвитку науки, наші уявлення про загальний устрій атома суттєво уточнювалися. Скажімо сьогодні ми знаємо, що в атомі електрони рухаються не строго визначеними траєкторіями, а знаходяться на певних енергетично дозволених рівнях. Що перебуваючи на енергетично дозволеному рівні, електрон представляє собою не над дрібненьку, негативно заряджену кульку, а певний хвильовий процес. Що поглинаючи енергію, електрон переходить на відповідний більш високий енергетичний рівень, а падаючи з цього рівня, він випромінює відповідну порцію (квант) світла, тощо.
Втім, про нюанси устрою атома, ми поговоримо в одинадцятому класі, коли розділ «Фізика атома та атомного ядра» будемо вивчати більш детально. Наразі ж будемо вважати, що атом представляє собою певну електромеханічну систему, в центрі якої знаходиться масивне, позитивно заряджене ядро, навколо якого обертається певна кількість електронів. І потрібно зауважити, що атомне ядро займає мізерно малу частину атома. Адже діаметр атомного ядра (≈ 2·10–15м) приблизно у 100 000 разів менший за діаметр відповідного атома (≈ 2·10–10м). А це означає, що в об’ємі атома, ядро займає лише 1/(105)3 = 1/1015 частину цього об’єму.
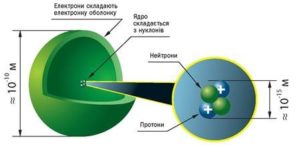
Мал.184. Атомне ядро займає лише 0,000 000 000 000 001 частину об’єму атома.
Контрольні запитання.
- Що означає слово «атом»?
- З якого моменту вчені почали задумуватися про внутрішній устрій атома?
- Що було відомо про атоми на початок 20-го століття?
- Яка будова атома згідно з моделлю Томсона?
- Як модель Томсона пояснювала ті факти які були відомі про атом?
- Чому маси атомів та інших мікрочастинок зазвичай вимірюють не в кілограмах, а в атомних одиницях маси? Чому дорівнює ця одиниця?
- Яка ідея лежала в основі дослідів Резерфорда?
- Чому у своїх дослідах, в якості досліджуваного матеріалу Резерфорд обрав золото?
- Які результати мав би отримати Резерфорд, якби модель Томсона була правильною?
- Які результати отримав Резерфорд в процесі своїх експериментів? На що вказували ці результати?
- Чому запропоновану Резерфордом модель атома назвали «планетарною»?
.
§43. Природна радіоактивність.
В 1896 році, французький фізик Анрі Беккерель (1852–1908) експериментально встановив, що уран, постійно та без явних енергетичних причин, випромінює якесь невідоме проміння з великою енергією та проникливою здатністю. Це явище назвали радіоактивністю тобто променевою активністю (від лат. radio – промінь, activus – активний, діяльний).
Відкриття Беккереля шокувало науковий світ. Шокувало тому, що одним з базових постулатів науки є закон збереження енергії. А в цьому законі стверджується: енергія виникати нізвідки не може. При цьому наука стоїть на тому, що будь який фундаментальний закон можна спростувати одним єдиним експериментальним фактом, який суперечить цьому закону. І от знайшовся експериментально встановлений факт, який явно суперечив закону збереження енергії. Адже уран, постійно і без видимих енергетичних причин випромінював велику кількість енергії.
Звісно, потім з’ясувалося, що ніякого протиріччя з законом збереження енергії не існує. З’ясувалося, що атоми урану, а точніше ядра цих атомів, утворюються в надрах надмасивних зірок, і що в процесі утворення в них накопичується така величезна кількість надлишкової енергії, яка і через мільярди років продовжує поступово випромінюватись. Втім, це стане зрозумілим лише через багато десятиліть. В кінці ж дев’ятнадцятого століття, ситуація виглядала таким чином, ніби було відкрито явище, яке явно суперечило базовому принципу науки – закону збереження енергії. Ясно, що в такій ситуації, велика кількість провідних науковців зацікавились даним явищем.
В 1898 році, французькі фізики П’єр Кюрі та його дружина Марія Складовська–Кюрі з’ясували, що радіоактивним є не лише уран (U92), а й торій (Th90). Більше того, в тому ж 1898 році, вони відкрили два нових, до того часу не відомих хімічних елемента, які були радіоактивними. Один з цих елементів назвали полонієм Ро84 (на честь Польщі – батьківщини Марії Складовської–Кюрі), інший – радієм Ra88 (за назвою того явища, яке дозволило зробити дане відкриття).
В 1899 році, англійський фізик Резерфорд, експериментально з’ясував, що при проходженні через потужне магнітне поле, «уранові промені» розкладаються на три складові: α-промені, β-промені, γ-промені (мал.185). Подальші дослідження показали, що альфа–проміння представляє собою потік швидких (v ≈ 5·103м/с), масивних (m = 4а.о.м.), позитивно заряджених (q= +2е) α-частинок, а по суті – ядер атома гелію (4α+2 = 4Не+2). Бета–проміння, представляє собою потік надзвичайно швидких (v ≈ 5·105м/с), надлегких (m = 0,0005а.о.м.), негативно заряджених (q = –е) β-частинок, а по суті – електронів (0β–1 = 0е–1). Гама–проміння, представляє собою потік надзвичайно коротких та енергійних фотонів невидимого світла.
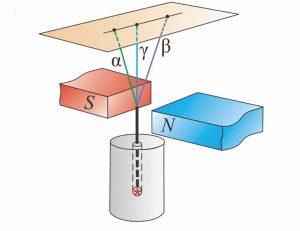

Мал.185. Схема дослідів Резерфорда: в магнітних (а) та електричних (б) полях «уранове проміння» розкладається на три складові.
В 1902 році Резерфорд, разом з англійським фізиком Фредеріком Содді (1877–1956) експериментально довели, що з плином часу, в хімічно чистому шматку урану (U92) неминуче з’являється інший хімічний елемент – радій (Ra88). Виходячи з цього, вони розробили першу науково обгрунтовану теорію радіоактивності. Згідно з цією теорією, радіоактивне випромінювання є результатом самовільного природного процесу, при якому атом однієї речовини випромінюючи α або β частинку, перетворюється на атом іншої речовини. В загальних рисах, теорія Содді–Резерфорда є правильною. Однак потрібно мати на увазі, що радіоактивне перетворення атомів є результатом відповідного перетворення атомних ядер. Адже альфа та бета частинки вилітають не просто з атома, а з атомного ядра.

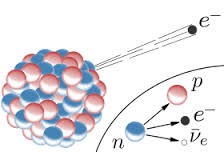
Мал.186. Радіоактивне випромінювання є результатом самовільного природного процесу, при якому атомні ядра однієї речовини випромінюючи α або β частинку, перетворюється на атомні ядра іншої речовини.
Однією з основних кількісних характеристик радіоактивності речовини є період її напіврозпаду. Періодом напіврозпаду радіоактивної речовини називають той проміжок часу протягом якого половина наявних атомів даної речовини розпадається, тобто перетворюється на атоми іншої речовини (позначається Т). Кожна радіоактивна речовина має свій період напіврозпаду. І величина цього періоду визначається експериментально. Наприклад:
для урану-238 Т = 4,5·109 років;
для урану-235 Т = 0,71·109 років;
для торію-235 Т = 80 000 років;
для радію-226 Т = 1620 років;
для плюмбуму-210 Т = 4 роки;
для полонію-210 Т = 138 днів;
для полонію-218 Т = 3 хвилини;
Твердження про те, що період напіврозпаду радію-226 становить 1620 років означає, що коли на даний момент у вас є, наприклад 10г радію, то через 1620 років цього радію залишиться 5г. Через наступні 1620 років, радію залишиться 2,5г. Ще через 1620 років – 1,25г, і т.д. При цьому інша частина радію перетвориться в атоми іншої речовини. І потрібно зауважити, що наука не може передбачити в який момент часу розпадеться даний атом радію. Ця подія може відбутися в дану мить, а може не відбутися і через мільйон років. Говорячи про період напіврозпаду речовини, мають на увазі лише те, що за наявності достатньо великої кількості атомів цієї речовини, наприклад такої що міститься в одному грамі, міліграмі чи навіть мікрограмі речовини, за певний проміжок часу розпадеться половина цих атомів. Однак, в який момент розпадеться той чи інший конкретний атом не можливо сказати навіть в принципі. Не можливо тому, що ті процеси які відбуваються в атомному ядрі, відбуваються з певною ймовірністю.
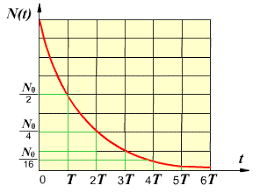
Мал.187. Характер зміни кількості радіоактивної речовини з плином часу.
Дослідження показують, що період напіврозпаду речовини, практично не залежить ні від кількості цієї речовини, ні від тих зовнішніх умов в яких вона знаходиться (температури, тиску, вологості повітря, тощо), ні від хімічного складу тих сполук, частиною яких є атоми відповідної речовини. І це закономірно. Адже радіоактивність є результатом тих процесів які відбуваються в атомному ядрі, тобто в тій частині атома, яка практично повністю ізольована від тих подій що відбуваються в навколишньому світі. Звичайно за умови, що ці події не стосуються самого атомного ядра. Адже якщо наприклад, ви нагрієте речовину до мільйонів градусів, то в процесі теплового руху фактично будуть взаємодіяти не атоми, а їх ядра. А такі взаємодії можуть суттєво впливати на період напіврозпаду речовини.
Період напіврозпаду речовини певним чином характеризує питому інтенсивність її радіоактивного розпаду. Скажімо радій (Т=1620 років) розпадається набагато інтенсивніше за уран (Т=4,5·109років) і тому є відповідно більш радіоактивним. Однак, якщо говорити про інтенсивність радіоактивності як про величину що характеризує кількість розпадів за одиницю часу, то вона залежить не лише від періоду напіврозпаду речовини, а й від кількості цієї речовини.
Ви можете запитати: якщо період напіврозпаду плюмбуму-210 становить 4 роки, то яким чином за ті 4,5 мільярди років які існує Земля, подібні атоми на ній збереглися. Втім, напевно ви вже здогадалися, що всі ці радіоактивні радії, полонії, плюмбуми та їм подібні атоми, зустрічаються на Землі тільки тому, що є продуктами розпаду таких довгожителів як уран-238 (Т = 4,5·109 років). І це дійсно так.
Дослідження показують, що останнім стабільним атомом таблиці хімічних елементів є плюмбум-208, і що всі більш важкі атоми є радіоактивними, тобто такими, які рано чи пізно розпадаються. І якщо на Землі подібні надважкі атоми зустрічаються, то це тільки тому, що серед їх різноманіття є невелика кількість тих, які розпадаються надзвичайно повільно. Скажімо період напіврозпаду урану-238 4,5·109 років. А це означає, що за час існування Землі (4,5·109 років), розпалася лише половина з тих атомів урану-238 які були в наявності на момент її формування. Загалом же, на теперішній час на Землі існує три так звані радіоактивні родини (ряди), джерелами яких є торій-232 (Т=13,9·109років), уран-238 (Т=4,5·109років) та уран-235 (Т=0,71·109років). Радіоактивною родиною (радіоактивним рядом) називають таку послідовність взаємопов’язаних радіоактивних атомів, в якій кожний наступний атом утворюється в результаті альфа або бета розпаду попереднього атома. Наприклад, поступово розпадаючись, ядра атома торію-232 утворюють наступний радіоактивний ряд.
- 232Тh+90 – 4α+2 → 228Ra+88 (T = 13,9·109 років)
- 228Ra+88 – 0β–1 → 228As+89 (T = 6,7 років)
- 228As+89 – 0β–1 → 228Th+90 (T = 6,13 годин)
- 228Тh+90 – 4α+2 → 224Ra+88 (T = 1,9 років)
- 224Ra+88 – 4α+2 → 220Rn+86 (T = 3,64 доби)
- 220Rn+86 – 4α+2 → 216Po+84 (T = 51,4c)
- 216Po+84 – 4α+2 → 212Pb+82 (T = 0,158c)
- 212Pb+82 – 0β–1 → 212Bi+83 (T = 10,6 годин)
- 212Bi+83 – 0β–1 → 212Po+84 (T = 60,5 хвилин)
- 212Po+84 – 4α+2 → 208Pb+82 (T = 3·10–7с)
- 208Pb+82 – стабільний.
Якщо ж говорити про радіоактивні родини урану-238 та урану-235, то їх можна описати наступною послідовністю розпадів:
238U+92→α→β→β→α→α→α→α→α→β→β→α→β→β→α→206Pb+82 ;
235U+92→α→β→α→β→α→α→α→α→β→β→α→207Pb+82.
З плином часу, в кожній радіоактивній родині встановлюється так звана вікова рівновага, тобто такий динамічний стан системи при якому швидкість утворення та швидкість розпаду проміжних членів родини є однаковою. В стані вікової рівноваги, кількість кожної різновидності проміжних атомів в наявній суміші радіоактивних елементів залишається незмінною. Однак, якщо говорити про співвідношення мас між базовим (материнським) та кінцевим елементами радіоактивної суміші, то з плином часу це співвідношення змінюється. А знаючи це співвідношення можна визначити вік відповідного об’єкту.
Наприклад знаючи співвідношення мас між U-238 та Pb-206 в тій чи іншій гірській породі, можна достатньо точно визначити вік цієї породи. Подібні методи визначення віку об’єктів називають радіоізотопним датуванням. Радіоізотопне (радіометричне) датування широко застосовується в геології, палеонтології, археології та інших науках. Це джерело практично всіх об’єктивних та достовірних датувань тих подій які відбувалися в історії Землі.
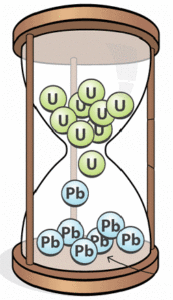
Мал.188. За співвідношенням мас U-238 і Pb-206 в тому чи іншому об’єкті, можна достатньо точно визначити вік цього об’єкту.
На завершення зауважимо, що записи 238U+92 і 238U92 відрізняються тим, що в першому випадку (238U+92) мова йде про позитивно заряджене ядро атома урану-238, а в другому випадку (238U92) – про атом урану-238, тобто ту незаряджену частинку яка складається з атомного ядра та відповідної кількості електронів.
Задача. Покроково опишіть ті ядерні перетворення які відбуваються в радіоактивній родині урану-235 і які відповідають послідовності 235U+92→α →β →α →β →α →α →α →α →β →β → α→ 207Pb+82.
Рішення. Знаючи порядкові номери і назви тих атомів які знаходяться у проміжку між плюмбумом і ураном (Pb82; Bi83; Po84; At85; Rn86; Fr87; Ra88; Ac89; Th90; Pa91; U92), та керуючись елементарною логікою, можна записати:
- 235U+92 – 4α+2 → 231Th+90
- 231Ra+90 – 0β–1 → 231Pa+91
- 231Pa+91 – 4α+2 → 227Ac+89
- 227Тh+89 – 0β–1 → 227Th+90
- 227Th+90 – 4α+2 → 223Ra+88
- 223Ra+88 – 4α+2 → 219Rn+86
- 219Rn+86 – 4α+2 → 215Po+84
- 215Po+84 – 4α+2 → 211Pb+82
- 211Pb+82 – 0β–1 → 211Bi+83
- 211Bi+83 – 0β–1 → 211Po+84
- 211Po+84 – 4α+2 → 207Pb+82
- 207Pb+82 – стабільний.
Контрольні запитання.
- В чому суть явища радіоактивності?
- Чому відкриття явища радіоактивності шокувало наукову громадськість?
- Чи дійсно явище радіоактивності суперечить закону збереження енергії? Чому?
- Що з’ясував в 1898 році Резерфорд?
- Що представляє собою α-частинки; β-частинки?
- Що називають періодом напіврозпаду радіоактивної речовини?
- Від чого залежить і від чого не залежить період напіврозпаду речовини?
- Чи можна за відомим періодом напіврозпаду речовини, визначити момент розпаду конкретного атома? Чому?
- Чому на Землі зустрічаються ті атоми, які вже давно мали б розпастися?
- Що називають радіоактивною родиною? Скільки таких родин натепер є на Землі?
- Що називають радіоізотопним датуванням?
Вправа 43.
- Покроково опишіть ті ядерні перетворення які відбуваються в радіоактивній родині урану-238 і які відповідають послідовності 238U+92→α →β →β →α →α →α →α →α →β →β →α →β →β →α →206Pb+82.
.
§44. Будова атомного ядра. Ізотопи.
Після того як в 1911році Резерфорд з’ясував, що в центрі атома знаходиться маленьке за розміром, масивне, позитивно заряджене ядро, практично відразу ж постало питання про внутрішній устрій цього ядра. А про те, що ядро має певний внутрішній устрій, з усією очевидністю говорило явище природної радіоактивності. Адже факт того, що в процесі радіоактивного розпаду атомів, випромінюються альфа та бета частинки, безумовно вказував на те, що ці частинки вилітають саме з атомного ядра.
Однак, як зазирнути всередину атомного ядра? Як довести, що воно складається з тих чи інших частинок? Адже мова йде про об’єкт, діаметр якого приблизно в 5000 разів менший за діаметр атома. Об’єкт, який займає лише декілька трильйонних частин об’єму атома.
Цілком закономірно, що проблемою з’ясування внутрішнього устрою атомного ядра зайнявся Резерфорд. Адже досліджуючи внутрішній устрій атома, Резерфорд бачив, що деякі α-частинки, наштовхувались на атомні ядра та відскакували від них (мал.189). Тому він, цілком слушно вирішив: якщо різні речовини опромінювати α-частинками, то є ймовірність того, що вони бодай з деяких ядер, вибиватимуть їх складові елементи. При цьому на люмінесцентному екрані приладу будуть зафіксовані відповідні спалахи.
а)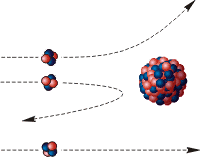 б)
б)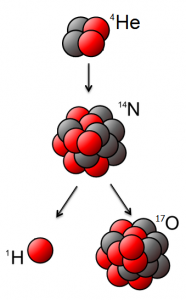
Мал.189. Суть (а) та результати (б) дослідів Резерфорда.
Реалізуючи дану ідею, Резерфорд в 1919 році з’ясував, що в процесі опромінювання азоту α-частинками, з’являються атоми кисню та якісь невідомі, позитивно заряджені частинки (мал195б). Ці частинки назвали протонами 1р+1 (m=1а.о.м. ; q = +1е). Здійснену Резерфордом ядерну реакцію можна записати у вигляді: 14N+7 + 4α+2 → 17O+8 + 1p+1 .
Подібні реакції часто називають реакцією розщеплення атомного ядра. Така назва не є надто вдалою. Адже при взаємодії з α-частинкою, ядро атома фактично не розщеплюється, а перетворюється на більш масивне та більш складне. Та як би там не було, а фактом залишається те, що в 1919 році Резерфорд здійснив першу штучну ядерну реакцію, в результаті якої була відкрита друга елементарна частинка – протон.
Таким чином, на 1919 рік в розпорядженні вчених було дві елементарні частинки: електрон (m=0а.о.м.; q= –1е) та протон (m=1а.о.м.; q= +1е). Виходячи з цього, в тому ж 1919 році, Резерфорд запропонував першу науково обгрунтовану протонно–електронну модель атомного ядра. Згідно з цією моделлю, атомні ядра складаються з протонів та електронів. При цьому, кількість протонів дорівнює масовому числу ядра (М), а кількість електронів – різниці між масовим (М) та зарядовим (Z) числом (порядковим номером атома). Іншими словами: Np = M; Ne = M – Z. Наприклад, згідно з протонно–електронною моделлю, ядро атома урану 238U+92 складається з 238 протонів та 238–92=146 електронів.
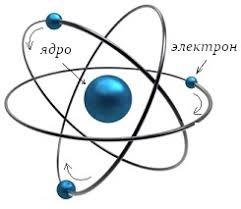

Мал.190. В 1919 році Резерфорд запропонував протонно–електронну модель атомного ядра.
Протонно–електронна модель, цілком задовільно пояснювала відомі на той час властивості атомного ядра. Зокрема пояснювала, яким чином позитивно заряджені протони та негативно заряджені електрони об’єднуються в міцну цілісну структуру. Пояснювала, звідки беруться альфа та бета частинки, тощо. Однак, після того, як всередині 20-х років були сформульовані базові закони квантової механіки, з’ясувалося, що згідно з цими законами, такі надлегкі частинки як електрони, не можуть знаходитись в таких над малих об’ємах як об’єм атомного ядра. Виходячи з цього, було теоретично передбачено, що в Природі, окрім протонів та електронів, має існувати ще одна елементарна частинка. Частинка, дуже схожа на протон, але не заряджена (електронейтральна). Цю частинку назвали нейтроном.
Дане теоретичне передбачення було підтверджене учнем Резерфорда, англійським фізиком Джеймсом Чедвіком (1891–1974). В 1932 році, Чедвік здійснив ядерну реакцію, одним з продуктів якої був нейтрон 1n0 (m=1а.о.м.; q=0): 9Ве+4 + 4α+2 → 12С+6 + 1n0. Потрібно зауважити, що експерименти в яких фіксували нейтронне випромінювання, проводились і раніше. Однак спочатку це випромінювання ідентифікували як потік потужних гама–квантів. Чедвік же довів, що це нове потужне випромінювання представляє собою потік електронейтральних частинок, маса яких близька до маси протона.
В тому ж 1932 році, було запропоновано протонно–нейтронну модель атомного ядра. Згідно з цією моделлю, атомні ядра складаються з протонів і нейтронів. При цьому, кількість протонів дорівнює зарядовому числу ядра, а кількість нейтронів – різниці між масовим та зарядовим числом. Іншими словами: Np = Z; Nn = M–Z. Наприклад, ядро урану 238U+92 складається з 92 протонів та 146 нейтронів.
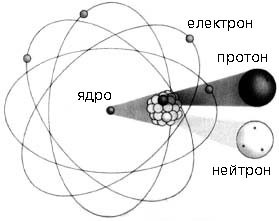
Мал.191. В 1932 році була запропонована сучасна протонно-нейтронна модель атомного ядра.
Подальші дослідження повністю підтвердили достовірність протонно-нейтронної моделі. Однак ця модель поставила перед вченими ряд наукових проблем. По перше, було незрозуміло, яким чином позитивно заряджені протони та електронейтральні нейтрони об’єднуються в таку міцну структуру як атомне ядро. Адже відомі на той час фундаментальні сили, сили гравітаційної та електромагнітної взаємодій, забезпечити таке об’єднання не могли (поясніть чому?). По друге, дослідження показали, що вільні нейтрони є частинками радіоактивними. І що вони, з періодом напіврозпаду 10,6 хвилини, розпадаються на протони та електрони: 1n0 → 1р+1 + 0е–1 . Звідси, з неминучою очевидністю виникало питання: чому у вільному стані (за межами атомного ядра) нейтрони розпадаються, а в ядрі – не розпадаються?
В процесі розвитку науки, ці та їх подібні запитання отримали вичерпні відповіді. Про ці відповіді ми поговоримо дещо пізніше. На разі ж стисло зупинимся на ще одному очевидному питанні, яке стосується факту того, що масові числа більшості хімічних елементів суттєво відрізняються від цілих чисел.
Дійсно. Аналізуючи ті дані які містяться в таблиці хімічних елементів, не важко бачити, що масові числа більшості з них суттєво відрізняються від цілих чисел: 6,9Li; 10,8В; 20,2Ne; 22,4Mg; 35,5Cl і т. д. При цьому виникає закономірне питання. Якщо атоми складаються з протонів (m=1), нейтронів (m=1) та електронів (m=0), то яким чином масове число атома виявляється суттєво нецілим? Пояснюючи даний факт можна сказати наступне. Хімічні властивості атома практично на 100% залежать від заряду його ядра, тобто від числа протонів в ньому. Скажімо, якщо в ядрі атома міститься 17 протонів, то цим атомом є хімічно активний неметал хлор. Збільшивши число протонів до 18, ми отримаємо абсолютно новий атом – хімічно інертний аргон. Додавши ще один протон, ми отримаємо атом хімічно активного металу – калію, який буде кардинально відрізнятись від двох попередніх атомів.
Якщо ж говорити про число нейтронів в атомному ядрі, то воно практично не впливає на хімічні властивості атома. Наприклад в ядрі одного атома хлору міститься 18 нейтронів, а в ядрі іншого атома хлору – 20 нейтронів. При цьому хімічні властивості обох атомів (35Сl17 та 37Cl17) будуть практично однаковими.
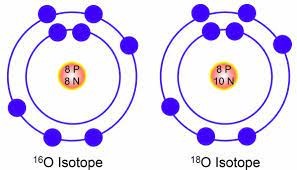
Мал.192. Хімічні властивості атома залежать від числа протонів і його ядрі і практично не залежать від кількості нейтронів у цьому ядрі.
Атоми, в ядрах яких міститься однакова кількість протонів але різна кількість нейтронів називають ізотопами (від грец. isos – однаковий, topos – місце). Ізотопи мають практично однакові хімічні властивості і тому цілком обгрунтовано знаходяться в одній і тій же клітинці періодичної системи та позначаються одним і тим же хімічним знаком. Однак інші властивості ізотопів можуть бути суттєво різними. Зокрема вони мають суттєво різну масу, а отже відповідно різну кількість гравітаційних, енергетичних та інерціальних властивостей. Ізотопи можуть бути як стабільними так і радіоактивними. При цьому різні радіоактивні ізотопи, мають різні періоди напіврозпаду.
Дослідження показують, що переважна більшість природних хімічно простих речовин, представляють собою певну суміш різних ізотопів. Наприклад природний, хімічно чистий хлор, на 75,4% складається з ізотопу 35Сl17 і на 24,6% з ізотопу 37Сl17. Ці ізотопи є хімічно ідентичними і тому в будь яких сполуках (NaCl; Cl2; HCl; тощо) зустрічаються в незмінних пропорціях: 75,4% 35Сl17 та 24,6% 37Сl17. В такій ситуації, визначаючи молярну масу хлору (тобто масу 6,02·1024 його атомів) хіміки неодмінно отримують одну і ту ж величину – 35,45г/моль. Виходячи з цього, у відповідну клітинку періодичної системи записується масове число 35,45. І як ви відтепер розумієте, це число характеризує масу певного усередненого атома хлору.
Таким чином, ті масові числа які містяться в таблиці хімічних елементів, фактично характеризують усереднену масу природного ізотопного складу відповідного елементу.
На сьогоднішній день відомо близько 280 стабільних та понад 2000 радіоактивних ізотопів. При цьому всі стабільні та частина радіоактивних ізотопів є природніми, тобто такими, які зустрічаються в природних умовах Землі і поява яких не пов’язана з діяльністю людини. Наприклад, природний гідроген (водень) складається з трьох ізотопів: гідроген-1 (протій) 1Н1 (99,984%), гідроген-2 (дейтерій) 2Н1 або 2D1 (0,016%) та гідроген-3 (тритій) 3Н1 або 3Т1 (≈10–10%). При цьому гідроген-1 та гідроген-2 є стабільними, а гідроген-3 – радіоактивним. Природний гелій складається з двох стабільних ізотопів: 4Не2 (99,9999%) та 3Не2 (0,0001%). Природний літій складається з двох стабільних ізотопів: 6Li3 (7,52%) та 7Li3 (92,48%)…. Природний уран, складається з двох радіоактивних ізотопів: 238U92 (99,3%) та 235U92 (0,7%).
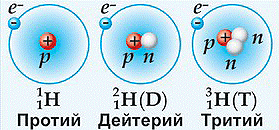
Мал.193. Ізотопи водню (гідрогену).
На ряду з природними, існує величезна кількість (понад 1500) штучних радіоактивних ізотопів, тобто таких ізотопів поява яких обумовлена діяльністю людини. Скажімо в сучасній періодичній системі хімічних елементів налічується 126 хімічно різних атомів. При цьому в природних умовах Землі, жодного атома з порядковим номером більшим за 92 не існує. Всі подібні атоми є штучно створеними радіоактивними ізотопами. Зазвичай, період напіврозпаду штучних ізотопів вимірюється хвилинами, секундами та долями секунди. Однак, серед штучно створюваних ізотопів зустрічаються і «довгожителі». Наприклад Т(236U92)=24·106років; T(92Nb41)=33·106років; T(10B4)=2,5·106років; T(26Al13)= 0,74·106років; T(36Cl17)=0,4·106 років.
Розділити ізотопи хімічним шляхом практично не можливо. Однак це зовсім не означає, що цього не можливо зробити взагалі. Переважна більшість методів розділення ізотопів, базується на залежності певних фізичних процесів від маси частинок. Скажімо відомо, що при одній і тій же температурі, середня швидкість теплового руху легких частинок більша ніж важких. А це означає, що через пористу перешкоду легкі частинки дифундують суттєво швидше ніж їх важчі аналоги. Організувавши низку таких дифузійних переходів, можна суттєво змінити ізотопний склад речовини. В промислових масштабах, подібним чином здійснюють так зване збагачення урану, тобто досягають того, що в урані, кількість ізотопу уран-235 збільшується від 0,7% до 4%.
Задача. Визначте невідому складову ядерної реакції:
а) 27Aℓ+13 + 1n0 → ? + 4He+2;
б) 238U+92 + 4He+2 → ? + 0γ0;
в) ? + 1р+1 → 22Na+11 + 4He+2;
Рішення. Подібні задачі розв’язуються на основі логіки звичайних математичних міркувань та за наявності таблиці хімічних елементів. Наприклад якщо 27Aℓ+13 + 1n0, то загальна маса продуктів цієї реакції має дорівнювати 27+1=28, а загальний заряд +13+0=+13. А оскільки одним з цих продуктів є 4He+2, то маса іншого має дорівнювати 28–4=24, а його заряд +13–2=+11. Це означає, що невідомою складовою даної реакції є ядро атома з порядковим номером 11, тобто атома натрію. Таким чином: 27Aℓ+13 + 1n0 → 24Na+11 + 4He+2. Якщо ж виходити з того, що кожну складову ядерної реакції можна охарактеризувати масовим (М) та зарядовим () числом, то стисле рішення задачі набуває вигляду:
а) Дано: 27Aℓ+13 + 1n0 → ? + 4He+2.
Оскільки 27 + 1 = М + 4, то М = 28 – 4 = 24;
Оскільки +13 + 0 = Z + 2, то Z = +13 – 2 = +11, атом натрій Na.
Відповідь: 27Aℓ+13 + 1n0 → 24Na+11 + 4He+2.
б) Дано: 238U+92 + 4He+2 → ? + 0γ0;
Оскільки 238 + 4 = М + 0, то М = 242 – 0 = 242;
Оскільки +92 + 2 = Z + 0, то Z = +94 – 0 = +94, атом плутоній Pu.
Відповідь: 238U+92 + 4He+2 → 242Pu+94 + 0γ0;
в) Дано: ? + 1р+1 → 22Na+11 + 4He+2.
Оскільки М + 1 = 22 + 4, то М = 26 – 1 = 25;
Оскільки Z + 1 = +11 + 2, то Z = +13 – 1 = +12, атом магній Mg.
Відповідь: 25Mg+12 + 1р+1 → 22Na+11 + 4He+2.
Контрольні запитання
- Які факти вказують на те, що атомне ядро має певний внутрішній устрій?
- В чому суть протонно-електронної моделі атомного ядра?
- Чому вчені передбачили існування нейтрона?
- Які проблеми створила протонно-нейтрона модель атомного ядра?
- Які атоми називають ізотопами? Чим схожі і чим відрізняються ці атоми?
- Якщо атоми складаються з протонів (m=1), нейтронів (m=1) та електронів (m=0), то чому масове число хлору (35,45) є нецілим?
- Поясніть, чому гравітаційні та електромагнітні сили не можуть забезпечити цілісність атомного ядра?
- В сучасній таблиці хімічних елементів понад 120 різних атомів. Скільки з них зустрічаються в природних умовах Землі? Скільки з них мають стабільні ізотопи?
- Чим відрізняються та в яких випадках застосовуються записи: 4Не2 та 4Не+2; 238U92 та 238U+92?
Вправа 44.
- Скільки протонів (Z) і скільки нейтронів (N) міститься в ядрі атома: а) 14N7; б) 35Сℓ17; в) 40Са20; г) 72Ge32; д) 206Pb82?
- Визначте невідому складову ядерної реакції:
а) 7Li+3 + 1р+1 → 4He+2 + ?;
б) 14N+7 + ? → 11B+5 + 4He+2;
в) 27Аℓ+13 + 0γ0 → 26Mg+12 + ?;
г) 14N+7 + ? → 17О+8 + 1р+1;
д) 10В+5 + 1n0 → ? + 4He+2.
- При бомбардуванні азоту 14N7 нейтронами, з ядра яке утворилося вилітає протон, а потім β – частинка. Запишіть відповідні ядерні реакції.
.
§45. Радіація: джерела, дози, ризики.
Термін радіація (від лат. radiatio – випромінювання, сяйво) має широкий спектр значень: сонячна радіація, ультрафіолетова радіація, інфрачервона радіація, радіохвильова радіація, тощо. Однак в науковій та побутовій практиці, цим терміном позначають так зване іонізуюче випромінювання, тобто те випромінювання що іонізує молекули повітря. А це означає, що частинки іонізуючого випромінювання повинні мати таку кількість енергії якої достатньо для того, вибивати електрони із таких міцних молекул як О2 і N2
В загальному випадку до числа іонізуючих випромінювань (радіації) відносять: альфа-випромінювання, бета-випромінювання, гама-випромінювання, рентгенівське випромінювання, жорстке ультрафіолетове випромінювання, нейтронне випромінювання та будь яке інше випромінювання, частинки якого здатні іонізувати молекули повітря, тобто здатні вибивати з цих молекул електрони. При цьому найбільш поширеними видами радіації прийнято вважати альфа-, бета- та гама- випромінювання. Загалом же, класифікаційну структуру іонізуючих випромінювань (радіації) можна представити у вигляді наступної схеми:

Однією з основних характеристик іонізуючого випромінювання є його прониклива здатність, тобто та відстань на яку можуть проникати частинки даного випромінювання в тому чи іншому середовищі. Ясно, що прониклива здатність іонізуючого випромінювання залежить як від параметрів частинок самого випромінювання (їх маси, заряду, енергії, тощо) так і від властивостей того середовища в якому ці частинки розповсюджуються (його густини, агрегатного стану, атомарного складу, тощо). Зазвичай, прониклива здатність електронейтральних частинок набагато більша ніж частинок заряджених.
Найменшу проникливу здатність мають масивні, позитивно заряджені α-частинки. Для них, тонкий аркуш паперу чи поверхневий шар шкіри є практично непереборною перешкодою. Тому зовнішня альфа-радіація не представляє для людини серйозної загрози. Ця загроза з’являється тоді, коли джерело α-частинок з повітрям, харчами чи через відкриті рани потрапляє всередину організму.
Прониклива здатність легких, негативно заряджених β-частинок є значно більшою. Ці частинки можуть проникати в організм людини на глибину до одного сантиметра. Тому для захисту від зовнішньої бета-радіації, потрібно застосовувати спеціальний одяг. Якщо ж говорити про гама-випромінювання та нейтронне випромінювання, то їх прониклива здатність є найбільшою. Ці види випромінювань здатні проникати навіть через стіни будинків. І в цьому сенсі, нейтронне та гама випромінювання є найбільш небезпечними. Що правда в природних умовах, нейтронне випромінювання зустрічається рідко. Натомість гама-випромінювання є найбільш розповсюдженим видом радіації. Адже γ-кванти випромінюються практично при всіх ядерних перетвореннях, в тому числі при альфа-, бета- та нейтронних розпадах.
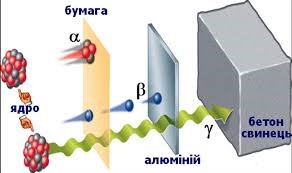
Мал.194. Різні види радіації мають різну проникливу здатність.
Радіація не лише іонізує молекули повітря, а й спричиняє певну біологічну дію. Ця дія полягає в тому, що частинки іонізуючого випромінювання хімічно активізують атоми та молекули організму. При цьому в організмі можуть з’являтися нові хімічні сполуки, в тому числі і шкідливі для нього. Крім цього, іонізуюче випромінювання може руйнувати окремі молекули організму та певні елементи його клітин.
Біологічна дія радіації має дві характерні особливості. Перша полягає в тому, що відносно малі кількості поглинутої організмом енергії випромінювання, можуть призвести до серйозних та навіть смертельних біологічних наслідків. Скажімо, якщо ту радіаційну енергію що є смертельною для організму людини перевести у відповідну кількість теплоти, то її вистачить лише на те щоб нагріти цей організм на 0,001ºС. Втім, дана особливість є досить сумнівною. Адже якщо, наприклад, енергію смертельної для людини кулі перевести в теплоту, то неодмінно з’ясується, що механічна енергія не менш смертельна за енергію радіаційну. Бо енергії смертельної для людини кулі вистачить лише на те, щоб нагріти її організм на все тих же 0,001ºС.
Другою особливістю біологічної дії радіації є те, що біологічні наслідки радіаційного опромінення стають відчутними не відразу, а через певний проміжок часу. Величина цього проміжку залежить від багатьох обставин (дози опромінення, режиму опромінювання, індивідуальних особливостей організму, тощо) і може становити від декількох хвилин до десятків років.
Говорячи про біологічну дію радіації, потрібно особливо підкреслити, що ця дія не є безумовно шкідливою та безумовно небезпечною. Адже всі живі організми завжди перебували, перебувають і будуть перебувати під дією так званого природного радіаційного фону. Тобто тієї постійно діючої радіації, джерелом якої є природні об’єкти та події. При цьому нема жодних вагомих підстав стверджувати, що цей природній радіаційний фон є небезпечним для організму людини та інших живих істот. Звичайно за умови, що інтенсивність цієї природної радіації не є надмірною.
Дослідження показують, що біологічна дія різних видів радіації є суттєво різною. Скажімо, біологічна шкода від альфа-випромінювання приблизно в 20 разів більша за ту шкоду яку спричиняє аналогічна за енергією кількість бета- або гама- випромінювання.
Величина, яка показує у скільки разів біологічна дія даного виду радіації більша за біологічну дію аналогічної за енергією кількості гама-випромінювання називається коефіцієнтом відносної біологічної ефективності випромінювання (позначається k). Для основних видів радіації, числові значення цього коефіцієнту є наступними:
– гама-випромінювання k = 1;
– рентгенівське випромінювання k = 1;
– бета-випромінювання k = 1:
– нейтронне випромінювання k = 10;
– альфа випромінювання k = 20.
Потрібно зауважити, що вище наведені значення коефіцієнтів біологічної ефективності випромінювання є певними усередненими величинами. І це закономірно. Адже в межах одного й того ж виду радіації, енергетичні параметри різних частинок можуть бути суттєво різними. Наприклад, максимальна енергія тих β-частинок які вилітають з атомів плюмбум-214 та вісмут-214 відповідно дорівнюють 0,65МеВ та 7,68МеВ. І не важко збагнути, що біологічна дія β-частинок різних енергій може бути суттєво різною. Крім цього, не слід забувати і про те, що біологічні наслідки радіаційного впливу, суттєво залежать від індивідуальних особливостей кожного конкретного організму.
Оцінюючи біологічну дію радіації, зазвичай орієнтуються на такі величини як поглинута та еквівалентна дози випромінювання. Поглинутою дозою випромінювання називають ту кількість енергії іонізуючого випромінювання що поглинається одиницею маси даного тіла.
Позначається: D
Визначальне рівняння: D = E/m, де Е – загальна кількість поглинутої тілом енергії іонізуючого випромінювання; m – маса тіла,
Одиниця вимірювання: [D] = Дж/кг = Гр, грей.
Еквівалентною дозою випромінювання (опромінення) називають ту величину яка дорівнює добутку поглинутої дози випромінювання на коефіцієнт біологічної ефективності цього випромінювання.
Позначається: De
Визначальне рівняння: De = kD
Одиниця вимірювання: [De] = Дж/кг = Зв, зіверт.
Прийнято вважати, що смертельно небезпечною для людини є еквівалентна доза випромінювання 5 Зв/рік.
Застарілою, позасистемною одиницею вимірювання еквівалентної дози випромінювання (опромінення) є бер – біологічний еквівалент рентгена. В побутовій практиці, цю одиницю (бер) часто називають просто «рентген». 1бер = 0,01Зв.
Загалом же, існує велике різноманіття величин які так чи інакше характеризують енергетичні параметри радіації: експозиційна доза, ефективна еквівалентна доза, колективна еквівалентна доза, повна еквівалентна доза, потужність поглинутої дози, потужність експозиційної дози, тощо. Ми не будемо визначати кожну з цих величин. Просто зауважимо, що такі величини існують і що за певних обставин ви можете з ними зустрітись.
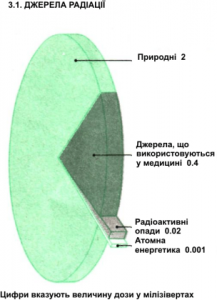
Побутує думка, що найбільшу дозу радіації людина отримує від тих джерел які так чи інакше пов’язані з атомною енергетикою. За деякими винятками, ця думка не має нічого спільного з дійсністю. Її хибність з усією очевидністю спростовують факти об’єктивних досліджень. А ці факти є наступними. За даними постійно діючої при ООН наукової комісії по дії атомної радіації, основними джерелами тієї річної дози радіаційного опромінення яку отримує середньо статистичний житель Землі, є:
- Та радіація яку отримує середньо статистичний землянин від природнього радіаційного фону, тобто від природних, постійно діючих джерел (розпад існуючих на Землі радіоактивних ізотопів, сонячна радіація, космічна радіація, тощо). В загальному радіаційному балансі, частка цієї дози опромінення становить 82,6% або 2 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всього комплексом тих джерел які пов’язані з атомною енергетикою (видобуток урану, його збагачення виготовлення твелів, експлуатація ядерних реакторів, переробка та зберігання ядерних відходів, проведення випробувань ядерної та термоядерної зброї, тощо). Сумарна доля цих джерел в загальному радіаційному балансі становить 0,04% або 0,001 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всієї сукупності техногенних джерел не пов’язаних з атомною енергетикою (шкідливі відходи різноманітних виробництв, той дим який викидають в атмосферу наші заводи, автомобілі, тощо). Сумарна доля цих джерел становить 0,8% або 0,02 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всієї сукупності медичних джерел (рентгенівська, флюорографічна та радіоізотопна діагностика, променева терапія, радіохірургія, тощо). В загальному балансі радіаційного навантаження, доля медичних джерел становить 16,5% або 0,4 мЗв/рік.
*) Дані факти наведені в книзі “Радіація: дози, ефекти, ризики“, яка представляє собою узагальнення тих фактів, що були зібрані Науковим комітетом по дії атомної радіації при ООН, за 30 років його діяльності. (Москва. Видавництво “Мир”, 1990).

Мал.195. Оцінюючи ті ризики які пов’язані з атомною енергетикою, потрібно послуговуватись фактами, а не домислами.
Таким чином, об’єктивні дослідження показують, що найбільшим джерелом тієї радіації яку отримує середньо статистичний житель Землі, є той природний радіаційний фон в якому ми завжди жили, живемо і будемо жити. При цьому половину цієї природної радіації ми отримуємо від атомів хімічно інертного радону (Rn86) та продуктів його радіоактивного розпаду. Радон є складовою частиною повітря і тому потрапляє в наш організм разом з тим повітрям яке ми вдихаємо. А оскільки радон та його дочірні атоми альфа-радіоактивні, то і та біологічна шкода яку спричиняє ця внутрішня альфа-радіація може бути великою. (Нагадаємо, для альфа-випромінювання k=20).
Втім, про ілюзорність тієї небезпеки яку приховує у собі природна радіація, з усією очевидністю ілюструє той факт, що загально визнаним лікувальним засобом є так звані радонові ванни, тобто ті лікувально-профілактичні процедури, які відбуваються у воді насиченій радіоактивним радоном.
Як це не парадоксально, а фактом залишається те що найпотужнішим джерелом тієї радіації якої ми так панічно боїмося є не атомна енергетика, а наша медицина. Адже середньорічна доза тієї радіації яку отримує середньостатистичний землянин від медичних джерел в 400 разів більша за ту дозу яку він отримує від всієї сукупності джерел пов’язаних з атомною енергетикою. І тим не менше, ми схильні вважати що саме атомна енергетика є основним джерелом радіації.
Звісно, вище наведені середньостатистичні дані не відображають нюансів кожної окремо взятої ситуації. Скажімо та доза яку отримує конкретна людина від медичних джерел, може вимірюватись як практично нульовою величиною (для тих хто жодного разу не стикався з сучасною медициною) так і тисячами середньорічних доз (для тих хто в процесі лікування раку отримував променеву терапію). Тим не менше, вище наведені узагальнюючі факти, з усією очевидністю вказують на те, що наші фобії відносно екологічної та радіаційної шкідливості атомної енергетики, м’яко кажучи, перебільшені. Об’єктивні факти безумовно доводять, що екологічна шкода від штатно працюючої атомної електростанції в сотні, а то й в тисячі разів менша за ту, яку створюють ті автомобілі що їздять дорогами наших міст.
Інша справа – потенційна небезпечність ядерної енергетики. І в цьому сенсі атомна електростанція, а точніше – її ядерні реактори, дійсно є потенційно небезпечними об’єктами. І ця потенційна небезпечність закладена в самому принципі дії ядерного реактора. Адже ядерний реактор працює в умовах так званої нестійкої рівноваги.
Звичайно, проектуючи ядерний реактор, вчені роблять все можливе за для того щоб його робота була безпечною. Однак, як засвідчив досвід Чорнобильської АЕС, не все і не завжди можна врахувати. Хтось щось відімкнув, хтось щось забув, хтось на щось понадіявся, і от результат – ядерна катастрофа. Катастрофа, яка з усією очевидністю засвідчила, що об’єкти атомної енергетики є надзвичайно небезпечними. Однак ця небезпечність не в тому що вони надмірно екологічно шкідливі. А в тому, що вони потенційно небезпечні об’єкти, в тому числі і екологічно небезпечні. А це означає, що проектуючи, будуючи та експлуатуючи об’єкти атомної енергетики, потрібно дотримуватись найжорстокіших норм технологічної дисципліни та техніки безпеки.
Існує велике різноманіття приладів за допомогою яких реєструють і досліджують іонізуючі випромінювання. При цьому найвідомішим та найпоширенішим з них є так званий лічильник Гейгера. Лічильник Гейгера (лічильник Гейгера-Мюллера) – це прилад, призначений для реєстрації частинок іонізуючого випромінювання (зазвичай гамма та бета випромінювання), принцип дії якого базується на здатності цього випромінювання іонізувати молекули газу (мал.196). Основним елементом лічильника Гейгера є іонізаційна камера, яка представляє собою герметичну трубку в якій знаходяться два електроди: внутрішня струмопровідна поверхня трубки – катод, та металева дротина – анод. Ці електроди перебувають під необхідно високою напругою та включені в коло електронного лічильного механізму. Принцип дії цієї системи полягає в наступному. При потраплянні частинки іонізуючого випромінювання всередину лічильника, ця частинка іонізує молекули наявного в лічильнику газу (зазвичай інертного). При цьому, в результаті ударної іонізації газу, між електродами проскакує іскровий імпульс, який і фіксується лічильним механізмом.
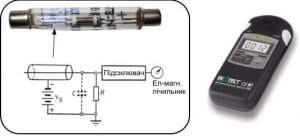
Мал.196. Схема загального устрою лічильника Гейгера.
Контрольні запитання.
- Що називають радіацією (іонізуючим випромінюванням)?
- Які види радіації ви знаєте?
- Які джерела радіації вам відомі?
- Що називають природним радіаційним фоном?
- Яке місце в спектрі природних джерел радіації займає радон? В чому небезпечність його радіоактивності?
- Що характеризує коефіцієнт біологічної ефективності випромінювання?
- Що характеризує поглинута доза випромінювання?
- Чим еквівалентна доза випромінювання відрізняється від поглинутої дози?
- У скільки разів та радіація яку отримує середньо статистичний житель Землі від джерел атомної енергетики менша ніж від а) природного радіаційного фону; б) медицини?
- В чому реальна і надумана небезпека атомної енергетики?
- Поясніть загальний устрій та принцип дії лічильника Гейгера.
.