
Розділ 6. Фізика атома та атомного ядра.
Тема 6.1. Фізика атома.
§44. З історії наукових поглядів на загальний устрій атома.
§45. Квантові числа, як метод наукового відображення внутрішнього устрою та властивостей атома. Періодична система хімічних елементів.
Тема 6.2. Фізика атомного ядра.
§46. Природна радіоактивність.
§47. Будова атомного ядра. Ізотопи.
§48. Ядерні сили.
§49. Енергія зв’язку та дефект маси атомного ядра.
§50. Термоядерні реакції. Енергія Сонця та зірок.
§51. Військове та цивільне застосування термоядерних реакцій.
§52. Види радіоактивного розпаду. Родини радіоактивних елементів.
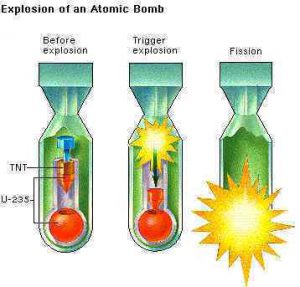
§53. Ядерні реакції поділу. Їх військове та цивільне застосування.
§54. Радіація: джерела, дози, ризики.
§55. Методи спостереження та реєстрації частинок іонізуючого випромінювання.
§56. Загальні відомості про елементарні частинки.
§57. Фундаментальні взаємодії.

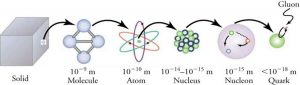
Тема 6.1. Фізика атома.
§44. З історії наукових поглядів на загальний устрій атома.
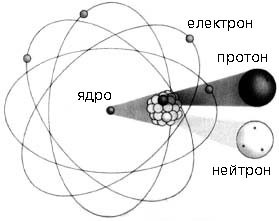
Про те, що всі речовини складаються з надзвичайно дрібненьких, неподільних частинок, давньогрецькі філософи і зокрема Демокріт (460–370 до н.е.) говорили та писали ще за 400 років до нашої ери. Ці частинки вони називали «атомами», що в буквальному перекладі означає «неподільні» (грец. atomos – неподільний). Якщо ж говорити про сучасну науку, то в ній відродження ідеї про атомарну будову речовини пов’язують з англійським вченим Джоном Дальтоном (1766–1844). На початку 19-го століття Дальтон сформулював основи своєї атомістичної теорії, у відповідності з якою:
– речовини складаються з дрібних неподільних частинок – атомів;
– усі атоми даного хімічного елемента однакові;
– атоми різних елементів мають різні маси;
– при утворенні сполук атоми об’єднуються в певних пропорціях.
Власне неподільними, атоми вважались до початку двадцятого століття. Лише в 1897 році відбулася подія, яка кардинально змінила історію атома. В цьому році, англійський фізик Джозеф Томсон (1856–1940), на основі аналізу багатьох експериментальних фактів, безумовно довів, що до складу будь якої речовини, а отже і до складу її атомів, входять дрібненькі, негативно заряджені частинки, які отримали назву електрони. Іншими словами, в 1897 було відкрито першу елементарну частинку – електрон (m=9,1·10–31кг; q0=e= –1,6·10–19Кл). При цьому стало ясно, що атом має певний внутрішній устрій. З’ясовуючи цей устрій, доречно сказати про те, а що ж власне знали вчені про атоми на початок 20-го століття. А знали вони наступне:
- Атоми – частинки електронейтральні, однак такі, що за певних умов можуть перетворюватись на позитивно чи негативно заряджені іони;
- Атоми – частинки стабільні та довговічні;
- При енергетичному збуджені, атоми випромінюють світло, при цьому кожна різновидність атомів дає свій неповторний лінійчатий спектр;
- До складу атомів входять електрони.
Аналізуючи вище наведені факти та спираючись на закони класичної фізики, Джозеф Томсон в 1902 році запропонував першу, науково обгрунтовану модель атома – модель Томсона. Згідно з цією моделлю, атом представляє собою кулю однорідної, позитивно зарядженої речовини, в якій міститься певна кількість легеньких, негативно заряджених електронів.
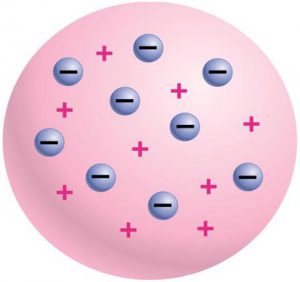
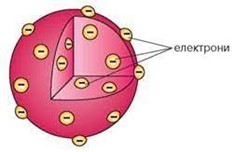
Мал.176. Схема загального устрою атома у відповідності з моделлю Томсона.
Модель Томсона цілком прийнятно (у всякому разі на якісному рівні) пояснювала всі відомі властивості атома. Дійсно. Згідно з цією моделлю, до складу атома входять електрони. За нормальних умов, атом Томсона є електронейтральним, тобто таким в якому загальний позитивний заряд кулястого тіла атома, в точності дорівнює загальному негативному заряду електронів. При цьому, втрачаючи або отримуючи електрони, атом легко перетворюється на відповідний іон. Атом Томсона представляє собою динамічно стійку та довговічну систему. Систему в якій електрони з одного боку взаємно відштовхуються, а з іншого – притягуються до центру атома тією силою яку створює його позитивно заряджене тіло. В такій ситуації, електрони автоматично розташовуються в тих місцях де діючі на них сили електростатичного притягування та відштовхування зрівноважують ода одну.
Крім цього, модель Томсона достатньо переконливо пояснювала механізм випромінювання світла та факт того, що кожна різновидність атомів дає свій неповторний лінійчатий спектр. Дійсно. Якщо атом знаходиться в енергетично незбудженому стані, то його електрони відносно нерухомі, а отже такі, що не створюють електромагнітних хвиль. При енергетичному ж збуджені, електрони починають здійснювати високочастотні коливання, які згідно з теорією Максвела створюють відповідні електромагнітні хвилі. А оскільки кожен атом має свої індивідуальні особливості, то відповідно індивідуальними є і частотні параметри коливань електронів, а отже і параметри того набору електромагнітних хвиль які випромінюються атомом.
Таким чином, запропонована Томсоном модель внутрішнього устрою атома, переконливо пояснювала всі його відомі властивості, і тому не безпідставно претендувала на загальне визнання. Однак наука стоїть на тому, що в ній критерієм істини є експеримент. А це означає, що в науці будь яка гіпотеза, в незалежності від того наскільки переконливою чи сумнівною вона виглядає, має бути експериментально перевіреною і відповідно підтвердженою чи спростованою. Яким же чином можна було перевірити внутрішній устрій атома в ті часи, коли сам факт існування атомів ще був під питанням? (Нагадаємо, що факт існування атомів (молекул) був безумовно доведений лише в 1908 році). Відповідь на це запитання дав англійський фізик Ернест Резерфорд (1871–1931).
В 1899 році, досліджуючи на передодні відкрите явище радіоактивності, Резерфорд експериментально встановив, що складовою частиною радіоактивного випромінювання є так зване α–випромінювання. При цьому він з’ясував, що α–випромінювання представляє собою потік швидких, масивних (m=4а.о.м.), позитивно заряджених (q0=+2е) частинок. Власне ці α-частинки Резерфорд і вирішив застосувати в якості того інструменту який дозволить дослідити внутрішній устрій атома. Ідея Резерфорда була гранично простою: якщо на шляху направленого потоку α-частинок поставити тонкий шар речовини, то при взаємодії з атомами цієї речовини, α-частинки будуть змінювати траєкторію свого руху. Аналізуючи ці зміни, можна зробити певний висновок щодо внутрішнього устрою атома.
В якості досліджуваної речовини, Резерфорд обрав золото. Такий вибір пояснювався двома обставинами. По перше, атоми золота є достатньо масивними (m=197а.о.м.), а отже такими які при взаємодії з α-частинкою (m=4а.о.м.) не будуть «відскакувати» від неї, та додатково не впливатимуть на траєкторію руху цієї частинки. По друге, Резерфорд розумів, що в умовах його експерименту, шар досліджуваної речовини має бути гранично тонким. Адже якщо шар речовини буде відносно товстим, то α-частинки багаторазово взаємодіючи з атомами речовини та багаторазово змінюючи траєкторію свого руху, «намалюють» певну усереднену картинку яка не відображатиме закономірностей внутрішнього устрою атома. А золото було саме тим матеріалом, який з незапам’ятних часів вміли виготовляти у вигляді надтонких плівок (плівок, товщина яких близька до одного мікрона, тобто до 0,001мм).
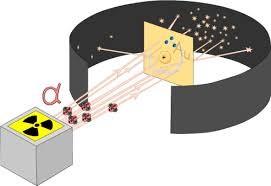
Реалізуючи свої ідеї, Резерфорд в 1906 році створює прилад для дослідження внутрішнього устрою атома (мал.177). Цей прилад представляє собою герметичний корпус в середині якого, в умовах глибокого вакууму знаходяться: контейнер з радіоактивною речовиною; тонкий шар золотої фольги; люмінісцируючий екран. Принцип дії цієї системи очевидно простий. З отвору радіоактивного контейнеру вилітають α-частинки. Пролітаючи через тонкий шар золота, вони певним чином взаємодіють з його атомами та потрапляють на люмінісцируючий екран. При цьому у відповідних точках екрану можна побачити певні світлові спалахи.
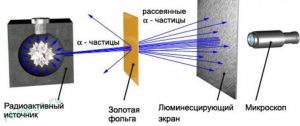
Мал.177. Схема та результати дослідів Резерфорда.
На які ж результати очікував Резерфорд виходячи з того, що модель Томсона є правильною? Перш за все Резерфорд розумів, що надлегкі електрони не можуть суттєво вплинути на поведінку масивних α-частинок (mα/me=7300). Ця поведінка визначальним чином залежатиме від взаємодії α-частинки з тією масивною, позитивно зарядженою речовиною яка утворює тіло атома. При цьому можливі три варіанти поведінки α-частинок. 1) Якщо густина тіла атома є гранично малою (умовно кажучи, тіло атома є «газоподібним»), то всі α-частинки практично безперешкодно пролітатимуть через атоми речовини та потраплятимуть в центр екрану. 2) Якщо густина тіла атому є помірно великою (умовно кажучи, тіло атома є «рідким»), то всі α-частинки в процесі проходження через це тіло будуть гальмуватися та відповідним чином розсіюватись. А це означає, що потік α-частинок на екрані утворить однорідну пляму, діаметр якої залежатиме від густини тіла атома (чим більша густина, тим більша площа плями). 3) Якщо ж густина тіла атома є гранично великою (умовно кажучи, тіло атома є «твердим»), то при взаємодії з цим тілом, всі α-частинки відбиватимуться від нього.
Таким чином, якщо виходити з того, що модель Томсона є правильною, то в залежності від густини тієї речовини яка утворює тіло атома, Резерфорд мав би отримати один з наступних результатів: 1) всі α-частинки потрапляють в центр екрану; 2) всі α-частинки рівномірно розсіюються по певній частині екрану; 3) всі α-частинки відбиваються від золотої фольги.
Які ж результати отримав Резерфорд в дійсності? А ці результати були наступними. Переважна більшість α-частинок пролітаючи через фольгу потрапляли в центральну частину екрану. Приблизно десять відсотків α-частинок, пролітаючи через фольгу суттєво відхилялись та розсіювались по екрану. Деякі ж α-частинок (приблизно одна на десять тисяч) відбивались від фольги так, ніби наштовхувались на масивну тверду перешкоду (мал.178). Дані результати безумовно вказували на те, що модель Томсона є неправильною. Ці результати можна було пояснити лише в тому випадку, якщо виходити з того, що в центрі атома знаходиться невелике за розміром, масивне, позитивно заряджене ядро.

Мал.178. Результати експериментів Резерфорда безумовно доводили, що в центрі атома знаходиться масивне, позитивно заряджене ядро.
Узагальнюючи результати багаторічних експериментальних досліджень, Резерфорд в 1911 році робить висновок: атом представляє собою електромеханічну систему, в центрі якої знаходиться масивне, позитивно заряджене ядро, навколо якого обертається певна кількість електронів. Запропоновану Резерфордом модель загального устрою атома, назвали планетарною моделлю атома.
Планетарна модель атома безумовно пояснювала результати дослідів Резерфорда і в цьому сенсі була безумовно достовірною. Однак, ця модель явно суперечила певним передбаченням теорії Максвела та деяким загально відомим експериментальним фактам. Дійсно. В планетарному атомі, електрон не може знаходитись в стані спокою. Адже з боку ядра на нього постійно діє певна електрична сила, яка прагне до того щоб електрон упав на ядро. Для того щоб не впасти на ядро, електрон повинен з певною швидкістю та відповідним доцентровим прискоренням (прискоренням для якого Fел=Fі) обертатись навколо нього. А обертаючись навколо ядра електрон, згідно з теорією Максвела, повинен випромінювати електромагнітну енергію. А випромінюючи цю енергію (втрачаючи енергію), електрон повинен наближатись до ядра та неминуче падати на нього. При цьому розрахунки показували, що тривалість життя планетарного атома не перевищує тисячних долей секунди. Експериментальні ж факти безумовно доводили, що атоми – частинки стабільні та довговічні.
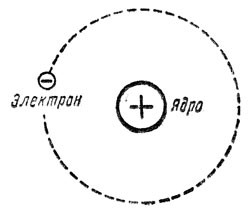
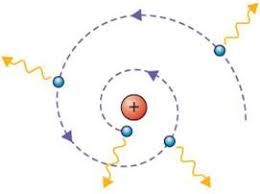
Мал.179. Планетарна модель атома, з одного боку була прямим наслідком експериментальних фактів, а з іншого – явно суперечила передбаченням теорії Максвела.
Таким чином, в фізиці виникла кризова ситуація: з одного боку, експериментальні факти безумовно доводили що планетарна модель атома є правильна. З іншого ж боку, експериментально підтверджена теорія Максвела наполягала на тому, що ця модель є не правильною. Вихід із цієї кризової ситуації запропонував данський фізик Нільс Бор. Бор розсудив так. 1) Якщо експериментальні факти безумовно доводять, що в центрі атома знаходиться масивне, позитивно заряджене ядро навколо якого обертається певна кількість електронів – значить, так воно і є. 2) Якщо експериментальні факти безумовно доводять, що в енергетично не збудженому стані, атом не випромінює світло – зачить, так воно і є. 3) Оскільки наші знання про суть тих процесів які відбуваються в атомі є досить поверхневими, то вирішення тих суперечностей які існують між планетарною моделлю атома та теорією Максвела, доцільно залишити на майбутнє.
Виходячи з такого розуміння суті проблеми, Бор враховував наступні факти. 1) Планетарна модель атома є експериментально підтвердженою і тому правильною. 2) Атом – частинка стабільна та довговічна. 3) При енергетичному збуджені, атоми випромінюють світло, при цьому кожна різновидність атомів дає свій неповторний лінійчастий спектр. 4) Енергетично не збуджені атоми, не випромінюють світло.
Розмірковуючи над даними фактами, та прагнучи поєднати їх в єдине ціле, Бор приходить до розуміння того, що той лінійчатий спектр який створює енергетично збуджений атом, є певним відображенням тих внутрішніх процесів які відбуваються в цьому атомі. Він усвідомлює, що квантові влавстивості світла, це закономірний наслідок квантової поведінки електрона в атомі. Зважаючи на ці обставини та кількісно аналізуючи закономірності спектру атома водню, Нільс Бор в 1913 році формулює свої знамениті постулати. (Нагадаємо, в фізиці постулатами називають ті базові твердження, достовірність яких приймається без теоретичного доведення.)
Постулати Бора:
- В атомі, електрони можуть знаходитись лише на певних, енергетично дозволених рівнях. 2. Перебуваючи на енергетично дозволеному рівні, електрон не випромінює світло. 3. При поглинанні зовнішньої енергії, електрон переходить на більш високий енергетичний рівень, а при падінні з цього рівня – випромінює відповідний квант світлової енергії.
Вище сказане означає, що згідно з теорією Бора, атом будь якої речовини представляє собою певну електро-механічну систему, яка складається з масивного, позитивно зарядженого ядра та легких, негативно заряджених електронів, і в якій електрони можуть знаходитись лише на певних, енергетично дозволених рівнях (стаціонарних орбітах). При цьому, за відсутності зовнішнього енергетичного збудження, електрони перебувають на найнижчих енергетично дозволених рівнях і не випромінюючи енергію, можуть перебувати на цих рівнях як завгодно довго. Поглинаючи зовнішню енергію, електрон перескакує на відповідний, більш високі енергетичний рівень. А падаючи з цього рівня – випромінює відповідний світловий фотон.

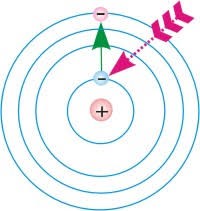
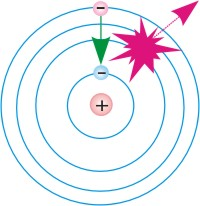
Мал.180. Схема загального устрою та «принципу дії» атома.
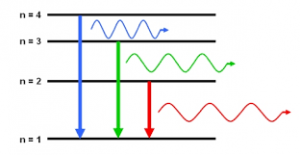
Теорія Бора пояснювала загальний устрій та «принцип дії» атома не лише на якісно–описовому рівні, а й на рівні точних кількісних розрахунків. Наприклад у відповідності з цією теорією, лінійчатий спектр атома водню є результатом переходу електрона з одного енергетично дозволеного рівня, на інший більш низький енергетично дозволений рівень. При цьому енергію електрона на енергетично дозволеному рівні n можна визначити за формулою Еn= E0/n2, де Е0=13,6еВ – енергія іонізації атома водню, тобто та мінімальна кількість енергії яку необхідно витратити на те, щоб електрон повністю відірвати від енергетично не збудженого атома водню. Зважаючи на вище сказане, можна записати: Е1=13,6/12=13,6еВ; Е2=13,6/22=3,40еВ; Е3=13,6/32=1,51еВ; Е4=13,6/42=0,85еВ; Е5=13,6/52=0,54еВ; Е6=13,6/62=0,38еВ; і т.д.
Коли ми стверджуємо, що на першому енергетичному рівні електрон має енергію Е1=13,60еВ, а на другому – Е2=3,40еВ, то це означає, що для переходу з рівня 1 на рівень 2 потрібна енергія ∆Е12= Е1 – Е2 = 10,20еВ. І навпаки, при переході з рівня 2 на рівень 1 виділяється 10,20еВ енергії. По суті це означає, що при переході електрона з рівня 2 на рівень 1 випромінюється фотон світла енергія якого ∆Е12= 10,20еВ = 10,20∙1,6∙10–19Дж, а отже фотон з довжиною хвилі λ12=hc/∆Е12 = 1,22∙10– 7м = 122нм.
Аналогічним чином можна визначити λ23=hc/∆Е23 =656нм; λ24=hc/∆Е24 =486нм; λ25=hc/∆Е25= 434нм; λ26=hc/∆Е26= 410нм. Не важко бачити, що довжини хвиль тих фотонів які випромінює водень в спектрі видимого світла (656нм; 486нм; 434нм; 410нм) в точності дорівнюють довжинам тих хвиль які у відповідності з теорією Бора має випромінювати цей атом при переході електрона з рівнів 3; 4; 5; 6 на рівень 2.
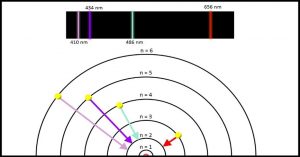
Мал.181. Довжини хвиль тих фотонів які випромінює водень в спектрі видимого світла (656нм; 486нм; 434нм; 410нм) дорівнюють довжинам тих хвиль які випромінює цей атом при переході електрона з рівнів 3; 4; 5; 6 ра рівень 2.
Експериментальні дослідження показують, що енергетично збуджені атоми водню випромінюють не лише певні фотони видимого світла, а й певні фотони світла невидимого, зокрема ультрафіолетового та інфрачервоного. Повний спектр тих фотонів які випромінюють атоми водню, прийнято розділяти на певні серії: серія Лаймана (фотони з довжинами хвиль 122нм; 103нм; 97нм; 94нм – ультрафіолетове випромінювання); серія Бальмера (фотони з довжинами хвиль 656нм; 486нм; 434нм; 410нм – видиме світло); серія Пашена (1875нм; 1282нм; 1094нм – інфрачервоне випромінювання). І не важко переконатися в тому, що параметри фотонів серії Лаймана в точності відповідають параметрам тих фотонів, які у відповідності з теорією Бора має випромінювати атом водню при переході його електронів з рівнів 2; 3; 4; 5; 6 на рівень 1. Фотони серії Бальмера відповідають переходам електронів з рівнів 3; 4; 5; 6 на рівень 2. А фотони серії Пашена відповідають переходам електронів з рівнів 4; 5; 6 на рівень 3.
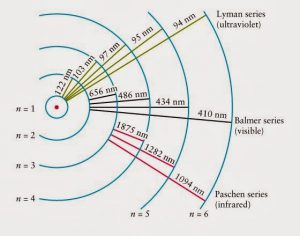
Мал.182. Схема яка пояснює наявне різноманітті електромагнітних хвиль в повному спектрі атома водню.
Теорія Бора практично ідеально пояснювала загальні властивості атома водню. Однак стосовно інших, більш складних атомів, кількісні передбачення цієї теорії експериментально не підтверджувались. Не підтверджувались по перше тому, що в багато електронних атомах, поведінка електронів визначально залежить не лише від їх взаємодії з атомним ядром, а й від всієї сукупності міжелектронних взаємодій. По друге, і це напевно головне, створюючи свою теорію, Бор використовував ті інструменти (закони класичної фізики) які добре пояснювали поведінку куль, автомобілів і планет, але були практично не придатними для пояснення поведінки електронів. Умовно кажучи, Бор намагався відремонтувати мініатюрний наручний годинник, тими інструментами які були призначеними для ремонту вантажного автомобіля.
Після 1913 року було зроблено декілька спроб удосконалити квантово–механічну теорію Бора. Зокрема було постульовано, що електрони в атомі можуть рухатись не лише круговими, а й еліптичними орбітами. Що параметри цих еліптичних орбіт, як і параметри орбіт кругових, підпорядковані певним квантовим обмеженням. Що кругові та еліптичні орбіти, можуть мати певну просторову орієнтацію і що кут цієї орієнтації також регулюється певними квантовими обмеженнями. Що електрони обертаються не лише навколо атомного ядра, а й навколо власної осі, і що момент імпульсу цього обертання не може бути довільним.
Ускладнена квантово-механічна теорія Бора, дозволила кількісно пояснити практично всі відомі властивості атома водню та водне подібних іонів (Не+; Lі++; Ве+++; тощо). Однак по мірі ускладнення, ця теорія втрачала свої головні чесноти: наочність та логічну простоту. До того ж, навіть гранично ускладнена квантово-механічна теорія не могла кількісно пояснити властивості складних багато електронних атомів.
Пройшли роки перш ніж вчені зрозуміли, що будь які спроби представити атом у вигляді наочної механічної моделі, приречені на провал. Приречені тому, що атом абсолютно не схожий на те, що нам коли небуть доводилось бачити. Приречені тому, що по відношенню до елементарних частинок, неприйнятні такі звичні для нас та класичної фізики поняття як частинка (кулька), відстань між частинками, траєкторія руху, радіус орбіти, тощо. Приречені тому, що поведінка елементарних частинок та їх систем, підпорядкована не законам класичної фізики, а законам квантової механіки. З’ясувавши ці закони, вчені створили сучасну квантову теорію атома.
Якщо ж говорити про ті протиріччя які виникли між планетарною моделлю атома та теорією Максвела, то після того як в середині 20-х років минулого століття були сформульовані базові закони квантової механіки, з’ясувалося, що ніяких протиріч не існує. А існує наше не правильне розуміння суті того, що називається електроном. Адже коли ми стверджували, що в процесі обертання навколо ядра, електрон повинен випромінювати світло, то мали на увазі, що електрон, це така маленька негативно заряджена кулька яка обертається навколо атомного ядра. І якби така кулька дійсно оберталась навколо ядра, то вона б дійсно випромінювала світло та неминуче падала на ядро. Однак електрон це не кулька, а певна елементарна частинка якій притаманні як корпускулярні так і хвильові властивості. При цьому в атомах речовини, електрон веде себе як певна хвиля, яка за відсутності енергетичного збудження і не повинна випромінювати світло.
Узагальнюючи історію наукових поглядів на загальний устрій атома, можна виділити наступні базові віхи: 1) З античних часів і до 1897 року, атоми вважались елементарними, тобто такими які не мають певного внутрішнього устрою і не складаються з більш простих частинок. 2) В 1897 році було відкрито першу дійсно елементарну частинку – електрон. А це означало, що атом має певний внутрішній устрій. 3) В 1911 році Резерфорд експериментально встановив, що в центрі атома знаходиться масивне, позитивно заряджене ядро, навколо якого обертається певна кількість електронів. 4) В 1913 році Бор в загальних рисах (якісно) пояснив «принцип дії» атома. 5) В 1924 році були сформульовані базові закони квантової механіки, на основі яких була створена теорія, яка кількісно пояснювала як загальний устрій так і «принцип дії» атома.
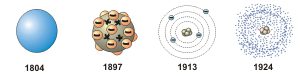
Мал.183. Еволюція наукових поглядів на загальний устрій атома.
Задача. Представляючи атом водню в вигляді електромеханічної системи, визначити з якою швидкістю має обертатися електрон навколо ядра, щоб не падати на нього? (Вважати що радіус орбіти електрона 0,55∙10–10м)

Рішення. Розглянемо ті сили які діють на електрон при його обертанні навколо ядра. А цими силами є: 1) доцентрова сила електричної взаємодії електрона (q1= –e = –1,6∙10–19Кл) з ядром (q2= +e = +1,6∙10–19Кл): Fел = k0∙e∙e/r2, де k0=9∙109(Н∙м2/Кл2), r=0,55∙10–10м – радіус орбіти електрона; 2) виникаюча в процесі обертання, а отже руху з доцентровим прискоренням ад = v2/r, відцентрова сила інерції: Fі = mea = mev2/r, де me=9,1∙10–31кг – маса електрона; (сила гравітаційної взаємодії електрона з атомним ядром є мізерно малою, тому її не враховуємо).
Оскільки електрон не падає на атомне ядро і не віддаляється від нього, то можна стверджувати, що Fел = Fі, а отже k0∙e2/r2 = mev2/r, звідси v = √(k0e2/rme) = √(9∙109∙(1,6∙10–19)2/0,55∙10–10∙9,1∙10–31) = √(4,6∙1012) = 2,1∙106(м/с).
Відповідь: v = 4,1∙106(м/с).
Контрольні запитання.
- Що було відомо про атоми на початок 20-го століття?
- Яка будова атома згідно з моделлю Томсона?
- Як модель Томсона пояснювала факт того, що кожна різновидність атомів дає свій лінійчатий спектр?
- Яка ідея лежала в основі дослідів Резерфорда?
- Які результати мав би отримати Резерфорд, якби модель Томсона була правильною?
- В чому суть протирічь між планетарною моделлю атома та теорією Максвела?
- Як сучасна фізика пояснює факт того, що обертаючись навколо ядра, електрон не випромінює світло?
- Поясніть загальний устрій та «принцип дії» атома (згідно з теорією Бора).
- Що називають енергією іонізації атома.
- Чому всі спроби вчених представити атом у вигляді наочної механічної моделі виявились марними?
Вправа 44.
- Відомо, що в атомі водню енергія електрона на 1, 2, 3, 4 та 5 енергетичних рівнях відповідно дорівнює 13,60еВ, 3,40еВ, 1,51еВ, 0,85еВ та 0,54еВ. Визначте ці енергії в джоулях.
- Фотон якої довжини хвилі випромінює атом водню при переході його електрона з четвертого енергетичного рівня (Е4=0,85еВ) на другий (Е2=3,40еВ)?
- В атомі водню при переході електрона з п’ятого енергетичного рівня на другий енергетичний рівень, випромінюється фотон з довжиною хвилі 434нм. Яка різниця енергій між другим та п’ятим енергетичними рівнями?
- На скільки змінюється енергія електрона в атомі водню, при випромінюванні фотона з довжиною хвилі 486нм?
- Скільки фотонів з різною енергією може випромінювати атом водню, якщо його електрон знаходиться на четвертому енергетичному рівні?
- При переході електрона з четвертого енергетичного рівня на третій, його енергія зменшується на 0,66еВ. Фотон якої довжини хвилі при цьому випромінюється?
- Для іонізації атома кисню потрібно 14еВ енергії. Яку довжину хвилі повинно мати те випромінювання яке здатне іонізувати атоми кисню?
- У скільки разів сила електричної взаємодії електрона з ядром атома водню, більша за силу їх гравітаційної взаємодії?
- Представляючи іон Не+ у вигляді електромеханічної системи, визначте з якою швидкістю має обертатися електрон навколо ядра іона гелію, щоб не падати на нього? (Вважати що радіус орбіти електрона 0,3∙10–10м).
.
§45. Квантові числа як спосіб відображення внутрішнього устрою та властивостей атома. Періодична система хімічних елементів.
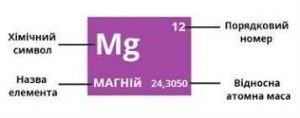
В 1869 році, російський хімік Дмитро Менделєєв (1834–1907) розташувавши 63 відомих на той час хімічних елементів в порядку зростання їх атомних мас, звернув увагу на певну періодичність (повторюваність) їх властивостей. Аналізуючи цю періодичність, Менделєєв створив першу, науково обгрунтовану систему хімічних елементів. Ця система констатувала факт того, що в наявному різноманітті атомів існує певний прядок, який характеризується певною повторюваністю їх хімічних властивостей. Однак, чому ця повторюваність існує? Від чого залежить кількість атомів в періоді? Чому ця кількість в різних періодах різна? Чому хімічні властивості атомів змінюються так а не інакше? На ці та їм подібні запитання, система Менделєєва не відповідала.
В 1913 році, вчені дійшли висновку: в періодичній системі хімічних елементів, порядковий номер атома фактично визначається не масою атома, а зарядом його ядра. При цьому виникало питання: чому монотонна зміна заряду атомного ядра призводить до періодичних змін властивостей атомів? Ясно, що причину періодичності фізико–хімічних властивостей атомів потрібно шукати не в самому ядрі, а в періодичності розташування тих електронів які його оточують.
В 1923 році, Нільс Бор теоретично обгрунтував, що в атомах речовини, електрони розташовуються певними шарами, і що періодичність хімічних властивостей атомів пояснюється наступним чином. В процесі послідовного заповнення певного електронного шару, хімічні властивості відповідних атомів поступово змінюються від хімічно активних (металічних) на початку періоду, до хімічно інертних в кінці періоду. Після того як попередній електронний шар заповнено, заповнюється наступний електронний шар. При цьому властивості відповідних атомів знову змінюються від хімічно активних до хімічно інертних. В загальних рисах, таке пояснення було правильним. Але воно ще не відображало тих кількісних закономірностей які притаманні періодичній системі хімічних елементів. Наприклад не пояснює, чому в першому періоді цієї системи міститься 2 хімічних елементи, в другому та третьому періодах – по 8 елементів, в четвертому та п’ятому – по 18, а в шостому – 32? Відповіді на ці та їм подібні запитання дає сучасна квантова теорія.
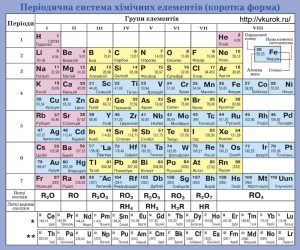
Мал.184. Періодична система хімічних елементів.
Пояснюючи закономірності розташування електронів в атомах речовини, а відповідно і закономірності хімічних властивостей цих атомів, потрібно бодай в декількох словах сказати про ту властивість електрона та інших елементарних частинок, яку позначають терміном спін (від англ. spin – обертання). Відразу ж зауважимо, що терміном «спін», позначають як певну властивість мікрочастинки, так і ту фізичну величину яка цю властивість характеризує. Крім цього, в науковій практиці спіном називають і те квантове число, яке ми будемо називати спіновим числом (s). Зважаючи на ці малоприємні обставини, строго визначати термін «спін» ми не будемо. Натомість стисло, пояснимо фізичну суть цього терміну.
Характеризуючи обертальний рух тіла, в механіці говорять про його момент імпульсу (L), величину яка дорівнює векторному добутку імпульсу тіла (p=mv) на радіус (r) того кола яке описує тіло в процесі свого обертального руху (L = p×r). При цьому розрізняють дві різновидності моменту імпульсу: орбітальний момент імпульсу та власний момент імпульсу. Наприклад, обертаючись навколо Сонця, Земля має певний орбітальний момент імпульсу. А обертаючись навколо своєї осі – певний власний момент імпульсу. Електрон не є тією маленькою кулькою що обертається навколо ядра. Однак, подібно до звичайної кульки, він має як орбітальний так і власний момент імпульсу. Цей власний момент імпульсу електрона і називають його спіном (позначається Ls).

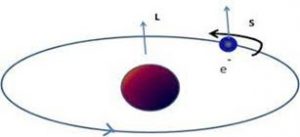
Мал.185. Подібно до того як обертаючись навколо Сонця, Земля має певний орбітальний момент імпудьсу, а обертаючись навколо власної осі – певний власний момент імпульсу, електрон також має як певний орбітальний момент імпульсу Lℓ, так і певний власний момент імпульсу Ls (спін).
Факт того що електрон має певний спін (власний момент імпульсу) іноді пояснюють тим, що подібно до дзиги, електрон обертається навколо своєї осі. Таке пояснення є досить умовним. Умовним бодай тому, що електрон не є тією маленькою однорідною кулькою яка обертається навколо власної осі. В реальності електрон, як власне і всі елементарні частинки, представляє собою цілісний згусток певних енергетичних процесів (коливань), які характеризуються певною масою (енергією), певним електричним зарядом та певним спіном (власним моментом імпульсу).
На відміну від власного моменту імпульсу дзиги, Землі чи будь якого іншого макрооб’єкту, спін елементарної частинки і зокрема електрона може мати лише певну, строго визначену величину: Ls = s(h/2π), де h=6,6310–34 – стала Планка, s – характерне для кожної елементарної частинки ціле або напівціле число, яке називається спіновим числом. Наприклад для електрона s= ±1/2, де знак « ± » вказує на те, що електрон може мати два діаметрально протилежних значення спіну. Умовно кажучи, електрон може обертатись або справа наліво, або навпаки – зліва направо.
Фактично спін є таким же базовим, невід’ємним параметром електрона як його маса та електричний заряд. Це означає, що електрон характеризується не лише строго визначеною масою спокою (m=9,1·10–31кг) та строго визначеним зарядом (e= –1,6·10–19Кл), а й строго визначеним спіном (Ls= ±0,5·10–34Дж·с).
Тепер, коли ви знаєте, що в атомі речовини, електрон має не лише певну енергію (Е), а й певний орбітальний момент імпульсу (Lℓ) та певний спін (Ls), можна стисло окреслити основи тієї теорії яка пояснює загальний устрій атома та закономірності його властивостей. А ці властивості визначальним чином залежать від закономірностей розподілу електронів в тілі атома. Досліджуючи ці закономірності, вчені з’ясували, що їх можна описати на основі чотирьох квантових величин, які прийнято називати квантовими числами:
1) головне квантове число n,
2) орбітальне квантове число ℓ,
3) магнітне квантове число m,
4) спінове квантове число s.
Потрібно зауважити, що квантові числа не є тими фізичними величинами які характеризують енергетичні, імпульсні чи інші параметри приналежних атому електронів. Квантові числа, це певні безрозмірні коефіцієнти (числа) за допомогою яких можна визначити відповідні параметри електрона в будь якому енергетично дозволеному місці атома.
Ви можете запитати: «А чому в атомах речовини, електрони розподілені таким чином, що їх енергетично–імпульсні параметри залежать від певного набору цілих чисел?”. Чесно кажучи, на це запитання ніхто (хіба що за винятком Творця) відповіді не знає. Вчені просто констатують факт того, що фізико–хімічні властивості атомів можна пояснити на основі певного набору квантових чисел.
Гранично стисло та спрощено пояснюючи фізичну суть квантових чисел, можна сказати наступне. Коли характеризують стан електрона в атомі, то перш за все говорять про його енергію. В загальному випадку, визначити величину цієї енергії досить складно. Адже потрібно враховувати не лише взаємодію електрона з атомним ядром, а й всю сукупність між електронних взаємодій. Втім, згідно з законами квантової механіки, енергія того електрона що є складовою частиною атома певним чином залежить від величини певного цілого числа, яке називається головним квантовим числом. Іншими словами, головне квантове число (позначається n), це безрозмірна величина, яка певним чином характеризує величину тієї енергії яку має електрон на тому чи іншому енергетично дозволеному рівні атома, і яка дорівнює порядковому номеру відповідного енергетичного рівня, тобто n = 1; 2; 3; 4; і т.д.
Дослідження показують, що в атомі речовини, кожен енергетично дозволений рівень складається з певного числа підрівнів. На цих підрівнях, електрони мають однакову кількість енергії але різні значення орбітального моменту імпульсу. Ці значення залежать від величини певного цілого числа яке називається орбітальним квантовим числом. Іншими словами, орбітальне квантове число (позначається ℓ), це безрозмірна величина яка характеризує орбітальний момент імпульсу електрона. Для заданого головного квантового числа n, орбітальне квантове число ℓ може мати будь яке ціле значення з інтервалу від 0 до (n–1). Наприклад, якщо n=1, то орбітальне квантове число ℓ має одне значення: ℓ=0; якщо n=2, то ℓ має два значення: ℓ=0; ℓ=1; якщо n=3, то ℓ має три значення: ℓ=0; ℓ=1; ℓ=2, і т.д.
Далі. В межах одного і того ж енергетичного підрівня, тобто для одних і тих же значень квантових чисел n і ℓ, параметри електронів можуть відрізнятися кутовою орієнтацією вектора орбітального моменту імпульсу. Цю орієнтацію характеризує магнітне квантове число. Іншими словами, магнітне квантове число (позначається m), це безрозмірна величина яка характеризує кутову орієнтацію вектора орбітального моменту імпульсу відповідного електрона. Для даного значення квантового числа ℓ, магнітне квантове число m може дорівнювати будь якому цілому числу з інтервалу (–ℓ; +ℓ). Наприклад, якщо ℓ=0, то m може мати лише одне значення: m=0; якщо ℓ=1, то m може мати три значення: –1; 0; 1; якщо ℓ=2, то m може мати п’ять значень:–2; –1; 0; 1; 2; і т.д. Не важко бачити, що магнітне квантове число m, може мати 2ℓ+1 значень.
Нарешті, в межах одного і того ж енергетичного підрівня, електрони відрізняються не лише за величиною магнітного квантового числа (m), а й за величиною спінового квантового числа, яке характеризує власний момент імпульсу (спін) відповідного електрона. Іншими словами, спінове квантове число (позначається s), це безрозмірна величина яка певним чином характеризує власний момент імпульсу (спін) відповідного електрона. Спінове квантове число може мати лише два значення: s = –1/2; s=+1/2.
В 1925 році швейцарський фізик Вольфганг Паулі сформулював один з базових законів квантової механіки – принцип Паулі. В цьому законі стверджується: в атомі не може бути двох електронів з однаковим набором квантових чисел. Керуючись принципом Паулі та знаючи фізичну суть квантових чисел, можна пояснити закономірності періодичної системи хімічних елементів. І це пояснення є наступним.
Загальна кількість електронів в електронейтральному атомі визначається зарядом його ядра (порядковим номером атома). Наприклад якщо заряд атомного ядра +1, то відповідний атом матиме один електрон, якщо заряд ядра +26, то відповідний атом матиме 26 електронів, якщо заряд ядра +82, то відповідний атом матиме 82 електрони і т.д. При цьому розташування електронів в атомі, а відповідно і його хімічні властивості регулюються законами квантової механіки.
У відповідності ж з цими законами, в атомі речовини енергетичні параметри електрона визначаються його головним квантовим числом n. По суті це означає, що ті електрони головне квантове число яких однакове, мають однакову кількість енергії і тому знаходяться на одному і тому ж енергетичному рівні. Кількість енергетичних рівнів в атомі визначає номер того періоду в якому знаходиться цей атом. Наприклад, ті атоми, електрони яких розташовуються на першому енергетичному рівні (n=1), утворюють перший період таблиці хімічних елементів. Ті атоми, електрони яких розташовуються на першому та другому енергетичних рівнях (n=1; n=2), утворюють другий період таблиці. Ті атоми, електрони яких розташовані на першому, другому та третьому енергетичних рівнях (n=1; n=2; n=3), утворюють третій період, і т.д.
У відповідності з законами квантової механіки, кожен енергетичний рівень складається з певної кількості підрівнів. При цьому, число цих підрівнів визначається кількістю значень орбітального квантового числа ℓ. Наприклад, перший енергетичний рівень атома (n=1), має лише один підрівень (ℓ=0, або ℓ=s). Другий енергетичний рівень атома (n=2), має два підрівні (ℓ=0; ℓ=1, або ℓ=s; ℓ=p). Третій енергетичний рівень атома (n=3), має три підрівні (ℓ=0; ℓ=1; ℓ=2, або ℓ=s; ℓ=p; ℓ=d). І т.д. Потрібно зауважити, що в науковій практиці, величину орбітального квантового числа ℓ позначають не цифрами (ℓ=0;1;2;3;…), а їм відповідними буквами (ℓ=s;p;d;f;…).
Далі. У відповідності з законами квантової механіки, кількість електронів на тому чи іншому підрівні, визначається кількістю значень магнітного (m) та спінового (s) квантових чисел. А оскільки для заданого числа ℓ, магнітне число може набувати (2ℓ+1) значень, кожному з яких відповідає два значення спінового числа, то можна стверджувати, що на кожному енергетичному підрівні може знаходитись до 2(2ℓ+1) електронів. Наприклад, на підрівнях 1s; 2s; 3s; 4s; 5s; …(ℓ=0) може знаходитись 2(0+1)=2 електрони. На підрівнях 2р; 3р; 4р; 5p; …(ℓ=1) може знаходитись 2(2∙1+1)=6 електронів. На підрівнях 3d; 4d; 5d;…(ℓ=2) може знаходитись 2(2∙2+1)=10 електронів. На підрівнях 4ƒ; 5ƒ;…(ℓ=3) може знаходитись 2(2∙3+1)=14 електронів. І т.д.
Узагальнюючи вище сказане, можна зробити наступні передбачення.
- Перший період системи хімічних елементів, мають утворювати ті атоми, електрони яких знаходяться на першому енергетичному рівні (n=1). І таких атомів має бути два (2): Н; Не.
- Другий період системи хімічних елементів, мають утворювати ті атоми, електрони яких знаходяться на першому та другому енергетичних рівнях (n=1; n=2). І таких атомів має бути вісім (2+6=8): Li; Be; B; C; N; O; F; Ne.
- Третій період системи хімічних елементів, мають утворювати ті атоми, електрони яких знаходяться на першому, другому та третьому енергетичних рівнях (n=1; n=2; n=3). І таких атомів має бути вісімнадцять (2+6+10=18).
- Четвертий період системи хімічних елементів, мають утворювати ті атоми, електрони яких знаходяться на першому, другому, третьому та четвертому енергетичних рівнях (n=1; n=2; n=3; n=4). І таких атомів має бути тридцять два (2+6+10+14=32).
«Стоп! Стоп! – скажете ви. Ваша теорія не співпадає з реальністю. Адже в третьому періоді таблиці хімічних елементів налічується не 18, а лише 8 різновидностей атомів. А в четвертому періоді – не 32, а лише 18». Пояснюючи даний факт можна сказати наступне. Вище наведена послідовність формування періодів, енергетичних рівнів та підрівнів, є гранично спрощеною і такою, що не враховує інших важливих обставин. Наприклад не враховує факт того, що по мірі накопичення електронів в атомі речовини, вплив міжелектронних взаємодій стає все більшим і більшим, і що тому енергія тих електронів які знаходяться на підрівні 3d, суттєво більша за енергію тих електронів які знаходяться на підрівні 4s. А це означає, що у відповідності з принципом мінімуму (будь яка системи прагне до того, щоб кількість зосередженої в ній енергії була мінімально можливою) спочатку буде заповнюватись підрівень 4s (два хімічних елементи: К, Са), тобто той енергетичний підрівень яким починається четвертий період (n=4) таблиці елементів, а лише після цього заповнюється підрівень 3d (вісім хімічних елементів: Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn), підрівень, який формально мав би належати третьому періоду (n=3), але в реальності є складовою частиною четвертого періоду. Після підрівня 3d заповнюється підрівень 4р (шість хімічних елементів: Ga, Ge, As, Se, Br, Kr), який і завершує четвертий період таблиці хімічних елементів.
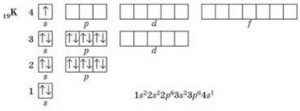
Мал.186. Розподіл електронів в атомі речовини є прямим наслідком дії законів квантової фізики.
Якщо ж говорити про енергетичні підрівні 4d і 4f, підрівні які формально мають належати четвертому періоду, то у повній відповідності з законами квантової механіки і зокрема принципу мінімуму, підрівень 4d заповнюється після підрівня 5s і тому є частиною п’ятого періоду, а підрівень 4f заповнюється після підрівня 6s і тому у вигляді так званих лантаноїдів стає частиною шостого періоду таблиці хімічних елементів.
Закони квантової фізики пояснюють не лише порядок формування періодичної системи хімічних елементів, та закономірності хімічних властивостей цих елементів, а й ті нюанси властивостей речовин, які не є предметом вивчення хімії. Наприклад пояснюють природу феромагнітних властивостей заліза, кобальту та нікелю, пояснюють природу надпровідності, надплинності, тощо.
Ми не будемо вдаватися в деталі того, як заповнюються енергетичні рівні та підрівні атома. Не будемо аналізувати той зв’язок який існує між внутрішнім устроєм атома та його хімічними властивостями. Не будемо аналізувати закономірну періодичність цих властивостей. А тим більше, не будемо заглиблюватись в деталі тих пояснень які дає сучасна квантова фізика стосовно пра-, діа- та феро- магнетизму, стосовно надпровідності, надплинності, тощо. Ми просто зауважимо, що всі хімічні та фізичні властивості атомів та їх систем є закономірним результатом дії законів квантової фізики.
Контрольні запитання.
1.Від чого залежить кількість електронів в електронейтральному атомі?
2.Як змінюються хімічні властивості атомів в межах одного і того ж періоду?
3. Чим відрізняється орбітальний момент імпульсу від власного моменту імпульсу?
4. Відомо, що електрон має власний момент імпульсу, чи означає цей факт, що електрон обертається навколо своєї осі? Чому?
5. Що характеризує головне квантове число?
6. Що характеризує орбітальне квантове число?
7. Що характеризує магнітне квантове число?
8. Що характеризує спінове квантове число?
9. Що стверджує принцип Паулі?
10. Чому в третьому періоді міститься не 18, а лише 8 хімічних елемента?
11. Що стверджує принципу мінімуму?

Тема 6.2. Фізика атомного ядра.
§46. Природна радіоактивність.
В 1896 році, французький фізик Анрі Беккерель (1852–1908) експериментально встановив, що уран, постійно та без явних енергетичних причин, випромінює якесь невідоме проміння з великою енергією та проникливою здатністю. Це явище назвали радіоактивністю тобто променевою активністю (від лат. radio – промінь, activus – активний, діяльний).
Відкриття Беккереля шокувало науковий світ. Шокувало тому, що одним з базових постулатів науки є закон збереження енергії. А наука стоїть на тому, що будь який фундаментальний закон (принцип) можна спростувати одним єдиним експериментальним фактом, що суперечить цьому закону. І от знайшовся експериментальний факт, який явно суперечив закону збереження енергії. Адже уран, постійно і без видимих енергетичних причин випромінював велику кількість енергії. Звичайно, потім з’ясувалося, що ніякого протиріччя з законом збереження енергії не існує. Просто, коли в надрах надмасивних зірок утворювались ядра урану, їм було надано таку величезну кількість надлишкової енергії, яка і через мільярди років продовжує поступово випромінюватись. Втім, це стане зрозумілим лише через багато десятиліть. В кінці ж дев’ятнадцятого століття, ситуація виглядала таким чином, ніби було відкрито явище, яке явно суперечило базовому принципу науки – закону збереження енергії. Ясно, що в такій ситуації, велика кількість провідних науковців зацікавились даним явищем.
В 1898 році, французькі фізики П’єр Кюрі та його дружина Марія Складовська–Кюрі з’ясували, що радіоактивним є не лише уран (U92), а й торій (Th90). Більше того, в тому ж 1898 році, вони відкрили два нових, до того часу не відомих хімічних елемента, які були радіоактивними. Один з цих елементів назвали полонієм Ро84 (на честь Польщі – батьківщини Марії Складовської–Кюрі), інший – радієм Ra88 (за назвою того явища, яке дозволило зробити дане відкриття).
В 1899 році, англійський фізик Резерфорд, експериментально встановив, що при проходженні через потужне магнітне поле, «уранові промені» розкладаються на три складові: α-промені, β-промені, γ-промені (мал.188). Подальші дослідження показали, що альфа–проміння представляє собою потік швидких (v≈5·103м/с), масивних (m=4а.о.м.), позитивно заряджених (q= +2е) α-частинок, а по суті – ядер атома гелію (4α+2 = 4Не+2). Бета–проміння, представляє собою потік надзвичайно швидких (v≈5·105м/с), надлегких (m=0,0005а.о.м.), негативно заряджених (q= –е) β-частинок, а по суті – електронів (0β–1 = 0е–1). Гама–проміння, представляє собою потік надзвичайно коротких (λ˂10–11м) та енергійних (Е˃105еВ) фотонів невидимого світла.
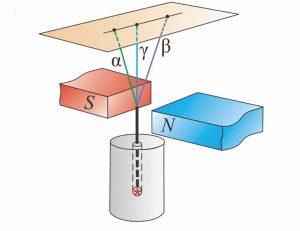

Мал.188. Схема дослідів Резерфорда: в магнітних (а) та електричних (б) полях «уранове проміння» розкладається на три складові.
В 1902 році Резерфорд, разом з англійським фізиком Фредеріком Содді (1877–1956) експериментально довели, що з плином часу, в хімічно чистому шматку урану (U92) неминуче з’являється інший хімічний елемент – радій (Ra88). Виходячи з цього, вони розробили першу науково обгрунтовану теорію радіоактивності. Згідно з цією теорією, радіоактивне випромінювання є результатом самовільного природного процесу, при якому атом однієї речовини випромінюючи α або β частинку, перетворюється на атом іншої речовини. В загальних рисах, теорія Содді–Резерфорда є правильною. Однак потрібно мати на увазі, що радіоактивне перетворення атомів є результатом відповідного перетворення атомних ядер. Адже альфа та бета частинки вилітають не просто з атома, а з атомного ядра. Зазвичай радіоактивні атоми, а точніше радіоактивні ядра атомів називають радіонуклідами (від лат. nucleus – ядро).
Однією з основних кількісних характеристик радіоактивності речовини є період її напіврозпаду. Періодом напіврозпаду радіоактивної речовини називають той проміжок часу протягом якого половина наявних атомів (радіонуклідів) даної речовини розпадається, тобто перетворюється на атоми (радіонукліди) іншої речовини (позначається Т). Період напіврозпаду речовини визначається експериментально і записується у відповідну таблицю, наприклад таку:
| Радіонуклід | Період напіврозпаду, Т | Радіонуклід | Період напіврозпаду, Т |
| Йод-131 | 8 діб | Радій-226 | 1620 років |
| Карбон-14 | 5700 років | Радон-222 | 3,8 доби |
| Кобальт-60 | 5,3 років | Радон-220 | 56 с |
| Плутоній-239 | 24 тис. років | Уран-235 | 0,7 млрд. років |
| Полоній-210 | 138 днів | Уран-238 | 4,5 млрд. років |
| Полоній-218 | 3 хв. | Цезій-137 | 30 років |
Потрібно зауважити, що знаючи величину періоду напіврозпаду речовини, не можливо визначити в який момент часу розпадеться даний радіоактивний атом. Ця подія може відбутися в дану мить, а може не відбутися і через мільйон років. Говорячи про період напіврозпаду речовини, мають на увазі лише те, що за наявності достатньо великої кількості атомів цієї речовини, наприклад такої що міститься в одному грамі, міліграмі чи навіть мікрограмі речовини, за певний проміжок часу розпадеться половина цих атомів. Однак, в який момент розпадеться той чи інший конкретний атом не можливо сказати навіть в принципі. Не можливо тому, що ті процеси які відбуваються в атомному ядрі, відбуваються з певною ймовірністю.
Зважаючи на вище сказане, не правильно стверджувати, що якщо в певному місці є 100, чи скажімо 1000 атомів радію-226 (Т=1620 років), то через 1620 років цих атомів залишиться 50 чи 500. Мова йде лише про те, що якщо в певному місці є величезна кількість атомів радію-226, наприклад стільки, скільки їх міститься в 1 грамі радію-226, то через 1620 років в цьому місці залишиться лише 0,5г радію, через наступні 1620 років, радію залишиться 0,25г, ще через 1620 років – 0,125г, і т.д. При цьому інша частина радію перетвориться в атоми іншої речовини.
Оскільки, за той проміжок часу який дорівнює періоду напіврозпаду речовини (t=Т), кількість радіонуклідів зменшується вдвічі (N=N0/2), за наступний такий же проміжок часу – ще вдвічі (N=N0/22), і т.д., то через певну кількість таких періодів (n=t/T) ця кількість становитиме N = N0/2n = N0/2t/T, де N0 – початкова кількість радіонуклідів, N – кількість цих радіонуклідів через час t, Т – період напіврозпаду даних радіонуклідів (даної речовини). І можна довести, що формула N = N0/2t/T, справедливі для довільних, в тому числі не цілих значень співвідношення t/T. Наприклад, якщо N0= 5∙1020; Т=1620р; t=10000р; (n=t/T=6,17), то N = 5∙1020/26,17 = 0,07∙1020. Зазвичай формулу N = N0/2t/T називають законом радіоактивного розпаду.
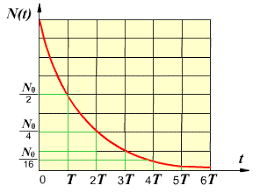
Мал.189. Графічне відображення закону радіоактивного розпаду.
Зважаючи на те, що між масою речовини (m) та кількістю атомів в ній (N) існує прямий зв’язок (m=m0N, де m0 – маса одного атома даної речовини), закон радіоактивного розпаду можна записати у вигляді m = m0/2t/T, де m0 – початкова маса речовини, m – маса цієї речовини через час t.
Дослідження показують, що період напіврозпаду речовини, практично не залежить ні від кількості цієї речовини, ні від тих зовнішніх умов в яких вона знаходиться (температури, тиску, вологості повітря, тощо), ні від хімічного складу тих сполук, частиною яких є атоми відповідної речовини. І це закономірно. Адже радіоактивність є результатом тих процесів які відбуваються в атомному ядрі, тобто в тій частині атома, яка практично повністю ізольована від тих подій що відбуваються в навколишньому світі. Звичайно за умови, що ці події не стосуються самого атомного ядра. Адже якщо наприклад, ви нагрієте речовину до мільйонів градусів, то в процесі теплового руху фактично будуть взаємодіяти не атоми, а їх ядра. І такі взаємодії можуть суттєво впливати на період напіврозпаду речовини.
Період напіврозпаду речовини певним чином характеризує питому інтенсивність її радіоактивного розпаду. Скажімо радій (Т=1620 років) розпадається набагато інтенсивніше за уран (Т=4,5·109років) і тому є відповідно більш радіоактивним. Однак, якщо говорити про активність певного радіоактивного джерела (певного тіла), то вона залежить не лише від питомої радіоактивності відповідної речовини, а й від кількості цієї речовини в даному джерелі (тілі). Адже абсолютно очевидно, що за однакові проміжки часу, в одному грамі радіоактивної речовини, кількість розпадів буде в тисячу разів меншою ніж в кілограмі цієї речовини.
Величину яку чисельно дорівнює кількості розпадів, що відбуваються в радіоактивному джерелі за одиницю часу, називають активністю радіоактивного джерела (позначається А). Активність радіоактивного джерела вимірюють в бекерелях (Бк). Бекерель (Бк) – це одиниця вимірювання активності радіоактивного джерела, яка дорівнює активності такого радіоактивного тіла в якому за одну секунду відбувається один радіоактивний розпад: Бк = 1розп/с = 1/с = с–1.
Позасистемною одиницею вимірювання активності радіоактивного джерела, є кюрі (Кі). За визначенням активність в один кюрі дорівнює тій кількості радіоактивних розпадів що відбувається в одному грамі радію за одну секунду. А таких розпадів 37·109. Іншими словами: 1Кі = 37·109розпадів/с = 37·109 Бк.
Оскільки з плином часу кількість радіонуклідів в речовині зменшується, то відповідно зменшується і радіаційна активність джерела. При цьому можна довести, що закон цього зменшення має вигляд А = λN, де N – кількість радіонуклідів на даний момент, λ = ℓn2/T = 0,693/T – величина яку часто називають сталою радіоактивного розпаду радіонукліда.
Якщо той проміжок часу (t) за який визначається кількість радіоактивних розпадів (∆N) набагато менший за період напіврозпаду відповідної речовини (t<<T), то кількість цих розпадів визначають за спрощеною формулою ∆N = (0,693/T)N0t.
На завершення додамо, що період напіврозпаду речовини (Т) не потрібно ототожнювати з середньостатистичною тривалістю життя її атомів (tсер). Ці величини є суттєво різними. Однак можна довести, що між періодом напіврозпаду речовини та середньостатистичною тривалістю життя її атомів, існує просте співвідношення: tсер = T/ℓn2 = T/0,693 = 1,44T. Оскільки tсер = T/ℓn2, а λ= ℓn2/T, то ясно, що стала радіоактивного розпаду (λ) даного радіонукліда, є величиною оберненою до середньостатистичної тривалості життя цього радіонукліда λ = 1/tсер, і навпаки tсер= 1/λ.
Задача 1. За 11,4 доби кількість атомів певної радіоактивної речовини зменшилась у 8 разів. Визначити період напіврозпаду цієї речовини.
Дано:
t = 11,4 доби
N0/N = 8
Т = ?
Рішення. Згідно з законом радіоактивного розпаду N=N0/2t/T, звідси N0/N = 2t/T = 8 = 23, звідси t/T = 3, звідси T = t/3 = 11,4доби/3 = 3,8 доби.
Відповідь: Т = 3,8 доби.
Задача 2. На даний момент є 25∙109 атомів радію (Т=1620 років). Скільки цих атомів розпадеться за добу?
Дано:
N0 = 25∙109
T = 1620 років = 1620∙365 діб
t = 1 доба
∆N = ?
Рішення. Оскільки в умовах нашої задачі t<<T, то кількість розпадів за одну добу можна визначити за формулою ∆N = (0,693/T)N0t = 0,693∙ 25∙109∙1/1620∙365 = 3∙104 атомів.
Відповідь: ∆N = 3∙104 атомів.
Задача 3. В свинцевій капсулі міститься 1г радію-226. Визначити радіаційну активність цього радію.
Дано:
m(Ra) = 1г
A =?
Рішення. Радіаційна активність наявного джерела визначається за формулою А = λN = (0,693/Т)N. В умовах нашої задачі Т(Ra) = 1620 років = 5,1∙1010(с) – таблична величина. Кількість атомів в 1г радію, можна визначити за базовою формулою N = (m/M)NA, де M(Ra) = 226 (г/моль) – молярна маса радію (таблична величина), NA = 6,021023(1/моль) – стала Авогадро. Таким чином, А = (0,693/Т)N = 0,693∙m∙NA/M∙T.
Розрахунки: А = 0,693∙m∙NA/M∙T = 0,693∙1г∙6,021023(1/моль)/226(г/моль)∙ 5,1∙1010(с) = 3,7∙1010(Бк) = 1(Кі)
Відповідь: А = 3,7∙1010(Бк) = 1(Кі).
Контрольні запитання.
- Чому явище радіоактивності шокувало наукову громадськість?
- Чи суперечить явище радіоактивності закону збереження енергії?
- Що представляє собою α, β, γ – випромінювання?
- На основі аналізу мал.188а та знань про силу Лоренца і правило лівої руки, визначте заряд альфа та бета частинок.
- Чи можна за відомим періодом напіврозпаду речовини, визначити момент розпаду конкретного атома? Чому?
- Від чого залежить та як визначається період напіврозпаду речовини?
- Що стверджується в законі радіоактивного розпаду?
- Що називають активністю радіоактивного джерела? Від чого залежить ця активність?
- Що фактично характеризує стала радіоактивного розпаду?
Вправа 46.
1.За 810 діб маса радіоактивного срібла зменшилась у 8 разів. Визначити період напіврозпаду цього срібла.
2.Скільки радіоактивного йоду залишиться через 40 діб, якщо його маса 200г, а період напіврозпаду 8 діб?
- Період напіврозпаду радію 1620 років. Визначте постійну радіоактивного розпаду радію та середню тривалість життя його атомів.
- На даний момент є 20∙109 атомів урану-238 (Т=4,5∙109 років). Скільки цих атомів розпадеться за добу?
- Скільки розпадів ядер за хвилину відбувається в препараті, активність якого 105Бк? Якою є ця активність виміряною в кюрі?
- Визначте радіаційну активність 1г урану-235, якщо період його напіврозпаду 0,7∙109 років.
- Порівняйте радіаційну активність 1г урану-238 (Т= 4,5∙109 років) з радіаційною активністю 1г полонію-210 (Т=138днів).
- Визначте радіаційну активність 0,15 моль полонію-239, якщо період його напіврозпаду 24,4∙103 років.
- Яка частина атомів радіоактивного кобальту-58 розпадеться за 20 діб, якщо період його напіврозпаду 70 діб?
.
§47. Будова атомного ядра. Ізотопи.
Після того як в 1911році Резерфорд з’ясував, що в центрі атома знаходиться маленьке за розміром, масивне, позитивно заряджене ядро, практично відразу ж постало питання про внутрішній устрій цього ядра. А про те, що ядро має певний внутрішній устрій, з усією очевидністю говорило явище природної радіоактивності. Адже факт того, що в процесі радіоактивного розпаду атомів, випромінюються альфа та бета частинки, безумовно вказував на те, що ці частинки вилітають саме з атомного ядра.
Однак, як зазирнути всередину атомного ядра? Як довести, що воно складається з тих чи інших частинок? Адже мова йде про об’єкт, діаметр якого приблизно в 5000 разів менший за діаметр атома. Об’єкт, який займає лише декілька трильйонних частин об’єму атома.
Цілком закономірно, що проблемою з’ясування внутрішнього устрою атомного ядра зайнявся Резерфорд. Адже досліджуючи внутрішній устрій атома, Резерфорд бачив, що деякі α-частинки, наштовхувались на атомні ядра та відскакували від них (мал.190). Тому він, цілком слушно вирішив: якщо різні речовини опромінювати α-частинками, то є ймовірність того, що вони бодай з деяких ядер, вибиватимуть їх складові елементи. При цьому на люмінесцентному екрані приладу будуть зафіксовані відповідні спалахи.
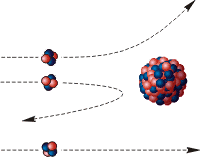
Мал.190. Про суть та результати дослідів Резерфорда.
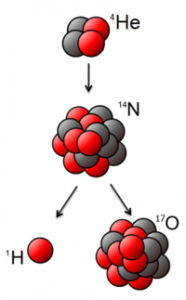
Реалізуючи дану ідею, Резерфорд в 1919 році з’ясував, що в процесі опромінювання азоту α-частинками, з’являються атоми кисню та якісь невідомі, позитивно заряджені частинки. Ці частинки назвали протонами 1р+1 (m=1а.о.м. ; q = +1е). Здійснену Резерфордом ядерну реакцію можна записати у вигляді: 14N+7 + 4α+2 → 17O+8 + 1p+1 .
Подібні реакції часто називають реакцією розщеплення атомного ядра. Така назва не є надто вдалою. Адже при взаємодії з α-частинкою, ядро атома фактично не розщеплюється, а перетворюється на більш масивне та більш складне. Та як би там не було, а фактом залишається те, що в 1919 році Резерфорд здійснив першу штучну ядерну реакцію (реакцію розщеплення атомного ядра), в результаті якої була відкрита друга елементарна частинка – протон.
Таким чином, на 1919 рік в розпорядженні вчених було дві елементарні частинки: електрон (m=0а.о.м.; q= –1е) та протон (m=1а.о.м.; q= +1е). Виходячи з цього, в тому ж 1919 році, Резерфорд запропонував першу науково обгрунтовану протонно–електронну модель атомного ядра. Згідно з цією моделлю, атомні ядра складаються з протонів та електронів. При цьому, кількість протонів дорівнює масовому числу ядра (М), а кількість електронів – різниці між масовим (М) та зарядовим (Z) числом (порядковим номером атома). Іншими словами: Np = M; Ne = M – Z. Наприклад, згідно з протонно–електронною моделлю, ядро атома урану 238U+92 складається з 238 протонів та 238–92=146 електронів.

Мал.191. В 1919 році Резерфорд запропонував протонно–електронну модель атомного ядра.
Протонно–електронна модель, більш менш задовільно пояснювала загальні властивості атомного ядра. Зокрема пояснювала, яким чином протони та електрони об’єднуються в цілісну структуру: за певного розташування, позитивно заряджені протони та негативно заряджені електрони, під дією сил електростатичного притягування утворюють цілісне атомне ядро. Пояснювала механізм випромінювання α частинок: за певних умов чотири протони об’єднуються з двома електронами і під дією сил електричного відштовхування вилітають за межі атомного ядра.
Однак, після того, як всередині 20-х років були сформульовані закони квантової механіки, з’ясувалося, що згідно з цими законами, такі надлегкі частинки як електрони, не можуть знаходитись в таких над малих об’ємах як об’єм атомного ядра. Виходячи з цього, було теоретично передбачено, що в Природі, окрім протонів та електронів, має існувати ще одна елементарна частинка. Частинка, дуже схожа на протон, але не заряджена (електронейтральна). Цю частинку назвали нейтроном.
Дане теоретичне передбачення було підтверджене учнем Резерфорда, англійським фізиком Джеймсом Чедвіком (1891–1974). В 1932 році, Чедвік здійснив ядерну реакцію, одним з продуктів якої був нейтрон 1n0 (m=1а.о.м.; q=0): 9Ве+4 + 4α+2 → 12С+6 + 1n0. Потрібно зауважити, що експерименти в яких фіксували нейтронне випромінювання, проводились і раніше. Однак спочатку це випромінювання ідентифікували як потік потужних гама–квантів. Чедвік же довів, що це нове потужне випромінювання представляє собою потік електронейтральних частинок, маса яких близька до маси протона.
В тому ж 1932 році, було запропоновано протонно–нейтронну модель атомного ядра. Згідно з цією моделлю, атомні ядра складаються з протонів та нейтронів. При цьому, кількість протонів дорівнює зарядовому числу ядра, а кількість нейтронів – різниці між масовим та зарядовим числом. Іншими словами: Np = Z; Nn = M–Z. Наприклад, ядро урану 238U+92 складається з 92 протонів та 146 нейтронів.
Мал.192. В 1932 році була запропонована сучасна протонно-нейтронна модель атомного ядра.
Подальші дослідження повністю підтвердили достовірність протонно-нейтронної моделі. Однак ця модель поставила перед вченими ряд наукових проблем. По перше, було незрозуміло, яким чином позитивно заряджені протони та електронейтральні нейтрони об’єднуються в таку міцну структуру як атомне ядро. Адже відомі на той час фундаментальні сили, сили гравітаційної та електромагнітної взаємодій, забезпечити таке об’єднання не могли (поясніть чому?). По друге, дослідження показали, що вільні нейтрони є частинками радіоактивними. І що вони, з періодом напіврозпаду 10,6 хвилини, розпадаються на протони та електрони: 1n0 → 1р+1 + 0е–1 . Звідси, з неминучою очевидністю виникало питання: чому у вільному стані (за межами атомного ядра) нейтрони розпадаються, а в ядрі – не розпадаються?
В процесі розвитку науки, ці та їх подібні запитання отримали вичерпні відповіді. Про ці відповіді ми поговоримо дещо пізніше. На разі ж стисло зупинимся на ще одному очевидному питанні, яке стосується факту того, що відносні атомні маси більшості хімічних елементів суттєво відрізняються від цілих чисел.
Мал.193. Відносні атомні маси більшості хімічних елементів, суттєво відрізняються від цілих чисел (експериментальний факт).
Дійсно. Аналізуючи ті дані які містяться в таблиці хімічних елементів, не важко бачити, що відносні атомні маси більшості з них суттєво відрізняються від цілих чисел: 6,9Li; 10,8В; 20,2Ne; 24,3Mg; 35,5Cl і т. д. При цьому виникає закономірне питання. Якщо атоми складаються з протонів (m=1), нейтронів (m=1) та електронів (m=0), то яким чином відносна маса атома виявляється суттєво нецілою? Пояснюючи даний факт можна сказати наступне. Хімічні властивості атома практично на 100% залежать від заряду його ядра, тобто від числа протонів в ньому. Скажімо, якщо в ядрі атома міститься 17 протонів, то цим атомом є хімічно активний неметал хлор. Збільшивши число протонів до 18, ми отримаємо абсолютно новий атом – хімічно інертний аргон. Додавши ще один протон, ми отримаємо атом хімічно активного металу – калію, який буде кардинально відрізнятись від двох попередніх атомів.
Якщо ж говорити про число нейтронів в атомному ядрі, то воно практично не впливає на хімічні властивості атома. Наприклад в ядрі атома хлору 35Сl17 міститься 18 нейтронів, а в ядрі атома хлору 37Сl17 – 20 нейтронів. При цьому хімічні властивості обох атомів є практично однаковими.
Атоми, в ядрах яких міститься однакова кількість протонів але різна кількість нейтронів називають ізотопами (від грец. isos – однаковий, topos – місце). Ізотопи мають практично однакові хімічні властивості і тому цілком обгрунтовано знаходяться в одній і тій же клітинці періодичної системи та позначаються одним і тим же хімічним знаком. Однак інші властивості ізотопів можуть бути суттєво різними.
Дослідження показують, що переважна більшість природних хімічно простих речовин, представляють собою певну суміш різних ізотопів. Наприклад природний, хімічно чистий хлор, на 75,4% складається з ізотопу 35Сl17 і на 24,6% з ізотопу 37Сl17. Ці ізотопи є хімічно ідентичними і тому в будь яких сполуках (NaCl; Cl2; HCl; тощо) зустрічаються в незмінних пропорціях: 75,4% 35Сl17 та 24,6% 37Сl17. В такій ситуації, визначаючи молярну масу хлору (тобто масу 6,02·1024 його атомів) хіміки неодмінно отримують одну і ту ж величину – 35,45г/моль. Виходячи з цього, у відповідну клітинку періодичної системи записується масове число 35,45. І як ви відтепер розумієте, це число характеризує масу певного усередненого атома хлору.
На сьогоднішній день відомо близько 280 стабільних та понад 2000 радіоактивних ізотопів. При цьому всі стабільні та частина радіоактивних ізотопів є природніми, тобто такими, які зустрічаються в природних умовах Землі і поява яких не пов’язана з діяльністю людини. Наприклад, природний водень (гідроген) складається з трьох ізотопів: водень (протій) 1Н1 (99,984%), важкий водень (дейтерій) 2Н1 або 2D1 (0,016%) та надважкий водень (тритій) 3Н1 або 3Т1 (≈10–10%). При цьому водень та дейтерій є стабільними, а тритій – радіоактивним. Природний гелій складається з двох стабільних ізотопів: 4Не2 (99,9999%) та 3Не2 (0,0001%). Природний літій складається з двох стабільних ізотопів: 6Li3 (7,52%) та 7Li3 (92,48%). Природний магній складається з трьох стабільних ізотопів: 24Мg12 (78,6%), 25Мg12 (10,1%), 26Мg12 (11,3%). Природний уран, складається з двох радіоактивних ізотопів: 238U92 (99,3%) та 235U92 (0,7%).
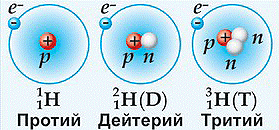
Мал.194. Ізотопи водню
Дослідження показують, що всі атоми (ізотопи) важчі за свинець-208 (208Pb82) є радіоактивними, тобто такими які рано чи пізно розпадаються. (Щоправда, радіоактивність ізотопу вісмут-209 (209Ві83) є такою мізерною, що його можна вважати практично стабільним). І якщо подібні ізотопи зустрічаються на Землі то це тільки тому, що деякі з них, зокрема 238U92; 235U92 та 232Th90 мають надзвичайно великі періоди напіврозпаду. Великі настільки, що за час існування Землі (4,5·109 років) ці ізотопи розпалися лише частково. Поступово розпадаючись, ці радіоактивні довгожителі продукують низку (приблизно 50) природних радіоактивних ізотопів, порядкові номери яких знаходяться в межах від 82 до 92.
На ряду з природними, існує величезна кількість (понад 1500) штучних радіоактивних ізотопів, тобто таких ізотопів поява яких обумовлена діяльністю людини. Скажімо в сучасній періодичній системі хімічних елементів налічується 126 хімічно різних атомів. При цьому в природних умовах Землі, жодного атома з порядковим номером більшим за 92 не існує. Всі подібні атоми є штучно створеними радіоактивними ізотопами. Зазвичай, період напіврозпаду штучних ізотопів вимірюється хвилинами, секундами та долями секунди. Однак, серед штучно створюваних ізотопів зустрічаються і «довгожителі». Наприклад Т(236U92)=24·106років; T(92Nb41)=33·106років; T(10B4)=2,5·106років; T(26Al13)= 0,74·106років; T(36Cl17)=0,4·106 років; Т(239Рu94)=24 360 років.
Розділити ізотопи хімічним шляхом практично не можливо. Однак це зовсім не означає, що цього не можливо зробити взагалі. Переважна більшість методів розділення ізотопів, базується на залежності певних фізичних процесів від маси частинок. Скажімо відомо, що при одній і тій же температурі, середня швидкість теплового руху легких частинок більша аніж важких. А це означає, що через пористу перешкоду легкі частинки дифундують суттєво швидше аніж їх важчі аналоги. Організувавши низку таких дифузійних переходів, можна суттєво змінити ізотопний склад речовини. В промислових масштабах, подібним чином здійснюють так зване збагачення урану, тобто досягають того, що в урані, кількість ізотопу уран-235 збільшується від 0,7% до 4%.
Ізотопи розділяють не лише дифузійними методами, а й методом дистиляції, методом ізотопного обміну, методом центрифугування, електролізним методом, електромагнітним методом, масспектрометричним методом, тощо.
Контрольні запитання
- Які факти вказують на те, що атомне ядро має певний внутрішній устрій?
- В чому суть протонно-електронної моделі атомного ядра?
- Чому вчені передбачили існування нейтрона?
- Які проблеми створила протонно-нейтрона модель атомного ядра?
- Поясніть, чому масове число хлору (35,45) є нецілим?
- Поясніть, чому гравітаційні та електромагнітні сили не можуть забезпечити цілісність атомного ядра?
- В сучасній таблиці Менделєєва записано близько 120 хімічних елементів. Скільки з них зустрічаються в природних умовах Землі? Скільки з них мають стабільні ізотопи?
- Чим відрізняються та в яких випадках застосовуються записи: 4Не2 та 4Не+2; 238U92 та 238U+92?
Вправа 47.
- Скільки протонів і скільки нейтронів міститься в ядрі атому азоту 14N7; германію 72Ge32; свинцю 206Pb82?
- Визначте другий продукт ядерної реакції 7Li3 + 1H1 → 4He2 + ?
- 3. Допишіть реакцій: а) 27Aℓ13 + 1n0 → ? + 4He2; б) 55Mn25 + ? → 56Fe26 + n0.
- Допишіть реакції: а) ? + 1H1 → 22Na11 + 4He2; б) 27Aℓ13 + γ → 26Mg12 + ?
- Допишіть реакції: а) 239Pu94 + 4He2 → ? + 1n0; б) 2H1 + γ → 1H1 + ?
- 6. При опроміненні ізотопу міді 63Cu29 протонами, реакція може йти декількома шляхами: із виділенням одного нейтрона; із виділенням двох нейтронів; із виділенням протона і нейтрона. Ядра яких елементів утворюються в кожному випадку? Напишіть ядерні реакції.
- При бомбардуванні азоту 14N7 нейтронами, з ядра яке утворилося вилітає протон, а потім β – частинка. Запишіть відповідні ядерні реакції.
- При бомбардуванні заліза 56Fe26 нейтронами утворюється β – радіоактивний ізотоп марганцю з атомною масою 56. Напишіть відповідну реакцію та реакцію β – розпаду марганцю.
.
§48. Ядерні сили.
До тепер, пояснюючи все різноманіття механічних, теплових, електричних, магнітних, оптичних, хімічних, міжатомних та внутріатомних явищ, ми фактично не виходили за межі двох фундаментальних сил – гравітаційної та електромагнітної. Однак, намагаючись пояснити устрій атомного ядра, ми з усією очевидністю зрозуміли: пояснити цей устрій, оперуючи відомими фундаментальними силами, не можливо.
Дійсно. Згідно з протонно–нейтронною моделлю, атомне ядро складається з позитивно заряджених протонів та електронейтральних нейтронів. При цьому, з одного боку, між цими частинками, діють сили гравітаційного притягування (Fгр=Gmр2/r2). З іншого ж боку, між протонами атомного ядра діють сили електростатичного відштовхування (Fел=kq1q2/r2). І не важко довести, що в атомному ядрі, сили електростатичного відштовхування протонів, більші за сили їх гравітаційного притягування приблизно в 1036 разів (Fел/Fгр= ke2/Gmp2 ≈ 1036). А це означає, що гравітаційні та електромагнітні сили забезпечити цілісність атомного ядра не можуть. І тим не менше, атомне ядро існує, є дуже міцним і складається з позитивно заряджених протонів та незаряджених нейтронів Звідси, з усією очевидністю випливає, що в Природі має існувати ще одна фундаментальна сила, яка і забезпечує цілісність атомного ядра. І така сила дійсно існує. Її називають ядерною силою.
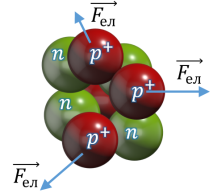
Мал.195. Чому гравітаційні та електричні сили не можуть забезпечити цілісність атомного ядра?
Навіть не заглиблюючись в деталі внутріядерних процесів, про ядерні сили можна сказати наступне. По перше. З факту того, що ядро представляє собою надзвичайно міцну структуру, з усією очевидністю випливає, що ядерні сили, це сили надзвичайно потужні. У всякому разі набагато потужніші за електромагнітні, а тим більше – за гравітаційні: Fя ˃ Fел ˃˃ Fгр .
По друге. З факту того, що ядерні сили об’єднують як заряджені так і не заряджені частинки, безумовно випливає, що ці сили є зарядово незалежними, тобто такими які діють як між зарядженими так і між незарядженими частинками. І в цьому сенсі, ядерні сили схожі на гравітаційні і не схожі на електромагнітні.
По третє. З факту того, що за межами атомного ядра ядерні сили жодним чином не проявляють себе, безумовно випливає, що ці сили короткодіючі, тобто такі, радіус дії яких обмежений розмірами атомного ядра і не перевищує 1,5·10–15м (r ≤ 1,5·10–15м). Дана властивість, кардинально відрізняє ядерні сили як від гравітаційних, так і від електромагнітних. Адже ці сили є далекодіючими, тобто такими, радіус дії яких необмежено великий (r = ∞).
В 1935 році, японський фізик Хідекі Юкава (1907–1981), намагаючись пояснити механізм внутріядерних взаємодій, висунув науково обгрунтовану гіпотезу про те, що в Природі, окрім протонів, нейтронів, електронів та фотонів, має існувати ще одна група елементарних частинок. Частинок, які і забезпечують внутріядерні взаємодії. При цьому, спираючись на закони квантової механіки, Юкава визначив основні параметри цих частинок. Зокрема, він теоретично передбачив, що маса такої частинки має бути приблизно в 250 разів більшою за масу електрона (m≈250me), а отже приблизно у 7 разів меншою за масу протона (m≈mp/7). Зважаючи на ці обставини (me˂m˂mp), теоретично передбачену частинку, Юкава назвав мезоном (від грец. mesos – проміжний, середній).
Підґрунтям для теоретичних передбачень Юкави були наступні міркування. Як відомо одним з проявів електромагнітних взаємодій є так званий ковалентний зв’язок, тобто той хімічний зв’язок який об’єднує атоми в молекули та найміцніші кристалічні структури. Суть ковалентного зв’язку полягає в тому, що атоми речовини, постійно обмінюються валентними електронами (мал.196а). При цьому між відповідними атомами виникає потужний хімічний (електромагнітний) зв’язок величина якого залежить від інтенсивності обміну електронами (чим більша інтенсивність обміну, тим міцніший зв’язок між атомами). Власне, подібним чином взаємодіють не лише атоми, а й заряджені тіла. Адже коли ми стверджуємо, що два заряди q1 i q2 взаємодіють між собою, то по суті це означає, що ці заряди постійно обмінюються квантами електромагнітних хвиль, тобто певними частинками які прийнято називати фотонами (мал.196б).
Мал.196. Суть хімічних (а) та електромагнітних (б) взаємодій полягає в тому, що взаємодіючі об’єкти постійно обмінюються певними частинками.
Виходячи з того, що механізм внутріядерних взаємодій може бути схожим на механізм ковалентного зв’язку, Юкава висунув гіпотезу про те, що в атомному ядрі протони і нейтрони постійно обмінюються певними частинками і за рахунок цього обміну об’єднуються в єдине ціле. При цьому виникало закономірне питання: а що це за частинки? Ясно, що першим претендентом на роль тих частинок якими могли обмінюватись протони та нейтрони були електрони. Однак закони квантової механіки стверджували, що такі надлегкі частинки як електрони не можуть знаходитись в таких над малих об’ємах як об’єм атомного ядра. Зважаючи на ці обставини, Юкава задався питанням: а якими згідно з законами квантової механіки мають бути ті частинки, які могли б забезпечувати внутріядерні взаємодії? І закони квантової механіки «відповіли»: маса цих частинок має бути приблизно в 250 разів більшою за масу електрона.
Не заглиблюючись в деталі теорії, масу мезона можна оцінити виходячи з наступних міркувань. В одному з базових законів квантової механіки, який називається співвідношенням невизначеностей Гейзенберга, стверджується: енергія частинки ΔЕ та час її перебування у відповідному енергетичному стані Δt, зв’язані співвідношенням: ΔE·Δt ≥ h/2π , де h=6,63·10–34Дж·с – стала Планка. Виходячи з того, що мезон фактично існує лише на проміжку того часу до поки летить від протона до нейтрона, тобто протягом Δt=r/v, де r ≈ 1,5·10–15м – радіус дії ядерних сил; v ≈ c = 3·108м/с – швидкість руху мезона, та враховуючи, що ΔЕ=mc2, де m – маса мезона, можна записати: mc2r/c ≥ h/2π, звідси m ≥ h/2πrc = 2,3·10–28кг ≈ 250mе.
Передбачена Юкавою частинка, була експериментально відкрита в 1947 році. При цьому з’ясувалося, що існує три різновидності мезонів: π+–мезон, π––мезон та π0–мезон. За сучасною класифікацією елементарних частинок, дану групу пі-мезонів прийнято називати піонами.
Потрібно зауважити, що механізм внутріядерних взаємодій практично не можливо представити у вигляді простої наочної моделі. Однак, якщо говорити про загальну суть цього механізму, то вона полягає в наступному. Складові частинки атомного ядра (протони та нейтрони), постійно обмінюються мезонами і в процесі цього обміну об’єднуються в надміцну структуру яка називається атомним ядром (мал.197). При цьому, дослідження показують, що інтенсивність протонно–нейтронних взаємодій набагато більша за інтенсивність протонно–протонних та нейтронно–нейтронних взаємодій. А це означає, що цілісність атомного ядра забезпечується головним чином за рахунок протонно–нейтронних взаємодій і що інші види взаємодій носять допоміжний характер. Крім цього, експериментальні та теоретичні дослідження показують, що різнойменні частинки обмінюються зарядженими мезонами (π+ та π–), а однойменні – незарядженими мезонами (π0).
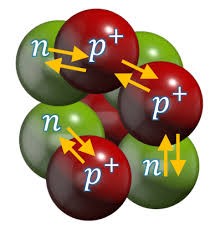
Мал.197. Графічна інтерпретація механізму дії ядерних сил (сильних ядерних взаємодій).
Аналізуючи вище описаний механізм внутріядерних взаємодій, не важко бачити, що в процесі цих взаємодій, протони і нейтрони постійно взаємно перетворюються. А це означає, що в атомному ядрі, з впевненістю сказати протоном чи нейтроном є дана частинка, практично не можливо. Адже протягом секунди ця частинка мільярди разів є то протоном то нейтроном. Зважаючи на ці обставини, ті протони та нейтрони що входять до складу атомного ядра, позначають єдиним терміном – нуклони (від лат. nucleus – ядро). Наприклад говорять, що ядро атома урану 238U+92 складається з 238 нуклонів, із яких 92 є протонами, а 146 – нейтронами.
Вище описаний механізм внутріядерних взаємодій, дозволив вирішити ще одну наукову проблему. Проблему, яка турбувала вчених з часу відкриття нейтрона.
Справа в тому, що після відкриття нейтрона (1932р) та дослідження його властивостей, з’ясувалося, що нейтрон частинка радіоактивна, і що з періодом напіврозпаду 10,6 хвилин, нейтрон розпадається на протон та електрон: 1n0→1р+1+ 0е–1. При цьому виникало питання: чому у вільному стані нейтрони розпадаються, а в атомних ядрах – не розпадаються? Втім, тепер, коли ви знаєте, що в процесі внутріядерних взаємодій протони і нейтрони постійно та надзвичайно часто взаємно перетворюються, відповісти на дане запитання не складно: в межах атомного ядра нейтрони не розпадаються тому, що просто не встигають цього зробити. Адже для того щоб розпастися, нейтрон певний час має бути нейтроном. В атомному ж ядрі, будь який нуклон мільярди разів за секунду є то протоном то нейтроном.
Потрібно зауважити, що за певних умов нейтрони можуть розпадатися і в атомному ядрі. Такі умови складаються тоді, коли в ядрі атома кількість нейтронів набагато більша за кількістю протонів. В такій ситуації нейтрон час від часу залишається так би мовити безнаглядним, тобто таким що не приймає участі у міжнуклонних взаємодіях. А будучи нейтроном він може розпастися на протон та електрон. При цьому електрон з шаленою швидкістю вилітає за межі ядра та атома загалом. Наприклад ядро надважкого водню (тритію 3Н+1) складається з одного протона та двох нейтронів. Ясно, що в такій ситуації то один то інший нейтрон не приймає участі у взаємодії, а отже відносно тривалий час залишається нейтроном. А це означає, що існує певна ймовірність розпаду нейтрона. І такий розпад рано чи пізно відбувається. При цьому ядро водню-3 перетворюється на ядро гелію-3: 3Н+1→3Не+2+0е–1.
Ядерні сили є не лише надпотужними, не лише зарядово незалежними, не лише короткодіючими, а й силами насиченої дії (обмеженої дії). Це означає, що будь який нуклон, почергово взаємодіє з певним обмеженим числом сусідніх нуклонів. І в цьому сенсі, ядерні сили суттєво відрізняються як від гравітаційних так і від електромагнітних. У всякому разі тих гравітаційних та тих електромагнітних сил, з якими взаємодіють макротіла.
Ще однією характерною особливістю ядерних сил є те, що вони нецентральні. Це означає, що величина діючої між нуклонами ядерної сили, не залежить від відстані між центрами цих нуклонів (у всякому разі, сучасній науці про таку залежність не відомо). Натомість гравітаційні та електричні сили є центральними, тобто такими, величина яких залежить від відстані між центрами взаємодіючих об’єктів.
Таким чином, характеризуючи ядерні сили, можна сказати наступне:
- Ядерні сили, це сили надзвичайно потужні.
- Ядерні сили, це сили зарядово незалежні.
- Ядерні сили, це сили короткодіючі.
- Ядерні сили, це сили насиченої дії.
- Ядерні сили, це сили нецентральної дії.
Потрібно зауважити, що механізм дії будь якої з натепер відомих фундаментальних сил, можна пояснити як з корпускулярної так і з хвильової точок зору. Наприклад, коли ми стверджуємо, що електромагнітні взаємодії є результатом того, що відповідні об’єкти постійно обмінюються фотонами, то по суті даємо корпускулярно–хвильове пояснення даного виду взаємодій. Адже фотони, з одного боку є частинками, а з іншого – певними порціями електромагнітних хвиль. Або наприклад, коли ми стверджуємо, що ядерні сили обумовлені міжнуклонним обміном мезонами, то по суті даємо корпускулярно–хвильове пояснення механізму дії ядерних сил. Адже як і будь яка елементарна частинка, мезон має як корпускулярні так і хвильові властивості. А це означає, що мезон можна розглядати не лише як частинку, а і як хвилю. Тільки хвилю не електромагнітну, а мезонну. Тому пояснюючи механізм дії ядерних сил, можна стверджувати, що кожен нуклон створює певне мезонне поле, хвильові дискретні збурення якого і передають ядерні взаємодії.
На завершення додамо, що внутріядерні взаємодії представляють собою цілий комплекс взаємопов’язаних процесів, однією з складових яких є міжнуклонний обмін мезонами. В залежності від ситуації, ці взаємодії можуть набувати найрізноманітніших проявів. Різноманіття цих проявів таке велике, що на сьогоднішній день цілісної, загально прийнятої та безумовно доведеної теорії ядерних сил не існує. А це означає, що в процесі розвитку науки, деталі вище описаного механізму внутріядерних взаємодій можуть уточнюватись. Однак, якщо говорити про загальні обриси цього механізму, то вони є безумовно достовірними.
Контрольні запитання.
- Чому устрій атомного ядра не можливо пояснити оперуючи лише гравітаційними та електромагнітними силами?
- Які факти вказують на те, що ядерні сили є: а) надзвичайно потужними; б) зарядово незалежними; в) короткодіючими.
- Чим ядерні сили схожі на сили ковалентного зв’язку?
- В чому суть теорії Юкави?
- Чому електрони не можуть бути тими частинками які забезпечують цілісність атомного ядра?
- Чому протони та нейтрони атомного ядра позначають єдиним терміном – нуклони?
- Чому нейтрони в атомному ядрі не розпадаються?
- Що означає твердження: ядерні сили, це сили насиченої дії?
.
§49. Енергія зв’язку та дефект маси атомного ядра.
Керуючись законом збереження енергії не важко довести, що енергія атомного ядра Е1 менша за загальну енергію тих окремих нуклонів Е2 з яких це ядро складається (Е1 ˂ Е2). Дійсно. Оскільки атомне ядро представляє собою міцну цілісну структуру, то абсолютно очевидно, що для розщеплення цієї структури на окремі частинки (нуклони) потрібно витратити певну кількість енергії ΔЕ. А це означає, що енергія тієї системи яку отримають в результаті повного розщеплення атомного ядра на його окремі нуклони (Е2) буде більшою за енергію самого ядра (Е1). Більшою на величину, яку прийнято називати енергією зв’язку атомного ядра: ΔЕ = Е2 – Е1 .
Мал.198. Енергія атомного ядра менша за загальну енергію тих окремих нуклонів з яких це ядро складається.
Енергією зв’язку атомного ядра називають ту мінімальну кількість енергії яку необхідно витратити на те щоб повністю розщепити дане атомне ядро на його складові нуклони
Позначається: ΔЕ
Визначальне рівняння: ΔЕ = Δmc2, де Δm – дефект маси атомного ядра
Одиниця вимірювання: [ΔE] = Дж , (або еВ).
Пояснюючи суть того що називають дефектом маси атомного ядра, можна сказати наступне. В теорії відносності стверджується, що повна енергія системи Е та її маса m зв’язані співвідношенням Е=mc2. А оскільки загальна енергія системи окремих нуклонів (Е2) більша за енергію того ядра яке з цих нуклонів складається (Е2>Е1), то відповідно більшою буде і загальна маса цих нуклонів (m2>m1). Результати експериментальних досліджень повністю підтверджують дане передбачення. Наприклад відомо, що маси вільного протона та вільного нейтрона відповідно дорівнюють: mp = 1,67265·10–27кг; mn = 1,67495·10–27кг. Маса ж того ядра яке складається з двох протонів та двох нейтронів (ядра атома гелію-4) становить m(4He+2) = 6,6447·10–27кг. І не важко довести, що загальна маса двох протонів та двох нейтронів більша за масу відповідного атомного ядра: (2mp + 2mn) – m(4He+2) = 0,0505·10–27кг = 9,5me.

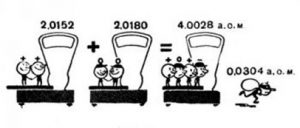
Мал.199. Маса ядра менша за масу тих окремих частинок з яких воно складається.
Дефектом маси атомного ядра називають ту різницю мас, що існує між загальною масою тих вільних нуклонів які утворюють дане атомне ядро (m2) та масою цього ядра (m1).
Позначається: Δm
Визначальне рівняння: Δm = m2 – m1
Одиниця вимірювання: [Δm] = кг.
Ви можете запитати: «А як це може бути, щоб маса атомного ядра була меншою за загальну масу тих частинок з яких це ядро складається? І чи не суперечить дана ситуація закону збереження маси?». Ну по перше, в сучасній науці такого закону як закон збереження маси не існує. Натомість існує закон який називається законом збереження мас-енергії. А по друге, факт того, що маса атомного ядра менша за загальну масу тих вільних нуклонів з яких це ядро складається, зовсім не означає, що в процесі утворення атомного ядра певна частина матерії безслідно зникає. Не означає тому, що при відповідному процесі, виділяється певна кількість енергії. А це означає, що в процесі утворення атомного ядра, певна кількість тієї матерії яку прийнято називати речовиною, перетворюється на відповідну кількість матерії яку прийнято називати енергією випромінювання. Перетворюється у повній відповідності з законом ΔЕ = Δmc2 .
І не важко збагнути, що у повній відповідності з законом збереження енергії (а точніше мас-енергії), загальна кількість тієї енергії яка виділяється в процесі утворення атомного ядра ΔЕ=Δmc2, в точності дорівнює тій енергії яку називають енергією зв’язку атомного ядра. А це означає, що енергію зв’язку атомного ядра, можна визначити за формулою ΔЕ=Δmc2, де Δm – дефект маси відповідного ядра. Наприклад, якщо дефект маси ядра атома гелію становить Δm = 0,0505·10–27кг, то енергія зв’язку цього ядра ΔЕ = Δmc2 = 45,4·10–13Дж = 28,3МеВ.
В багатьох практично важливих ситуаціях, енергетичні параметри атомного ядра характеризують не його енергією зв’язку, а питомою енергією зв’язку. Питомою енергією зв’язку атомного ядра називають відношення енергії зв’язку відповідного ядра (ΔЕ) до кількості нуклонів в ньому (до його масового числа М): ε = ΔЕ/М. Наприклад, для гелію (М=4нукл; ΔЕ=28,3МеВ), питома енергія зв’язку становить ε = 7,07МеВ/нук.
Дослідження показують, що питома енергія зв’язку легких атомних ядер (М ˂ 20) характеризується значними коливаннями цієї енергії (мал.178). Однак в подальшому, ці коливання стають менш суттєвими. При цьому стають очевидними певні тенденції зміни питомої енергії зв’язку. А ці тенденції полягають в тому, що до певної межі (до атомів заліза Fe) питома енергія зв’язку поступово збільшується, а після цієї межі – поступово зменшується.
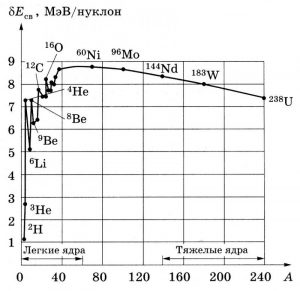
Мал.200. Діаграма залежності питомої енергії зв’язку атомного ядра від числа нуклонів в ньому.
Факт того, що питома енергія зв’язку атомного ядра, до певної межі збільшується, а після цієї межі – зменшується, по суті означає, що до відповідної межі, процес об’єднання (синтезу) легких атомних ядер в більш важкі ядра, відбувається з виділенням енергії, а після цієї межі – з її поглинанням. З практичної точки зору це означає, що певну кількість ядерної енергії можна отримати двома шляхами. 1) Шляхом об’єднання легких атомних ядер у відповідні більш важкі ядра (реакції термоядерного синтезу). 2) Шляхом поділу надважких атомних ядер, на відповідні більш легкі ядра або на їх елементи (ядерні реакції поділу та природна радіоактивність).
Ясно, що визначити дефект маси атомного ядра, а відповідно і енергію його зв’язку, без точної інформації про масу самого ядра, неможливо. А така інформація міститься у відповідних таблицях. Користуючись такими таблицями потрібно звернути увагу на дві обставини. 1) Табличні значення мас атомів зазвичай виражені не в кілограмах а в атомних одиницях маси (а.о.м.=1,660565510–27кг). 2) В таблицях зазвичай міститься інформація про масу того чи іншого ізотопу (атома). А ця маса складається з маси відповідного ядра та загальної маси тих електронів які обертаються навколо нього. Тому якщо наприклад, m(238U92)=238,05006а.о.м, то m(238U+92) = m(238U92) – 92me. Якщо ж говорити про маси протонів, нейтронів та електронів, то вони відносяться до числа базових фізичних сталих:
mp=1,6726485·10–27кг;
mn=1,6749543·10–27кг
mе=9,10953·10–31кг.
Таблиця. Маси деяких ізотопів (в а.о.м.)
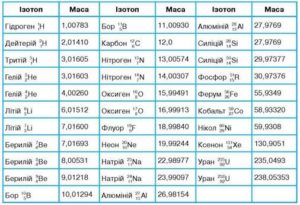
Задача. Визначити дефект маси, енергію зв’язку та питому енергію зв’язку ядра атому урану–238 (m(238U92)=238,05006а.о.м.)
Дано:
m(238U92)=238,05006а.о.м.= 238,05006·1,66057·10–27кг= 395,29878·10–27кг
mе=9,10953·10–31кг.
mp=1,6726485·10–27кг
mn=1,6749543·10–27кг
Δm=?; ΔE=?; ε=?
Рішення.
Визначаємо масу атомного ядра: m(238U+92) = m(238U92) – 92me= 395,29878·10–27кг – 92·9,10953·10–31кг= (395,29878 – 0,08381)10–27кг= 395,21497·10–27кг.
Визначаємо загальну масу нуклонів: 92mp + 146mn = 92(1,6726485·10–27кг) + 146(1,6749543·10–27кг)= 398,42701·10–27кг.
Визначаємо дефект маси атомного ядра: Δm= 398,42701·10–27кг – 395,29878·10–27кг = 3,21204·10–27кг.
Визначаємо енергію зв’язку атомного ядра: ΔЕ= Δmс2= 3,21204·10–27кг·(3·108м/с)2 = 28,91·10–11Дж= 18·108еВ= 1800МеВ.
Визначаємо питому енергію зв’язку: ε=ΔЕ/М= 1800МеВ/238нук = 7,56МеВ/нук.
Контрольні запитання.
- Чому загальна енергія атомного ядра, менша за загальну енергію тих окремих нуклонів з яких це ядро складається?
- Чому маса атомного ядра, менша за загальну масу тих окремих нуклонів з яких це ядро складається?
- Чому в сучасній науці говорять не про закон збереження маси, а про закон збереження мас-енергії?
- Відомо, що до певної межі питома енергія зв’язку атомного ядра збільшується, а після цієї межі – зменшується. Що це означає?
Вправа 49.
- Визначити дефект маси, енергію зв’язку та питому енергію зв’язку ядра атому літію (m(7Li3)=7,01601а.о.м.)
- Визначити дефект маси, енергію зв’язку та питому енергію зв’язку ядра атому алюмінію (m(27Аℓ13)=26,98153а.о.м.).
- Визначте найменшу енергію, необхідну для розділення ядер вуглецю (m(12С6)=12,00000а.о.м.) на три однакові частини.
.
§50. Термоядерні реакції. Енергія Сонця та зірок.
З факту того, що для розщеплення стабільного атомного ядра на дві, три чи більшу кількість частин, потрібні певні енергетичні затрати, з усією очевидністю випливає, що при зворотному процесі, аналогічна кількість енергії має виділятись. Ядерні реакції при яких легкі атомні ядра об’єднуються (синтезуються) у відповідні більш важкі ядра, називаються термоядерними реакціями або реакціями термоядерного синтезу. Вони називаються термоядерними тому, що відбуваються при надзвичайно високих температурах (понад 106К).
Пояснюючи факт того, що термоядерні реакції відбуваються при надвисоких температурах, можна сказати наступне. Оскільки ядерні сили є силами короткодіючими, то для отримання енергії цих сил, взаємодіючі частинки потрібно зблизити на відстань радіусу дії ядерних сил (≈1,5·10–15м), тобто на відстань, яка в 5000 разів менша за радіус атома. Звичайно, якби ці частинки були незарядженими або зарядженими та незарядженими, то необхідне зближення відбувалось би в процесі того теплового руху який характеризується відносно низькими температурами. Однак в даному випадку, мова йде про взаємодію атомних ядер, тобто тих позитивно заряджених частинок, між якими діють потужні сили електростатичного відштовхування. Це відштовхування можна подолати лише в тому випадку, якщо кінетична енергія взаємодіючих частинок буде надзвичайно великою. Великою настільки, що температура відповідної речовини має вимірюватись мільйонами кельвінів. Крім цього, надвисока температура створює умови при яких атомні ядра є так би мовити «голими», тобто такими які не захищені одне від одного електронною «подушкою».
Таким чином, для того щоб отримати енергію термоядерного синтезу, відповідну речовину потрібно попередньо нагріти до певної надвисокої температури. А таке нагрівання потребує певних енергетичних затрат. Втім, зробивши ці затрати та запустивши термоядерний процес, ви отримаєте таку кількість енергії яка не лише компенсує ваші енергетичні затрати, а й дасть великий енергетичний виграш. Дану ситуацію ілюструє наступна механічна модель. Уявіть собі дорогу, в якій відносно невеликий підйом змінюється затяжним спуском (мал.201). Долаючи підйом ви витрачаєте певну кількість енергії. Натомість, спускаючись з вершини підйому, отримуєте таку кількість енергії, яка не лише компенсує ваші енергетичні затрати, а й дає певний енергетичний виграш.
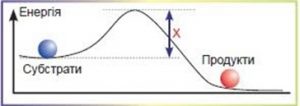
Мал.201. Механічна модель термоядерних реакцій.
В природних умовах, інтенсивні термоядерні реакції відбуваються в надрах зірок. Наприклад, в надрах Сонця при температурі близькій до 13·106К, відбувається так званий водневий цикл термоядерних реакцій. Водневим циклом термоядерних реакцій (протон–нейтронним циклом), називають ту послідовність ядерних реакцій в процесі якої чотири протона (чотири ядра атома водню) об’єднуються в одне ядро атома гелію: 41Н+1 → 4Не+2 + 26,71еВ. Етапи та енергетичний баланс водневого циклу термоядерних реакцій представлено в таблиці 1.
Таблиця 1. Водневий цикл термоядерних реакцій.
| Реакція | Енерговиділення (МеВ) |
| 2 (1Н+1 + 1Н+1) → 2 (2D+1 + 0e+1 + ν) | 0,33 + (0,51) |
| 2 (0e+1 + 0e–1) → 2 ( 2γ ) | 2,04 |
| 2 (1H+1 + 2D+1) → 2 (3He+2 + γ) | 10,98 |
| 3He+2 + 3He+2 → 4He+2 + 21H+1 | 12,87 |
| Всього: 41Н+1 → 4Не+2 | 26,20 + (0,51) |
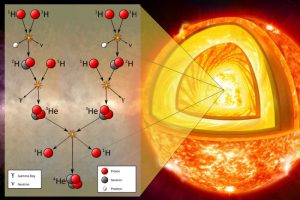
Мал.202. В надрах Сонця при температурі близькій до 13·106К відбувається водневий цикл термоядерних реакції.
Коментуючи наведені в таблиці дані, потрібно звернути увагу на те, що та енергія яка виділяється в процесі водневого циклу термоядерних реакцій (26,71МеВ) дещо менша за енергію зв’язку ядра гелію–4 (28,3МеВ). Даний факт пояснюється тим, що частина енергії термоядерних реакцій йде на перетворення протонів в нейтрони. Буде не зайвим сказати і про те, що переважна більшість (26,20МеВ) тієї енергії яка виділяється при водневому циклі термоядерних реакцій, виділяється у вигляді потужного електромагнітного випромінювання (фотонів). Тобто у вигляді тієї енергії яка інтенсивно взаємодіє з речовиною та спричиняє ті чи інші ефекти, зокрема теплові. Незначна ж частина (0,51МеВ) термоядерної енергії Сонця, випромінюється у вигляді особливих частинок які називаються нейтріно (ν). Ці частинки практично не взаємодіють з речовиною і тому відповідну енергію можна вважати безповоротно втраченою. Втраченою в тому сенсі, що її практично неможливо використати.
В межах водневого циклу, в надрах Сонця відбуваються й інші термоядерні реакції, кінцевим продуктом яких є гелій-4. Однак загальна кількість цих реакцій та їх загальний внесок в енергетичний баланс тих процесів що відбуваються на Сонці є незначними.
Потрібно зауважити, що будь яка термоядерна реакція, представляє собою складний квантово-механічний процес. Процес, який характеризується не лише певними енергетичними параметрами, а й певною ймовірністю протікання. Це означає, що та чи інша термоядерна реакція відбувається або не відбувається з певною ймовірністю. Ймовірністю, величина якої складним чином залежить від багатьох обставин: сорту взаємодіючих частинок, їх енергетичних параметрів, температури речовини, її густини, тиску, тощо.
Зазвичай, ймовірнісні параметри термоядерних та ядерних реакції характеризують величиною яка називається перерізом ядерної реакції, позначається σ, вимірюється в барнах. Наприклад для реакцій:
1) 1Н+1 + 1Н+1 → 2D+1 + 0e+1 + ν : σ = 10–23 барн;
2) 3Т+1 + 3Т+1 → 4Не+2 + 21n0 : σм = 0,1 барн;
3) 2D+1 + 3T+1 → 4He+2 + 1n0 : σм = 5 барн.
Це означає, що перша реакція відбувається з надзвичайно малою ймовірністю. Ця ймовірність така мала, що по суті лише одне з 1023 зіткнень ядер атомів водню закінчується утворенням більш важкого атомного ядра – ядра дейтерію. (Власне ця надзвичайно мала ймовірність і визначає факт того, що водневий цикл термоядерних реакцій є відносно повільним та довготривалим). Натомість ймовірність другої та третьої реакцій є досить великою. При цьому, за одних і тих же умов, ймовірність третьої реакції в 50 разів більша ніж другої.
Ясно, що яким би тривалим не був водневий цикл термоядерних реакцій, але рано чи пізно кількість водню в надрах зірки стане критично малою. Яка ж доля очікує зірку, в подальшому. А ця доля є наступною. Після того, як в процесі термоядерного синтезу, більша частина того водню що знаходиться в ядрі зірки перетворюється на гелій, інтенсивність термоядерного синтезу починає зменшуватись. При цьому потужні гравітаційні сили починають поступово стискати та додатково розігрівати ядро зірки. Коли ж в процесі цього стиснення, ядро розігрівається до температури 100·106К, в ньому починається новий цикл термоядерних реакцій. Реакцій, при яких гелій, шляхом двох послідовних взаємодій, перетворюється на вуглець (карбон):
4Не+2 + 4Не+2 → 8В+4 + ΔЕ 7,3МеВ
8В+4 + 4Не+2 → 12С+6 + ΔЕ
В процесі подальшого гравітаційного стиснення та розігрівання надр зірки, в них послідовно синтезуються все більш та більш важкі атомні ядра, зокрема ядра кисню, неону та магнію:
Т ~ 200·106К : 12С+6 + 4Не+2 → 16О+8 + ΔЕ
Т ~ 300·106К : 16О+8 + 4Не+2 → 20Ne+10 + ΔЕ
Т ~ 400·106К : 20Nе+10 + 4Не+2 → 24Mg+12 + ΔЕ
Дослідження показують, що на етапі утворення магнію, при температурі близькій до 400·106К, практично увесь наявний в надрах зірки гелій вичерпується. Тому для здійснення нових циклів термоядерних реакцій, (зокрема таких як 12С+6+12С+6→24Мg+12+ΔЕ; 12С+6+16О+8→28Si+14+ΔЕ; 16О+8+16О+8→32S+16+ ΔЕ , тощо) потрібне нове значне підвищення температури. І якщо таке підвищення можливе (а це залежить від маси зірки), то в надрах зірок, при температурах понад 1·109К, вище згадані реакції відбуваються.
Таким чином, в надрах зірок, в процесі певної послідовності термоядерних реакцій, синтезуються все більш і більш важкі атомні ядра. Головним чином ті, що утворюють так званий α-ланцюг: 12С+6→16О+8→20Ne+10→24Mg+12→28Si+14→32S+16→… Паралельно з цим, в процесі взаємодії з наявними ядрами водню, дейтерію та інших елементів, синтезуються й інші проміжні атомні ядра. Однак загальна інтенсивність цього синтезу є відносно низькою.
Характеризуючи усереднені енергетичні тенденції вище описаних термоядерних реакцій, можна сказати наступне. По мірі того, як в процесі термоядерного синтезу, маса атомного ядра збільшується, енергетична ефективність реакції зменшується. Зменшується в тому сенсі, що кожен новий цикл реакцій відбувається при все більш і більш високій температурі, тоді як енергетичний виграш від реакції стає все меншим і меншим.
Умовно кажучи, для здійснення все нових і нових реакцій, нам потрібно викочувати кулю на все більшу і більшу висоту (мал.201). При цьому величина того спуску який знаходиться за вершиною гори, стає все меншою і меншою. Ясно, що в такій ситуації рано чи пізно настає момент, коли енергогенеруючий потенціал термоядерних реакцій вичерпується (висота підйому, дорівнює глибині спуску). Цей момент настає при температурі 3,5·109К, коли в надрах зірки утворюються ядра заліза (Fe). Іншими словами, залізо є тим останнім хімічним елементам атомні ядра якого утворюються з виділенням енергії.
Ядра більш важких хімічних елементів, синтезуються не з виділенням енергії, а з її поглинанням. Точніше кажучи, та енергія яка виділяється в результаті відповідних термоядерних реакцій, менша за ту енергію яка витрачається на здійснення цих реакцій. По суті це означає, що в атомних ядрах важчих за залізо (Fе26), міститься певний надлишок енергії. При цьому, по мірі збільшення маси ядра, величина наявної в ньому надлишкової енергії неухильно зростає.
До певної межі (до ядер атома свинцю-208) потужні ядерні сили стримують наявну в ядрі надлишкову енергію та забезпечують стабільність відповідного ядра. Однак в надмасивних атомних ядрах (ядрах важчих за 208Pb+82) надлишок внутріядерної енергії такий великий, що навіть потужні ядерні сили не можуть утримати відповідне ядро від розпаду. Тому всі атомні ядра важчі за ізотоп 208Pb82 є радіоактивними, тобто такими які рано чи пізно розпадаються. І якщо на Землі надважкі хімічні елементи все ж зустрічаються, то це тільки тому, що деякі з них, зокрема 238U92; 235U92 та 232Th90 мають надзвичайно великі періоди напіврозпаду. Крім цього, потрібно мати на увазі, що радіоактивність ізотопу вісмут-209 така мізерна, що він є практично стабільним (Т(209Ві83) = 2·1019років, а це в мільярди разів більше за вік Всесвіту).
Таким чином, в надрах зірок, при все більш і більш високих температурах, синтезуються все більш і більш важкі атомні ядра. Синтезуються до тих пір, поки при температурі 3,5·109К не утворюються ядра атома заліза (Fe26). При цьому енергогенеруючий потенціал термоядерних реакцій вичерпується. Вичерпується в тому сенсі, що більш важкі атомні ядра, синтезуються не з виділенням енергії, а з її поглинанням (затрати енергії на здійснення реакції, більші за ту енергію яка виділяється в результаті реакції). В такій ситуації, термоядерні реакції не протидіють гравітаційному стисненню зірки, а навпаки – сприяють йому. Результатом такого сприяння, стає надпотужний вибух зірки. Вибух, в процесі якого синтезується та викидається в навколишній простір все різноманіття відомих хімічних елементів. Втім, про деталі тих подій які відбуваються в надрах зірок ми поговоримо вивчаючи тему «Про еволюцію зірок». Наразі ж, ключові моменти вище сказаного, представимо у вигляді наступної схеми.
H1→He2→……….→Fe26 (1)→………………→208Pb82 (2)→………238U92 (3)→……
до (1) – реакції з виділенням енергії;
після (1) – реакції з поглинанням енергії;
до (2) – ядра переважно стабільні;
після (2) – всі ядра радіоактивні;
до (3) – зустрічаються в природних умовах Землі;
після (3) – в природних умовах Землі не зустрічаються.
Завершуючи розмову про термоядерні реакції додамо, що визначення: «термоядерними називають такі реакції при яких легкі атомні ядра об’єднуються в більш важкі ядра», є досить умовним. Умовним бодай тому, що серед термоядерних реакцій є і такі, продуктами яких є більш легкі ядра. Наприклад:
7Li+3 + 1H+1 → 24He+2 + 17,3МеВ
6Li+3 + 2D+1 → 24He+2 + 22,4МеВ
11B+5 + 1H+1 → 34He+2 + 8,7МеВ.
Додамо також, що в надрах Сонця, в результаті термоядерних реакцій, щосекундно генерується понад 4·1026Дж енергії. А це означає, що в надрах Сонця, у повній відповідності з законом Е = mc2 щосекундно 4,5 мільйонів тон речовини, перетворюється на енергію випромінювання. Невелика частина цієї енергії потрапляє на Землю, та створює на ній ті умови, що є придатними для життя.
Задача. Зробити енергетичний розрахунок ядерної реакції:
4Не2 + 4Не2 → 7Lі3 + 1Н1.
Рішення.
Визначаємо загальну масу ядер до та після реакції (в даному випадку в якості маси атомного ядра можна брати масу відповідного атома, адже кількості електронів в правій та лівій частинах реакції є однаковою):
m(4Не2 + 4Не2)= 4,00260 + 4,00260 = 8,00520а.о.м.
m(7Lі3 + 1Н1)= 7,01600 + 1,00783 = 8,02384а.о.м.
Оскільки маса атомних ядер до реакції менша аніж після реакції, то це означає, що відповідна ядерна реакція відбувається з поглинанням енергії, кількість якої можна визначити за формулою ΔЕ=Δmс2, де Δm= (8,02384 – 8,00520)= 0,01864а.о.м= 0,031·10–27кг. ΔЕ=Δmс2= 0,031·10–27кг·9·1016(м2/с2)= 0,28·10–11Дж= 0,174·108еВ= 17,4МеВ.
Відповідь: Реакція відбувається з поглинанням 17,4МеВ енергії.
Контрольні запитання.
- З якого факту випливає, що при об’єднанні легких атомних ядер має виділятись енергія?
- Чому для здійснення термоядерних реакцій потрібні надвисокі температури?
- На якому етапі і при якій температурі, в надрах зірки вичерпуються запаси гелію?
- На якому етапі і при якій температурі вичерпується енергогенеруючий потенціал термоядерних реакцій?
- Чому в ядрах важчих за залізо є певний надлишок енергії?
- Чому всі хімічні елементи важчі за свинець-208 є радіоактивними? Чому такі елементи зустрічаються на Землі.
Вправа 50.
1.Визначити енергетичний вихід ядерної реакції 7Li3 + 1H1 → 2(4He2), якщо питома енергія у ядра атома літію 5,6МеВ/нук, а у гелію – 7,075МеВ/нук.
- Визначити енергетичний вихід ядерної реакції 7Li3 + 2H1 → 8Вe4 + 1n0, якщо енергія зв’язку ядер ізотопу берилію 56,4МеВ, ізотопу літію – 39,2МеВ, дейтерію – 2,2МеВ.
- Зробити енергетичний розрахунок ядерної реакції: 7Lі3 + 2Н1 → 2(4Не2).
- Зробити енергетичний розрахунок ядерної реакції: 14N7 + 4Нe2 → 17O8 + 1Н1.
- При обстрілюванні ядер бору 11В5 протонами утворюється берилій 8Ве4. Які ще ядра утворюються при цій реакції і скільки енергії виділяється?
- При бомбардуванні алюмінію 27Аℓ13 α-частинками утворюється фосфор 30Р15. Запишіть відповідну реакцію та визначте кількість виділеної енергії.
.
§51. Військове та цивільне застосування термоядерних реакцій.
Про ту надважливу роль яку відіграють термоядерні реакції в загальному устрої Природи ви вже знаєте. Тому наразі поговоримо про те, як застосовуються та можуть застосовуватись ці реакції в штучних, тобто людиною створених умовах.
На сьогоднішній день, в так би мовити промислових масштабах, людство навчилося здійснювати лише так звані неконтрольовані термоядерні реакції, тобто такі реакції які відбуваються у формі неконтрольованого термоядерного вибуху. Прилад в якому здійснюються такі реакції називається термоядерною (водневою) бомбою. Термоядерна бомба представляє собою надзвичайно міцний корпус (3) в якому знаходиться термоядерний заряд (2) та невеличка атомна бомба (1) мал.203. Принцип дії цієї системи полягає в наступному. В потрібний момент, ініціюється вибух відносно невеликої атомної бомби. В процесі цього вибуху, термоядерна вибухівки практично миттєво нагрівається до десятків мільйонів кельвінів і в ній відбувається величезна кількість термоядерних реакцій які і спричиняють надпотужний вибух.
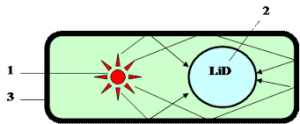
Мал.203. Схема принципового устрою термоядерної бомби
В перших термоядерних бомбах, в якості термоядерної вибухівки використовували рідку суміш двох ізотопів водню: дейтерію (2D1) та тритію (3Т1). З експлуатаційної точки зору, така вибухівка не є надто зручною. Адже водень може бути рідким лише при температурах нижчих за –240ºС. А це означає, що воднева термоядерна вибухівка потребує надійної теплоізоляції та постійних зусиль направлених на підтримку наднизької температури. Крім цього, тритій є радіоактивним елементом з відносно малим періодом напіврозпаду (Т=12,3 роки). А це означає, що термін зберігання тритієвої вибухівки є обмеженим. Зважаючи на ці обставини, в сучасних термоядерних бомбах, в якості основної вибухівки використовують тверду не радіоактивну речовину – дейтрид літію (LiD). Принцип дії цієї вибухівки полягає в наступному. При підриві атомної бомби, термоядерна вибухівка (LiD) нагрівається до десятків мільйонів кельвінів. При цьому в ній відбувається величезна кількість термоядерних реакцій, які і спричиняють надпотужний вибух. Основними з цих реакцій є:
6Li+3 + 1n0 → 4He+2 + 3T+1 + 4,8МеВ
2D+1 + 3T+1 → 4He+2 + 1n0 + 17,6МеВ
6Li+3 + 2D+1 → 24He+2 + 22,4МеВ
2D+1 + 2D+1 → 3T+1 + 1H+1 + 4,0МеВ.
На сьогоднішній день термоядерні бомби є найпотужнішими та найнебезпечнішими засобами масового знищення всього живого та неживого на Землі. Потужність цих бомб вимірюється десятками мегатон. Це означає, що енергія вибуху однієї такої бомби еквівалентна вибуху десятків мільйонів тон звичайної хімічної вибухівки (тротилу). А це в тисячі разів перевищує потужність тих атомних (ядерних) бомб, які зруйнували японські міста Хіросіму та Нагасакі.
Втім, енергія термоядерного синтезу може бути не лише руйнівною, а й корисною. Однак для того щоб отримати цю будівничо – корисну енергію потрібно навчитися здійснювати так звані керовані термоядерні реакції, тобто такі реакції енерговиділення яких є дозованим та регульованим. Не буде перебільшенням сказати, що в сучасного людства нема більш нагального та більш важливого енергетичного завдання, аніж створення таких приладів, які б в промислових масштабах перетворювали енергію термоядерних реакцій в корисну роботу. Створивши такі прилади, людство отримало б практично невичерпне джерело екологічно чистої, безпечної енергії та вирішило б всі свої енергетичні проблеми на мільйони років вперед.
На жаль, в промислових масштабах здійснювати керовані термоядерні реакції ми ще не вміємо. Не вміємо не тому, що чогось не знаємо про термоядерні реакції, а тому що для практичної реалізації контрольованих реакцій термоядерного синтезу, потрібно вирішити ряд надскладних науково–технічних проблем. Основними з цих проблем є. 1) Розробити та реалізувати технологію розігріву робочого термоядерного тіла до десятків мільйонів градусів. 2) Розробити та створити той термоядерний «котел» який би дозволяв утримувати нагріту до багатьох мільйонів градусів речовину, яка крім всього іншого створюватиме на стінки цього «котла» неймовірно великий механічний тиск. 3) Розробити та реалізувати ефективний спосіб відведення генерованої термоядерної енергії від робочого тіла. 4) Забезпечити динамічну стійкість та безпечність процесу.
В тих природних приладах які називаються зірками, всі вище названі та не названі проблеми, вирішуються просто та ефективно: надмасивне тіло зірки, та створюване ним надпотужне гравітаційне поле є і джерелом необхідно високої температури, і джерелом необхідно високого тиску, і джерелом тих сил які утримують термоядерну топку в стані стійкої рівноваги, і взагалі джерелом всього того, що забезпечує стабільну роботу термоядерного приладу. Ясно, що в умовах Землі, створити прилад, маса якого була б співрозмірною є масою Сонця, не можливо. Тому перед вченими стоїть неймовірно важке завдання: створити мініатюрне сонце, в якому функції надпотужного гравітаційного поля виконують інші енергетично–силові фактори.
На сьогоднішній день, найбільш перспективною виглядає ідея створення термоядерних реакторів з магнітною термоізоляцією плазми. Суть цієї ідеї полягає в наступному. Через низькотемпературну термоядерну плазму, пропускають надпотужний електричний струм (струм, величина якого вимірюється мільйонами ампер). Цей струм, по перше спричиняє виділення такої великої кількості теплоти (Q=I2Rt) яка розігріває плазму до необхідно високих температур (~108К). А по друге, створює таке потужне магнітне поле, яке відокремлює високотемпературну плазму від стінок реактора. А це в свою чергу дозволяє створити систему ефективного відводу генерованої термоядерної енергії.
Прилад, призначений для здійснення керованих термоядерних реакцій на основі магнітної термоізоляції плазми, прийнято називати токамак (тороїдальна камера з магнітними котушками). Перші токамаки були збудовані ще в середині 50-х років минулого століття. За ці роки вчені та інженери досягли значного прогресу на шляху практичної реалізації керованих термоядерних реакцій. Однак, маємо визнати, що сьогодні як і сімдесят років тому, проблема здійснення промислово доцільних керованих реакцій термоядерного синтезу, залишається не вирішеною.
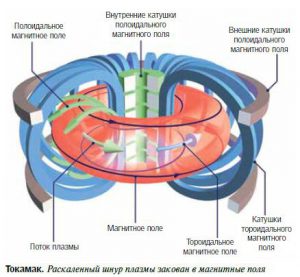
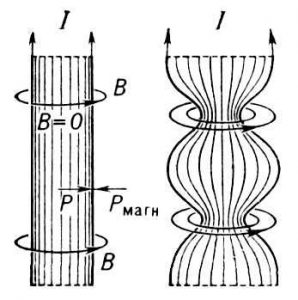
Мал.204. Схема загального устрою та принципу дії токамака.
Схема термоядерного синтезу з магнітною термоізоляцією плазми має один принциповий недолік. І цей недолік полягає в тому, що стиснута магнітним полем термоядерна плазма, практично неминуче перебуває в стані нестійкої рівноваги. Дійсно. Припустимо, що в результаті тих хаотичних процесів які відбуваються в тілі високотемпературної плазми, в певному місці цього тіла відбулося мізерне зменшення площі поперечного перерізу плазмового шнура (таке зменшення може спровокувати будь яке місцеве вихрове збурення плазми). Це зменшення автоматично призведе до місцевого збільшення густини струму, яке в свою чергу призведе до збільшення тієї місцевої магнітної сили, яка обжимає тіло плазмового шнура. А це означає, що будь яка місцева деформація тіла плазми, неминуче буде поглиблюватись до тих пір, до поки магнітні сили не розірвуть це тіло та не припинять термоядерний процес.
Дана проблема є настільки складною, що до тепер не має задовільного вирішення. Втім, будемо сподіватися, що рано чи пізно проблема керованого термоядерного синтезу буде вирішена, а разом з нею вирішені і практично всі енергетичні проблеми людства.
Контрольні запитання.
- Поясніть загальний устрій та принцип дії термоядерної бомби.
- Чому з експлуатаційної точки зору, суміш дейтерію з тритієм є поганою термоядерною вибухівкою?
- Чому дейтерій та тритій можуть бути термоядерною вибухівкою, а водень (1Н1) – практично ні?
- Які проблеми потрібно вирішити, щоб в промислових масштабах здійснювати керовані термоядерні реакції?
- Як ці проблеми вирішуються на Сонці?
- Поясніть загальний устрій та принцип дії токамака.
- Який принциповий недолік термоядерних реакторів з магнітною термоізоляцією плазми?
Вправа 51.
- Визначте енергію реакції синтезу речовини із дейтерію 2Н1 і тритію 3Н1.
- В надрах зірки 5·104кг водню перетворюються на 49644 кг гелію. Скільки енергії виділяється при цьому.
- Яку масу води, взятої при температурі 0°С, можна довести до кипіння, використавши енергію термоядерного синтезу гелію із дейтерію і тритію, якщо ККД перетворення 10%? Маса синтезованого гелію 1г.
.
§52. Види радіоактивного розпаду. Родини радіоактивних елементів.
На сьогоднішній відомо близько 2000 радіоактивних ізотопів, тобто таких природних чи штучно створених атомів, ядра яких спонтанно перетворюються на ядра інших хімічних елементів. При цьому розрізняють дві різновидності подібних перетворень: α-розпад та β-розпад.
Альфа-розпадом називають таке спонтанне радіоактивне перетворення атомного ядра, яке є результатом випромінюванням α-частинки (4α+2). Оскільки α-частинка представляє собою сукупність двох протонів та двох нейтронів (4α+2 = 4Не+2), то не важко збагнути, що в процесі альфа-розпаду зарядове число ядра зменшується на дві одиниці, а його масове число зменшується на чотири одиниці. Наприклад: 238U+92 – 4α+2 → 234Th+90.
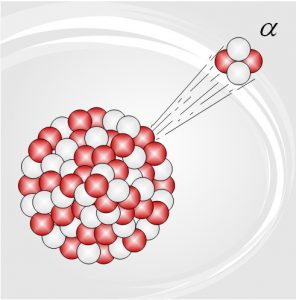
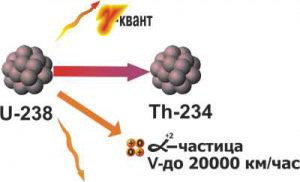
Мал.205. В процесі α-розпаду, радіоактивне ядро випромінює α-частинку та γ-квант.
Альфа-розпад зазвичай характерний для надмасивних атомних ядер (М˃200). Однак альфа-радіоактивними можуть бути і більш легкі атомні ядра, зокрема ті що відносяться до так званих рідкоземельних металів (елементи сімейства лантаноїдів). Період напіврозпаду альфа-радіоактивних елементів коливається від 3·10–7с для 212Ро84, до 2·1019років для 209Ві83.
В загальних рисах, механізм альфа-розпаду полягає в наступному. Як відомо, ядерні сили є силами насиченої дії. Це означає що в атомному ядрі кожен нуклон почергово взаємодіє з обмеженою кількістю сусідніх нуклонів. В такій ситуації, два протони та два нейтрони часто утворюють стійку обособлену групу (α-частинку), елементи якої взаємодіють між собою набагато частіше аніж з рештою нуклонів. А це означає, що сила взаємодії обособленої α-частинки з рештою нуклонів атомного ядра суттєво зменшується. При цьому існує певна ймовірність того, що постійно діючі сили електростатичного відштовхування однойменних зарядів, можуть викинути обособлену α-частинку за межі ядра.
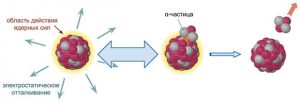
Мал.206. Коли сила взаємодії обособленої α-частинки з рештою нуклонів атомного ядра суттєво зменшується, існує ймовірність того, що ця частинка буде викинутою за межі ядра.
Дослідження показують, що енергія тих α-частинок які вилітають з атомного ядра, значно менша за ту енергію яка необхідна для зворотнього процесу, тобто для повернення α-частинки до складу відповідного ядра. Наприклад енергія тієї α-частинки яка вилітає з ядра атома урану-238 становить 4МеВ. Для повернення ж цієї частинки та відновлення ядра урану, потрібна енергія 30МеВ. Пояснюючи даний факт, говорять про так званий тунельний ефект.
Тунельний ефект, це явище, суть якого полягає в тому, що з певною ймовірністю складова мікрочастинка квантової системи (наприклад атомного ядра), може вийти за межі цієї системи навіть в тому випадку, коли енергія частинки значно менша за висоту потенціального бар’єру системи. Висотою потенціального бар’єру квантової системи називають ту мінімальну кількість енергії, яка згідно з законами класичної фізики, забезпечує вихід даної мікрочастинки за межі відповідної системи. Скажімо, для α-частинки, висота потенціального бар’єру в ядрі урону-238 становить 30МеВ.
Тунельний ефект є сугубо квантовим явищем, яке не можливо пояснити з точки зору законів класичної фізики. Це явище є прямим наслідком факту того, що мікрочастинки мають певні корпускулярно-хвильові властивості.
Говорячи про альфа-розпад, потрібно додати, що те ядро яке утворюється в процесі цього розпаду знаходиться в енергетично збудженому стані. Результатом переходу цього ядра від енергетично збудженого до нормального (стаціонарного) стану, є випромінювання відповідного кванту електромагнітної енергії – γ-фотона (γ-кванту). А це означає, що процес альфа-розпаду супроводжується випромінюванням як α-частинки так і γ-фотона. При цьому дослідження показують, що спектр тих фотонів які випромінюються при альфа-розпаді є лінійчатим. Даний факт безумовно вказує на квантовий характер тих процесів які відбуваються в атомному ядрі.
Бета-розпадом називають таке спонтанне радіоактивне перетворення атомного ядра, яке є результатом випромінюванням β-частинки (0β–1). Оскільки β-частинка має практично нульову масу і заряд –1е, то в процесі бета-розпаду, масове число дочірнього ядра залишається незмінним, а його зарядове число (порядковий номер атома) збільшується на одиницю. Наприклад: 3Н+1 – 0β–1 → 3Не+2; 40К+19 – 0β–1 → 40Са+20. Бета-розпад характерний для тих атомних ядер в яких кількість нейтронів є незбалансовано великою (зазвичай Nn > 1,5Np). Період напіврозпаду бета-радіоактивних ізотопів становить від 0,025с для 12Ве5 до 4·1012років для 187Rе75.
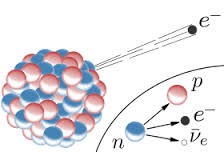
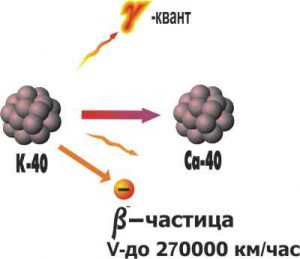
Мал.207. В процесі бета-розпаду, радіоактивне ядро випромінює β-частину, γ-квант та нейтріно.
Гранично стисло та спрощено пояснюючи причини бета-розпаду, можна сказати наступне. Дослідження показують, що цілісність атомного ядра на 99,9% забезпечується протонно-нейтронними взаємодіями. А це означає, що в тих атомних ядрах де кількість нейтронів незбалансовано велика, деякі з них часто залишаються так би мовити «бездоглядними», тобто такими, які в певні проміжки часу не приймають активної участі в міжнуклонних взаємодіях. А оскільки нейтрони – частинки радіоактивні, то існує ймовірність того, що в момент простою, вони можуть розпадатися: 1n0 → 1p+1 + 0e–1 . При цьому, той електрон який утворюється при розпаді нейтрона, у повній відповідності з законами квантової механіки, з шаленою швидкістю вилітає за межі атомного ядра.
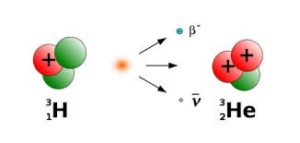
Мал.208. Якщо кількість нейтронів в атомному ядрі незбалансовано велика, то існує ймовірність розпаду одного з цих нейтронів.
Дослідження показують, що енергія β-частинки, завжди менша за різницю тих енергій які має відповідне атомне ядро до та після бета-розпаду. Аналізуючи даний факт, швейцарський фізик Вольфганг Паулі в 1930 році, висунув гіпотезу про те, що при бета-розпаді, одночасно з β-частинкою випромінюється ще одна елементарна частинка. Цю частинку назвали нейтріно. Нейтріно (позначається ν), це елементарна електронейтральна частинка з практично нульовою масою спокою (mν≈5·10–5me) та фантастично великою проникливою здатністю. Нейтріно практично не взаємодіє з речовиною і тому факт існування цих частинок був підтверджений лише в 1956 році.
Оскільки після бета розпаду, дочірнє атомне ядро перебуває в стані енергетичного збудження, то результатом переходу цього ядра до нормального стану є випромінювання відповідного γ-фотона (γ-кванта). Лінійчатий спектр цих фотонів певним чином відображає ті квантові процеси що відбуваються у відповідному атомному ядрі.
Альфа та бета розпади є найбільш поширеними та загально відомими видами радіоактивного розпаду. Однак в природних та штучних умовах можуть відбуватися й інші радіоактивні розпади, зокрема нейтронний розпад. Нейтронним розпадом називають таке спонтанне радіоактивне перетворення атомного ядра, яке є результатом випромінювання нейтрона (1n0). Оскільки маса нейтрона дорівнює одиниці, а заряд – нулю, то в процесі нейтронного розпаду, масове число дочірнього ядра зменшується на одиницю, а його зарядове число (порядковий номер атома) залишається незмінним. Наприклад: 5Не+2 – 1n0 → 4He+2 ; 9Li+3 – 1n0 → 8Li+3 .
Нейтронний розпад характерний для легких атомних ядер з великим надлишком нейтронів. Однак під дією сторонніх чинників, зокрема γ-фотонів, нейтронно радіоактивними можуть бути і стабільні атомні ядра з цілком збалансованою кількістю нейтронів. Наприклад стабільні ядра атома йод-127, під дією γ-радіації випромінюють нейтрони. Як і альфа та бета розпади, нейтронний розпад супроводжується не лише вильотом відповідної частинки, а й випромінюванням γ-фотона.
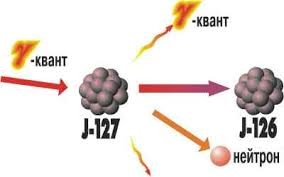
Мал.209. В процесі нейтронного розпаду, радіоактивне ядро випромінює нейтрон та γ-квант.
В §51 ми говорили про те, що в надрах зірок, при надвисоких температурах відбуваються цикли термоядерних реакцій, в процесі яких синтезуються все більш і більш важкі атомні ядра. Говорили і про те, що в надмасивних атомних ядрах (М˃208) міститься така велика кількість надлишкової енергії, що навіть потужні ядерні сили не можуть утримати відповідне ядро від розпаду.
Зазвичай, період напіврозпаду надмасивних атомних ядер є відносно малим. Однак існує група атомів, період напіврозпаду яких вимірюється мільярдами років. До числа таких радіоактивних довгожителів відносяться торій-232 (Т=13,9·109років), уран-238 (Т=4,5·109років) та уран-235 (Т=0,71·109років). Поступово розпадаючись, ці атоми утворюють певні радіоактивні родини. Радіоактивною родиною (радіоактивним рядом) називають таку послідовність взаємопов’язаних радіоактивних атомів, в якій кожний наступний атом утворюється в результаті альфа або бета розпаду попереднього атома. Наприклад, поступово розпадаючись, атоми торію-232 утворюють наступний радіоактивний ряд.
- 232Тh+90 – 4α+2 → 228Ra+88 (T = 13,9·109 років)
- 228Ra+88 – 0β–1 → 228As+89 (T = 6,7 років)
- 228As+89 – 0β–1 → 228Th+90 (T = 6,13 годин)
- 228Тh+90 – 4α+2 → 224Ra+88 (T = 1,9 років)
- 224Ra+88 – 4α+2 → 220Rn+86 (T = 3,64 доби)
- 220Rn+86 – 4α+2 → 216Po+84 (T = 51,4c)
- 216Po+84 – 4α+2 → 212Pb+82 (T = 0,158c)
- 212Pb+82 – 0β–1 → 212Bi+83 (T = 10,6 годин)
- 212Bi+83 – 0β–1 → 212Po+84 (T = 60,5 хвилин)
- 212Po+84 – 4α+2 → 208Pb+82 (T = 3·10–7с)
- 208Pb+82 – стабільний.
Потрібно зауважити, що в силу ймовірнісного характеру тих процесів які відбуваються в атомному ядрі, деякі етапи радіоактивного розпаду можуть відбуватись різними шляхами. Наприклад, перетворення 216Ро+84 в 212Ві+83, може відбуватись наступним чином:
- 216Ро+84 – 0β–1 → 216Аt+85 (T = 0,158c)
- 216At+85 – 4α+2 → 212Bi+83 (T = 3·10-4c).
Якщо ж говорити про радіоактивні родини урану-238 та урану-235, то їх можна описати наступною, найбільш ймовірною послідовністю розпадів:
238U+92→α→β→β→α→α→α→α→α→β→β→α→β→β→α→206Pb+82 ;
235U+92→α→β→α→β→α→α→α→α→β→β→α→207Pb+82.
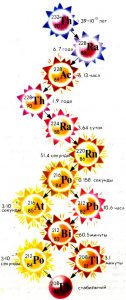
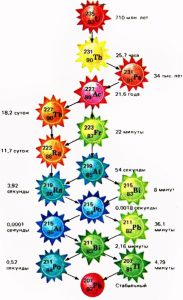
Мал.210. Радіоактивні роди торію-232 та урану-235.
З плином часу, в кожній радіоактивній родині встановлюється так звана вікова рівновага, тобто такий динамічний стан системи при якому швидкість утворення та швидкість розпаду проміжних членів родини є однаковою. В стані вікової рівноваги, кількість кожного проміжного ізотопу в наявній суміші радіоактивних елементів залишається незмінною. Однак, якщо говорити про масове співвідношення між базовим (материнським) та кінцевим ізотопами радіоактивної суміші, то з плином часу це співвідношення змінюється. А знаючи це співвідношення можна визначити вік відповідного об’єкту, скажімо гірської породи. Подібні методи визначення віку об’єктів називають радіоізотопним датуванням.
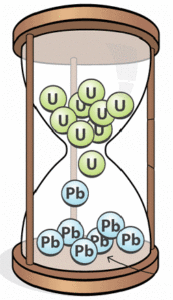
Мал.211. Знаючи співвідношення між масою материнського та кінцевого ізотопів, можна достатньо точно визначити вік відповідного об’єкту.
В Природі, окрім трьох вище згаданих радіоактивних родин, можуть існувати й інші подібні родини. Наприклад родина нептунія-237. Період напіврозпаду нептунія-237 є відносно малим (Т=2,14∙106 років). Тому, за час існування Землі, цей ізотоп практично повністю розпався. Однак його можна створити штучно. При цьому дослідження показують, що радіоактивний ряд нептунія-237 описується наступною послідовністю розпадів:
237Np+93 →α→β→α→α→β→α→α→α→β→α→β→209Ві+83.
До речі, вісмут-209 є найважчим практично стабільним ізотопом. Ми говоримо «практично стабільним» тому, що період його напіврозпаду 2·1019 років. А це в півтора мільярди разів більше за вік Всесвіту. Загалом же, окрім вісмуту-209 відомо ще 26 його ізотопів. При цьому всі вони є надзвичайно радіоактивними (період їх напіврозпаду не перевищує декількох діб).
Контрольні запитання.
- Як змінюється масове та зарядове число ядра при: а) альфа-розпаді, б) бета-розпаді, в) нейтронному розпаді?
- Чому альфа, бета та нейтронний розпади супроводжуються випромінюванням γ-фотона? Про що говорить факт того, що спектр цих фотонів є лінійчатим?
- Спрощено поясніть механізм альфа-розпаду.
- Які факти вказують на існування того явища яке називають тунельним ефектом?
- Спрощено поясніть механізм бета-розпаду.
- Які факти вказують на існування нейтріно?
- В чому суть радіоізотопного датування?
Вправа 52.
- Запишіть ядерну реакцію для кожного етапу заданої послідовності:
238U+92→α→β→β→α→α→α→α→α→β→β→α→β→β→α→206Pb+82.
- Запишіть ядерну реакцію для кожного етапу заданої послідовності:
235U+92→α→β→α→β→α→α→α→α→β→β→α→207Pb+82.
- Запишіть ядерну реакцію для кожного етапу заданої послідовності:
237Np+93 →α→β→α→α→β→α→α→α→β→α→β→209Ві+83.
.
§53. Ядерні реакції поділу. Їх військове та цивільне застосування.
Як відомо, ядра урану-238 та урану-235 мають такий великий надлишок енергії, який робить ці ядра енергетично нестійкими, тобто такими які рано чи пізно розпадаються. При цьому можливі два варіанти такого розпаду. 1) Поступовий природний розпад, в процесі якого уран, випромінюючи α- та β- частинки розпадається до стабільних ізотопів свинцю. Цей поступовий розпад називають природною радіоактивністю. 2) Штучно спровокований розпад при якому ядро урану, в процесі взаємодії з стороннім нейтроном розпадається на дві приблизно рівні частини. Такий розпад називають ядерними реакціями поділу. Про етапи природного радіоактивного розпаду урану, ми говорили в попередньому параграфі. Тому наразі мова піде про ядерні реакції поділу.
Ядерними реакціями поділу називають такі ядерні реакції при яких надмасивні атомні ядра в процесі взаємодії з сторонніми нейтронами, діляться на дві приблизно рівні частини та декілька нових нейтронів (мал.212а). Характерною та з практичної точки зору надважливою особливістю ядерних реакцій поділу є факт того, що в процесі цих реакцій виділяються два або три (в середньому 2,5) нових нейтрона, які можуть зініціювати нові цикли реакцій поділу. А це означає, що ядерні реакції поділу можуть набувати ланцюгового характеру (мал.212б). Ланцюговими ядерними реакціями називають такі само відновлювальні ядерні реакції поділу, продукти яких спричиняють нові цикли аналогічних реакцій.
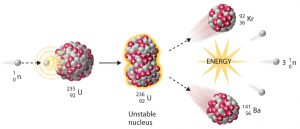
Мал.212. Загальна схема ядерної реакції поділу та ланцюгової реакції поділу.
Однією з основних характеристик ланцюгової ядерної реакції є коефіцієнт розмноження нейтронів – величина, яка дорівнює відношенню числа результативно прореагувавших нейтронів на даному етапі ланцюгової реакції (Ni) до їх числа на попередньому етапі цієї реакції (Ni–1): k = Ni/Ni–1.
Якщо виходити з того, що в середньому продуктами поділу кожного ядра урану є 2,5 нових нейтрона, то можна очікувати, що для відповідної ланцюгової реакції, коефіцієнт розмноження нейтронів має становити 2,5. Однак фактично, в подібних реакціях цей коефіцієнт завжди менший за максимально можливу величину. Менший по перше тому, що певна кількість нейтронів не провзаємодіявши з ядрами урану вилітає за межі уранового тіла. По друге, далеко не кожний акт взаємодії нейтрона з ядром урану, призводить до реакції його поділу. Скажімо, ядра урану-238 діляться лише при взаємодії з швидкими нейтронами, тобто такими нейтронами енергія яких більша за 1,8МеВ. Більша ж частина тих нейтронів які виділяються при реакціях поділу є повільними. Крім цього, ймовірність результативної взаємодії швидкого нейтрона з ядром урану-238 є відносно малою. Нагадаємо, цю ймовірність характеризує величина яка називається перерізом ядерної реакції (σ). Для урану-238 σ=0,3барн. Зважаючи на ці та деякі інші обставини можна з впевненістю стверджувати, що для природного урану (99,3%U-238 + 0,7%U-235) коефіцієнт розмноження нейтронів практично завжди менший за одиницю.
Втім, якщо говорити про уран-235, то його ядра діляться як швидкими так і повільними нейтронами. При цьому, при взаємодії з повільними нейтронами, переріз ядерної реакції урану-235 є дуже великим: σ=582барн. А це означає що для урану-235 можна організувати процес для якого коефіцієнт розмноження нейтронів може бути суттєво більшим за одиницю (k ˃ 1).
Ситуація при якій k˃1 реалізується в приладі, який називається атомною (ядерною) бомбою. Принцип дії атомної бомби грунтується на тому, що для кожного виду ядерної вибухівки існує так звана критична маса (mкр), тобто така мінімальна кількість ядерної вибухівки для якої можлива незгасаюча (k˃1) ланцюгова реакція поділу. Умовно кажучи, якщо у вашій валізі знаходиться закритична маса ядерної вибухівки (m ˃ mкр), то в будь який момент ця валіза може вибухнути. Вибухнути тому, що в навколишньому просторі постійно виникають та зникають різноманітні елементарні частинки, в тому числі і нейтрони. І якщо такий нейтрон потрапить у вашу валізу, то неминуче спровокує енергетично зростаючу (k ˃ 1) ланцюгову ядерну реакцію, яка й призведе до відповідного вибуху. Якщо ж маса ядерної вибухівки менша за критичну (m ˂ mкр), то будь яка спровокована зовнішнім нейтроном ланцюгова реакція, буде згасаючою (k˂1), а відповідно такою, що не призведе до ядерного вибуху.
Величина критичної маси ядерної вибухівки залежить від багатьох обставин. Зокрема від сорту вибухівки, її густини, геометричної форми, наявності домішок, режиму опромінювання, тощо. Наприклад, для виготовленого в формі кулі урану-235 mкр=48кг; для урану-233 mкр=16кг; для плутонію-239 mкр=10кг. Однак, критичну масу ядерної вибухівки можна суттєво зменшити, якщо цю вибухівку оточити шаром нейтронно відбивної речовини, наприклад берилію.
Загальний устрій (мал.213) та принцип дії атомної бомби досить простий. В міцному герметичному корпусі знаходиться звичайна хімічна вибухівка та не менше двох розділених ядерних зарядів, маса кожного з яких менша за критичну. В потрібний момент, детонатор підпалює хімічну вибухівку, яка швидко з’єднує частини ядерної вибухівки в єдине ціле та інтенсивно опромінює її потоком нейтронів. При цьому, в процесі інтенсивних ланцюгових ядерних реакцій поділу, за мікросекунди виділяється величезна кількість енергії яка і спричиняє відповідний ядерний вибух.

Мал.213. Схема загального устрою атомної бомби.
Ви можете запитати: «Якщо атомна бомба має такий простий та загально відомий устрій, то чому ж лише деякі держави володіють секретом її виготовлення?» А цей секрет полягає в тому, що серед тих матеріалів які зустрічаються в природних умовах Землі, в якості ядерної вибухівки можна використати лише уран-235. А як відомо, вміст цього ізотопа в природньому урані всього 0,7%. Технологія ж відділення урану235 від урану-238 настільки складна та енергозатратна, що може бути реалізованою лише невеликою кількістю економічно та технологічно потужних держав.
Втім, існує ще один набагато легший, простіший та дешевший спосіб отримання якісної ядерної вибухівки. Цей спосіб базується на факті того, що ядра урану-238 при поглинанні повільних нейтронів (Е ˂ 1,8МеВ) перетворюються на ядра урану-239. А ті в свою чергу, послідовно випромінюючи дві β-частинки, перетворюються на ядра плутонію-239:
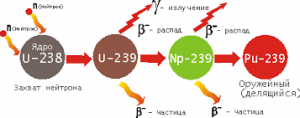
Плутоній-239 є відносно стабільним (Т=24360 років) трансурановим елементом, який подібно до урану-235 діллиться як швидкими так і повільними нейтронами. При цьому, продуктами його поділу в середньому є 2,92 нові нейтрони, які з великою ймовірністю (σ=742барн) результативно взаємодіють з іншими ядрами плутонію та ділять їх. По суті це означає, що плутоній-239 є суттєво кращою ядерною вибухівкою аніж уран-235. Тому практично всі сучасні ядерні бомби є плутонієвими.
В промислових масштабах, плутоній-239 відносно легко добувають з тих відходів які отримують в процесі роботи ядерних реакторів. Зважаючи на ці обставини, цивілізовані, демократичні суспільства з обгрунтованою пильністю відносяться і мають відноситись до розповсюдження ядерних технологій, в тому числі і тих, які прийнято називати «мирним атомом». Адже ядерні відходи цілком мирних атомних електростанцій, відносно легко перетворюються на ядерні та термоядерні бомби. Тому коли ви чуєте як деякі «доброзичливці», проливаючи крокодилячі сльози відстоюють право неадекватних режимів на мирний атом, то не забувайте і про те, що цей мирний атом легко стає немирним.
По суті атомна бомба є тим приладом в якому енергія неконтрольованих ядерних реакцій поділу, перетворюється на енергію вибуху та так званих вражаючих факторів (ударна хвиля, світлове випромінювання проникаюча радіація). Якщо ж говорити про контрольовані ядерні реакції поділу, тобто ті реакції при яких коефіцієнт розмноження нейтронів дорівнює одиниці (k=1), то вони застосовуються в ядерних реакторах. Ядерний реактор, це прилад, в якому енергія контрольованих ланцюгових ядерних реакцій поділу, дозовано претворюється в теплову енергію, яка за необхідності перетворюється в механічну роботу та енергію електричного струму.
Ядерний реактор (мал.214) прерставляє собою міцний залізобетонний або сталевий корпус, внутрішня поверхня якого покрита шаром нейтронно відбивного матеріалу. Всередині реактора знаходяться так звані твели (тепловиділяючі елементи), які представляють собою товстостінні труби або суцільні стержні виготовлені зі збагаченого урану (урану, в якому частка ізотопу уран-235 становить не 0,7% , а близько 5%). Внутрішній простір ядерного реактора заповнено рідиною, яка зазвичай виконує функції як теплоносія так і сповільнювача нейтронів. Крім цього, до числа основних елементів ядерного реактора відносяться рухомі стержні які виготовлені з нейтронно поглинаючого матеріалу (графіт, кадмій, бор, гафній).
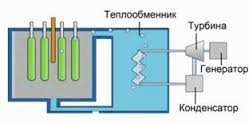
Мал.214. Схема загального устрою ядерного реактора.
Принцип дії даної системи полягає в наступному. Запускаючи ядерний реактор, нейтронно поглинаючі стержні піднімають на максимальну висоту та опромінюють твели сторонніми нейтронами, які й ініціюють ланцюгові ядерні реакції поділу. В процесі цих реакцій виділяються як швидкі так і повільні нейтрони. При цьому повільні нейтрони з великою ймовірністю результативно взаємодіють як з ядрами урану-235 (ділять ці ядра з виділенням нових нейтронів) так і з ядрами урану-238 (поглинаються цими ядрами та спричиняють їх перетворення в ядра плутонію-239). Ймовірність же результативної ядерної взаємодії швидких нейтронів є відносно малою. Тому переважна більшість швидких нейтронів вилітає за межі твелу та потрапляє в нейтронно гальмуюче середовище. Цим середовищем може бути як сам теплоносій, так і окремий матеріал (зокрема графіт). Втрачаючи енергію, швидкі нейтрони стають повільними. Більша частина цих вже повільних нейтронів знову потрапляють в навколишні твели та спричиняють нові результативні взаємодії з ядрами урану-235, урану-238 та плутонію-239. Певна ж частина тих нейтронів які знаходяться в міжтвеловому просторі потрапляє в нейтронно поглинаючі стержні та безповоротно виключається з кругообігу ядерних реакцій. А це означає, що піднімаючи або опускаючи нейтронно поглинаючі стержні, можна регулювати кількість наявних в реакторі нейтронів. Регулювати так, щоб коефіцієнт розмноження нейтронів дорівнював одиниці (k=1).
Таким чином, в ядерному реакторі відбуваються наступні базові процеси: 1) енергогенеруючі реакції поділу ядер урану-235 та плутонію-239; 2) реакції перетворення ядер урану-238 в ядра плутонію-239; 3) ефективне регулювання інтенсивності ядерних реакцій.
Та енергія яка виділяється в процесі ядерних реакцій поділу (80% цієї енергії складає кінетична енергія ядер-осколків, 20% – енергія нейтронів та електромагнітного випромінювання), призводить до того, що твели реактора нагріваються до 500 – 600ºС. Нагріті твели в свою чергу нагрівають навколишній теплоносій. При цьому, постійно циркулюючий теплоносій, з одного боку забезпечує охолодження твелів, а з іншого – передачу генерованої теплової енергії іншим елементам системи: вторинний теплоносій – парова турбіна – електрогенератор.
Потрібно зауважити, що ядерні реакції поділу відносяться до числа найбільш енергоефективних реакцій. Адже при поділі одного ядра атома урану виділяється близько 200МеВ енергії. При цьому 80% цієї енергії є зручною для використання та подальшої трансформації, енергією інтенсивного теплового руху масивних осколків ядерної реакції. В перекладі на мову звичайних хімічних джерел енергії, це означає, що при поділі тих ядер які містяться в 1кг урану можна отримати стільки ж енергії, скільки її виділяється при повному згоранні 250 тон кам’яного вугілля.
Говорячи про атомну енергетику загалом, та ядерні реактори зокрема, важко оминути проблему екологічної та ядерної безпеки. Втім, про цю проблему ми поговоримо в наступному параграфі.
Контрольні запитання.
- Назвіть можливі варіанти розпаду ядер урану.
- Що називають коефіцієнтом розмноження нейтронів і від чого залежить величина цього коефіцієнту?
- Чому для урану-238, коефіцієнт розмноження нейтронів завжди менший за одиницю?
- Поясніть загальний устрій та принцип дії атомної бомби.
- В чому секрет складності атомної бомби?
- Чому цивілізовані, демократичні держави протидіють безконтрольному розповсюдженню так званих «мирних» ядерних технологій.
- Поясніть загальний устрій та принцип дії ядерного реактора.
- Назвіть ті базові процеси що відбуваються в ядерному реакторі.
Вправа 53.
- При поділі одного ядра 235U92 на два осколки виділяється 200МеВ енергії. Яка кількість енергії виділиться при «спалюванні» 11г цього ізотопу? Яку кількість кам’яного вугілля треба спалити для отримання такої ж кількості енергії?
- Атомна електростанція потужністю 1000МВт має ККД 20%. Яка маса урану витрачається за добу? Вважати, що при кожному поділі ядра урану виділяється 200МеВ енергії.
- Який ККД атомної електростанції потужністю 5·108Вт, якщо за рік було витрачено 965кг урану?
- При поділі одного атома урану-235 на два осколки виділяється близько 3·10–11Дж енергії. Скільки бензину потрібно спалити для того, щоб отримати таку ж кількість енергії як при поділі 100г урану?
.
§54. Радіація: джерела, дози, ризики.
Термін радіація (від лат. radiatio – випромінювання, сяйво) має широкий спектр значень: сонячна радіація, ультрафіолетова радіація, інфрачервона радіація, радіохвильова радіація, тощо. Однак в науковій та побутовій практиці, цим терміном позначають так зване іонізуюче випромінювання, тобто те випромінювання що іонізує молекули повітря. В загальному випадку до числа іонізуючих випромінювань (радіації) відносять: альфа-випромінювання, бета-випромінювання, гама-випромінювання, рентгенівське випромінювання, жорстке ультрафіолетове випромінювання, нейтронне випромінювання та будь яке інше випромінювання, частинки якого здатні іонізувати молекули повітря, тобто здатні вибивати з цих молекул електрони. При цьому найбільш розповсюдженими видами радіації прийнято вважати альфа-, бета- та гама- випромінювання. Загалом же, класифікаційну структуру іонізуючих випромінювань (радіації) можна представити у вигляді наступної схеми:

Однією з основних характеристик іонізуючого випромінювання є його прониклива здатність, тобто та відстань на яку можуть розповсюджуватись частинки даного випромінювання в тому чи іншому середовищі. Ясно, що прониклива здатність іонізуючого випромінювання залежить як від параметрів частинок самого випромінювання (їх маси, заряду, енергії, тощо) так і від властивостей того середовища в якому ці частинки розповсюджуються (його густини, агрегатного стану, атомарного складу, тощо). Зазвичай, прониклива здатність електронейтральних частинок набагато більша аніж частинок заряджених.
Найменшу проникливу здатність мають масивні, позитивно заряджені α-частинки. Для них, тонкий аркуш паперу чи поверхневий шар шкіри є практично непереборною перешкодою. Тому зовнішня альфа-радіація не представляє для людини серйозної загрози. Ця загроза з’являється тоді, коли джерело α-частинок з повітрям, харчами чи через відкриті рани потрапляє всередину організму. Прониклива здатність легких, негативно заряджених β-частинок є значно більшою. Ці частинки можуть проникати в організм людини на глибину до одного сантиметра. Тому для захисту від зовнішньої бета-радіації, потрібно застосовувати спеціальний одяг. Якщо ж говорити про гама-випромінювання та нейтронне випромінювання, то їх прониклива здатність є найбільшою. Ці види випромінювань здатні проникати навіть через стіни будинків. І в цьому сенсі, нейтронне та гама випромінювання є найбільш небезпечними. Що правда в природних умовах, нейтронне випромінювання зустрічається рідко. Натомість гама-випромінювання є найбільш розповсюдженим видом радіації. Адже γ-кванти випромінюються практично при всіх ядерних перетвореннях, в тому числі при альфа-, бета- та нейтронних розпадах.
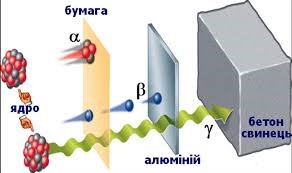
Мал.215. Різні види радіації мають різну проникливу здатність.
Радіація не лише іонізує молекули повітря, а й спричиняє певну біологічну дію. Ця дія полягає в тому, що частинки іонізуючого випромінювання хімічно активізують атоми та молекули організму. При цьому в організмі можуть з’являтися нові хімічні сполуки, в тому числі і шкідливі для нього. Крім цього, іонізуюче випромінювання може руйнувати окремі молекули організму та певні елементи його клітин.
Біологічна дія радіації має дві характерні особливості. Перша полягає в тому, що відносно малі кількості поглинутої організмом енергії випромінювання, можуть призвести до серйозних та навіть смертельних біологічних наслідків. Скажімо, якщо ту радіаційну енергію що є смертельною для організму людини перевести у відповідну кількість теплоти, то її вистачить лише на те щоб нагріти цей організм на 0,001ºС. Втім, дана особливість є досить сумнівною. Адже якщо, наприклад, енергію смертельної для людини кулі перевести в теплоту, то неодмінно з’ясується, що механічна енергія не менш смертельна за енергію радіаційну. Бо енергії смертельної для людини кулі вистачить лише на те, щоб нагріти її організм на все тих же 0,001ºС.
Другою особливістю біологічної дії радіації є те, що біологічні наслідки радіаційного опромінення стають відчутними не відразу, а через певний проміжок часу. Величина цього проміжку залежить від багатьох обставин (дози опромінення, режиму опромінювання, індивідуальних особливостей організму, тощо) і може становити від декількох хвилин до десятків років.
Говорячи про біологічну дію радіації, потрібно особливо підкреслити, що ця дія не є безумовно шкідливою та безумовно небезпечною. Адже всі живі організми завжди перебували, перебувають і будуть перебувати під дією так званого природного радіаційного фону. Тобто тієї постійно діючої радіації, джерелом якої є природні об’єкти та події. При цьому нема жодних вагомих підстав стверджувати, що цей природній радіаційний фон є небезпечним для організму людини та інших живих істот. Звичайно за умови, що інтенсивність цієї природної радіації не є надмірною.
Дослідження показують, що біологічна дія різних видів радіації є суттєво різною. Скажімо, біологічна шкода від альфа-випромінювання приблизно в 20 разів більша за ту шкоду яку спричиняє аналогічна за енергією кількість бета- або гама- випромінювання. Величина, яка показує у скільки разів біологічна дія даного виду радіації більша за біологічну дію аналогічної за енергією кількості гама-випромінювання називається коефіцієнтом відносної біологічної ефективності випромінювання (позначається k). Для основних видів радіації, числові значення цього коефіцієнту є наступними:
– гама-випромінювання k = 1;
– рентгенівське випромінювання k = 1;
– бета-випромінювання k = 1:
– нейтронне випромінювання k = 10;
– альфа випромінювання k = 20.
Потрібно зауважити, що вище наведені значення коефіцієнтів біологічної ефективності випромінювання є певними усередненими величинами. І це закономірно. Адже в межах одного й того ж виду радіації, енергетичні параметри різних частинок можуть бути суттєво різними. Наприклад, максимальна енергія тих β-частинок які вилітають з атомів плюмбум-214 та вісмут-214 відповідно дорівнюють 0,65МеВ та 7,68МеВ. І не важко збагнути, що біологічна дія β-частинок різних енергій може бути суттєво різною. Крім цього, не слід забувати і про те, що біологічні наслідки радіаційного впливу, суттєво залежать від індивідуальних особливостей кожного конкретного організму.
Оцінюючи біологічну дію радіації, зазвичай орієнтуються на такі величини як поглинута та еквівалентна дози випромінювання. Поглинутою дозою випромінювання називають ту кількість енергії іонізуючого випромінювання що поглинається одиницею маси даного тіла.
Позначається: D
Визначальне рівняння: D = E/m, де Е – загальна кількість поглинутої тілом енергії іонізуючого випромінювання; m – маса тіла,
Одиниця вимірювання: [D] = Дж/кг = Гр, грей.
Еквівалентною дозою випромінювання (опромінення) називають ту величину яка дорівнює добутку поглинутої дози випромінювання на коефіцієнт біологічної ефективності цього випромінювання.
Позначається: De
Визначальне рівняння: De = kD
Одиниця вимірювання: [De] = Дж/кг = Зв, зіверт.
Прийнято вважати, що смертельно небезпечною для людини є еквівалентна доза випромінювання 5 Зв/рік.
Застарілою, позасистемною одиницею вимірювання еквівалентної дози випромінювання (опромінення) є бер – біологічний еквівалент рентгена. В побутовій практиці, цю одиницю (бер) часто називають просто «рентген». 1бер = 0,01Зв.
Загалом же, існує велике різноманіття величин які так чи інакше характеризують енергетичні параметри радіації: експозиційна доза, ефективна еквівалентна доза, колективна еквівалентна доза, повна еквівалентна доза, потужність поглинутої дози, потужність експозиційної дози, тощо. Ми не будемо визначати кожну з цих величин. Просто зауважимо, що такі величини існують і що за певних обставин ви можете з ними зустрітись.
Побутує думка, що найбільшу дозу радіації людина отримує від тих джерел які так чи інакше пов’язані з атомною енергетикою. За деякими винятками, ця думка не має нічого спільного з дійсністю. Її хибність з усією очевидністю спростовують факти об’єктивних досліджень. А ці факти є наступними. За даними постійно діючої при ООН наукової комісії по дії атомної радіації, основними джерелами тієї річної дози радіаційного опромінення яку отримує середньо статистичний житель Землі, є:
- Та радіація яку отримує середньо статистичний землянин від природнього радіаційного фону, тобто від природних, постійно діючих джерел (розпад існуючих на Землі радіоактивних ізотопів, сонячна радіація, космічна радіація, тощо). В загальному радіаційному балансі, частка цієї дози опромінення становить 82,6% або 2 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всього комплексом тих джерел які пов’язані з атомною енергетикою (видобуток урану, його збагачення виготовлення твелів, експлуатація ядерних реакторів, переробка та зберігання ядерних відходів, проведення випробувань ядерної та термоядерної зброї, тощо). Сумарна доля цих джерел в загальному радіаційному балансі становить 0,04% або 0,001 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всієї сукупності техногенних джерел не пов’язаних з атомною енергетикою (шкідливі відходи різноманітних виробництв, той дим який викидають в атмосферу наші заводи, автомобілі, тощо). Сумарна доля цих джерел становить 0,8% або 0,02 мЗв/рік.
- Та радіація яку отримує середньо статистичний житель Землі від всієї сукупності медичних джерел (рентгенівська, флюорографічна та радіоізотопна діагностика, променева терапія, радіохірургія, тощо). В загальному балансі радіаційного навантаження, доля медичних джерел становить 16,5% або 0,4 мЗв/рік.
*) Дані факти наведені в книзі “Радіація: дози, ефекти, ризики“, яка представляє собою узагальнення тих фактів, що були зібрані Науковим комітетом по дії атомної радіації при ООН, за 30 років його діяльності. (Москва. Видавництво “Мир”, 1990).

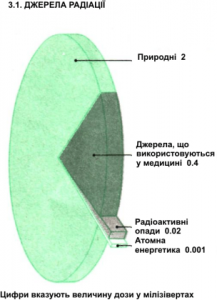
Мал.216. Оцінюючи ті ризики які пов’язані з атомною енергетикою, потрібно послуговуватись фактами, а не домислами.
Таким чином, об’єктивні дослідження показують, що найбільшим джерелом тієї радіації яку отримує середньо статистичний житель Землі, є той природний радіаційний фон в якому ми завжди жили, живемо і будемо жити. При цьому половину цієї природної радіації ми отримуємо від атомів хімічно інертного радону (Rn86) та продуктів його радіоактивного розпаду. Радон є складовою частиною повітря і тому потрапляє в наш організм разом з тим повітрям яке ми вдихаємо. А оскільки радон та його дочірні атоми альфа-радіоактивні, то і та біологічна шкода яку спричиняє ця внутрішня альфа-радіація може бути великою. (Нагадаємо, для альфа-випромінювання k=20).
Як це не парадоксально, а фактом залишається те що найпотужнішим джерелом тієї радіації якої ми так панічно боїмося є не атомна енергетика, а наша медицина. Адже середньорічна доза тієї радіації яку отримує середньостатистичний землянин від медичних джерел в 400 разів більша за ту дозу яку він отримує від всієї сукупності джерел пов’язаних з атомною енергетикою. І тим не менше, ми схильні вважати що саме атомна енергетика є основним джерелом радіації.
Звичайно, вище наведені середньостатистичні дані не відображають нюансів кожної окремо взятої ситуації. Скажімо та доза яку отримує конкретна людина від медичних джерел, може вимірюватись як практично нульовою величиною (для тих хто жодного разу не стикався з сучасною медициною) так і тисячами середньорічних доз (для тих хто в процесі лікування раку отримував променеву терапію). Тим не менше, вище наведені узагальнюючі факти, з усією очевидністю вказують на те, що наші фобії відносно екологічної та радіаційної шкідливості атомної енергетики, м’яко кажучи, перебільшені. Об’єктивні факти безумовно доводять, що екологічна шкода від штатно працюючої атомної електростанції в сотні, а то й в тисячі разів менша за ту, яку створюють ті автомобілі що їздять дорогами наших міст.
Інша справа – потенційна небезпечність ядерної енергетики. І в цьому сенсі атомна електростанція, а точніше – її ядерні реактори, дійсно є потенційно небезпечними об’єктами. І ця потенційна небезпечність закладена в самому принципі дії ядерного реактора. Адже забезпечуючи нормальну роботу ядерного реактора, ми маємо постійно підтримувати ситуацію при якій коефіцієнт розмноження нейтронів дорівнює одиниці (k=1). А це означає, що ядерний реактор працює в умовах нестійкої рівноваги: якщо k ˂ 1 – реактор гасне, а якщо k ˃ 1 – вибухає.
Звичайно, проектуючи ядерний реактор, вчені роблять все можливе за для того щоб його робота була безпечною. Однак, як засвідчив досвід Чорнобильської АЕС, не все і не завжди можна врахувати. Хтось щось відімкнув, хтось щось забув, хтось на щось понадіявся, і от результат – ядерна катастрофа. Катастрофа, яка з усією очевидністю засвідчила, що об’єкти атомної енергетики є надзвичайно небезпечними. Однак ця небезпечність не в тому що вони надмірно екологічно шкідливі. А в тому, що вони потенційно небезпечні об’єкти, в тому числі і екологічно небезпечні. А це означає, що проектуючи, будуючи та експлуатуючи об’єкти атомної енергетики, потрібно дотримуватись найжорстокіших норм технологічної дисципліни та техніки безпеки.
Контрольні запитання.
- Як ви думаєте, чому прониклива здатність гама та нейтронного випромінювань є такою великою?
- Які характерні особливості біологічної дії радіації?
- У скільки разів смертельно небезпечна річна доза радіації, більша за усереднену дозу: а) природного радіаційного фону; б) медичної радіації; в) радіації від об’єктів атомної енергетики?
- Яке місце в спектрі природних джерел радіації займає радон? В чому небезпечність його радіоактивності?
- В чому правда і в чому неправда міфу про надзвичайну шкідливість атомної енергетики?
- В чому потенційна небезпечність ядерних реакторів?
- Яку рівновагу називають стійкою; не стійкою; байдужою?
.
§55. Методи спостереження та реєстрації частинок іонізуючого випромінювання.
Розмова про частинки іонізуючого випромінювання буде не повною, якщо не поговорити про ті прилади які дозволяють фіксувати та досліджувати ці частинки. Різноманіття таких приладів можна розділити на дві групи: прилади які реєструють частинки іонізуючого випромінювання та прилади які фіксують траєкторію руху цих частинок. Стисло пояснюючи загальний устрій та принцип дії цих приладів можна сказати наступне.
- Прилади які реєструють частинки іонізуючого випромінювання.
Лічильник Гейгера (лічильник Гейгера-Мюллера) – це прилад, призначений для реєстрації частинок іонізуючого випромінювання (зазвичай гамма та бета випромінювання), принцип дії якого базується на здатності цього випромінювання іонізувати молекули газу (мал.217). Основним елементом лічильника Гейгера є іонізаційна камера, яка представляє собою герметичну трубку в якій знаходяться два електроди: внутрішня струмопровідна поверхня трубки – катод, та металева дротина – анод. Ці електроди перебувають під необхідно високою напругою та включені в коло електронного лічильного механізму. Принцип дії цієї системи полягає в наступному. При потраплянні частинки іонізуючого випромінювання всередину лічильника, ця частинка іонізує молекули наявного в лічильнику газу (зазвичай інертного). При цьому, в результаті ударної іонізації газу, між електродами проскакує іскровий імпульс, який і фіксується лічильним механізмом.
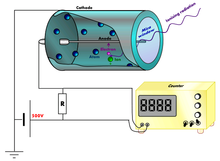
Мал.217. Схема загального устрою лічильника Гейгера.
Сцинтиляційний лічильник – це прилад, призначений для реєстрації частинок іонізуючого випромінювання, принцип дії якого базується на здатності цього випромінювання спричиняти люмінесцентне світіння певних матеріалів. Основним елементом сцинтиляційного лічильника є спеціальний люмінісцируючий екран. Якщо на цей екран потрапляє частинка іонізуючого випромінювання, то у відповідному місці відбувається локальний оптичний мікро спалах (сцинтиляція). Цей спалах можна зафіксувати як візуально так і за допомогою спеціальних лічильних систем.
Прилад в якому сцинтиляційні спалахи фіксуються візуально називається спінтарископом. Простий спінтарископ (мал.218а) представляє собою корпус на дні якого знаходиться вкритий сірчаним цинком екран. Над екраном закріплена голка на вістрі якої знаходиться крупинка радіоактивної речовини. У верхній частині корпусу знаходиться оптичний окуляр, який фокусується на екрані і через який спостерігаються ті люмінесцентні спалахи, що виникають під дією іонізуючого випромінювання. Простий (мал.218а), а згодом і вдосконалений (мал218б) спінтарископ був тим приладом, за допомогою якого Резерфорд зробив свої найвидатніші відкриття: відкрив та дослідив альфа- і бета- випромінювання; з’ясував внутрішній устрій атома; відкрив протон, тощо.
В сучасних сцинтиляційних лічильниках, слабкі люмінесцентні спалахи за допомогою світловодів передаються на так звані фото помножувачі, які підсилюють світлові спалахи в мільярди разів.
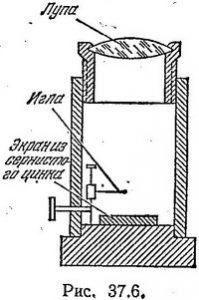

Мал.218. Деякі приклади сцинтиляційних лічильників.
Напівпровідниковий (кристалічний) лічильник – це прилад, призначений для реєстрації частинок іонізуючого випромінювання, принцип дії якого базується на здатності цього випромінювання іонізувати атоми кристалічних структур з утворенням пари носіїв струму (вільний електрон-дірка). Основним елементом напівпровідникового лічильника є спеціальна напівпровідникова пластинка з великою роботою виходу електронів (СdS; ZnS; AgCl), яка включена в коло електронного лічильного механізму. Під дією частинок іонізуючого випромінювання, в цій напівпровідниковій пластині виникає певна кількість носіїв струму. При цьому в колі електронного лічильника проходить відповідний електричний імпульс, який і фіксується цим лічильником. Напівпровідникові лічильники, прості та надійні в експлуатації, мають відносно низьку вартість, малі розміри та достатньо високу чутливість. Тому ці лічильники мають широке застосування в сучасній військово-побутовій практиці.
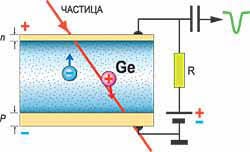
Мал.219. Схема загального устрою напівпровідникового лічильника.
- Прилади які фіксують траєкторію руху частинок іонізуючого випромінювання. Принцип дії більшості тих приладів які фіксують траєкторію руху частинок іонізуючого випромінювання, базується на тому, що ці частинки пролітаючи через метастабільне середовище залишають в ньому візуально видимий слід. Прикладами метастабільного стану речовини є перенагріта або переохолоджена рідина, перенагрітий або переохолоджений пар, тощо.
Камера Вільсона – це прилад, призначений для візуалізації траєкторії руху частинок іонізуючого випромінювання, принцип дії якого базується на тому, що відповідні частинки, пролітуючи через переохолоджений (перенасичений) пар, залишають слід з крапельок конденсованої вологи. Основними елементами камери Вільсона є заповнений газопаровою сумішшю циліндр та рухомий поршень (мал.220а). При різкому збільшенні об’єму робочої камери, той пар який в ній знаходиться різко охолоджується і на певний короткий проміжок часу (0,1с …0,2с) стає перенасиченим. І якщо в цей момент в камеру потрапляє частинка іонізуючого випромінювання, то в процесі свого руху, вона іонізує ті молекули які зустрічаються на її шляху. При цьому, виникаючі іони стають центрами конденсації перенасиченого пару. А це означає, що траєкторія руху досліджуваної частинки буде позначена шлейфом крапельок конденсованої вологи.
Одним з недоліків камери Вільсона є те, що в ній стан перенасиченості пару підтримується на протязі короткого проміжку часу (0,1 – 0,2с). Крім цього, густина газопарової суміші є відносно малою і тому камера Вільсона зазвичай фіксує лише фрагмент траєкторії руху досліджуваної частинки.
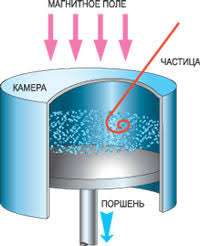
Мал.220. Схема загального устрою камери Вільсона та бульбашкової камери.
Бульбашкова камера – це прилад, призначений для візуалізації траєкторії руху частинок іонізуючого випромінювання, принцип дії якого базується на тому, що відповідні частинки, пролітуючи через перегріту рідину, залишають в ній слід з бульбашок пару цієї рідини (мал.220б). По суті, устрій та принцип дії бульбашкової камери і камери Вільсона є аналогічними. Різниця лише в тому, що робочий об՚єм бульбашкової камери заповнює не газопарова суміш, а очищеною від будь яких домішок рідиною, температура якої близька до температури кипіння. При різкому збільшені об՚єму камери, ця рідина на короткий проміжок часу стає перегрітою, тобто такою, що знаходиться при температурі більшій за температуру кипіння. Це пояснюється тим, що при зменшенні тиску, температура кипіння рідини зменшується. А оскільки в очищеній рідині практично відсутні центри конденсації пару (центри утворення бульбашок), то на певний короткий час ця рідина стає перегрітою. І якщо в цей момент через перегріту рідину пролітатиме частинка іонізуючого випромінювання, то траєкторія її руху буде позначена шлейфом дрідних бульбашок: частинка іонізує молекули рідини, при цьому утворені іони стають центрами закипання перегрітої рідини, тобто центрами утворення дрібниш бульбашок.
Головна перевага бульбашкової камери полягає в тому, що густина їх рідини значно більша за густину газу в камері Вільсона. Тому в дульбашковій камері, траєкторія руху досліджуваної частинки є значно коротшою, а відповідно меншими можуть бути і розміри приладу.
Дифузійна камера – це прилад, призначений для візуалізації траєкторії руху частинок іонізуючого випромінювання, принцип дії якого базується на тому, що відповідні частинки, пролітуючи через переохолоджений (перенасичений) пар, залишають слід з крапельок конденсованої вологи. Дифузійна камера є вдосконаленим варіантом камери Вільсона.
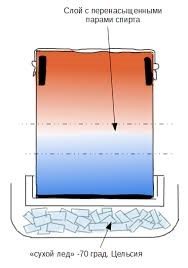
Мал.221. Схема загального устрою дифузійної камери.
На відміну від камери Вільсона, в дифузійній камері, стан перенасиченості пару створюється не за рахунок швидкого розширення газопарової суміші, а за рахунок постійної дифузії молекул пару від нагрітої верхньої поверхні камери до її холодної нижньої поверхні. Це досягається наступним чином. Металеве дно дифузфйної камери охододжується твердою вуглекислотою (сухим льодом) до температури –70ºС. При цьому між верхньою та нижньою частинами камери виникає великий перепад температур. За наявності цього перепаду, верхня частина камери постійно поповнюється парами метилового спирту. Ці пари поступово (дифузійно) опускаються вниз і конденсуються на дні камери. А оскільки перепад температур дуже великий, а швидкість опускання пару дуже мала, то в центральній частині камери утворюється відносно широкий шар (товщиною близько 6см) перенасичених парів спирту. Якщо через цей шар пролітає частинка іонізуючого випромінювання, то її траєкторія руху позначається крапельками конденсованого спирту.
Основна перевага дифузійної камери в тому, що вона є приладом постійної дії. Це означає, що в дифузійній камері стан перенасиченості пару підтримується не 0,1 – 0,2 секунди а практично як завгодно довго.
Фотоемульсійні прилади. Принцип дії фотоемульсійних приладів базується на тому, що в процесі проходження через спеціально підготовлену речовину (фотоемульсію), частинки іонізуючого випромінювання спричиняють певні хімічні перетворення, наприклад розпад молекул AgBr. При цьому, після хімічної обробки речовини (після її проявлення), траєкторія руху частинки стає візуально позначеною.
Контрольні запитання.
- Поясніть будову та принцип дії: а) лічильника Гейгера; б) сцинтиляційного лічильника; в) напівпровідникового лічильника; г) камери Вільсона; д) бульбашкової камери; д) дифузійної камери.
.
§56. Загальні відомості про елементарні частинки.
В сучасній науці нема більш заплутаної теми аніж та, яка стосується елементарних частинок. Достатньо сказати, що за сучасною класифікацією розрізняють понад 350 елементарних частинок. І це не враховуючи декількох десятків тих субелементарних частинок, з яких, як стверджують деякі вчені, складаються самі елементарні частинки. Що ж, давайте гранично стисло та в гранично загальних рисах, поговоримо про те, що прийнято називати елементарними частинками.
Пояснюючи загальний устрій звичних для нас речовинних об’єктів, можна сказати наступне. Речовини складаються з молекул. Молекули складаються з атомів, атоми складаються з атомних ядер та електронів, а атомні ядра складаються з протонів та нейтронів (мал.219). А от протони, нейтрони та електрони – з чого складаються вони? Наскільки нам відомо, ці частинки є елементарними, тобто такими які не складаються з певних більш простих, самостійно існуючих частинок.
Втім, деякі факти переконливо вказують на те, що протони і нейтрони, мають певну внутрішню структуру, яка є результатом тих процесів що постійно відбуваються в цих частинках. Описуючи ці процеси вчені говорять, що протони і нейтрони складаються з певних субелементарних частинок, які прийнято називати кварками. Однак питання про те, чим є кварки – обособлено існуючими, самостійними частинками, чи способом описання тих подій які відбуваються в світі елементарних частинок, залишається відкритим.
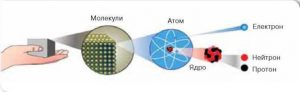
Мал.222. Загальна структура речовини.
Та як би там не було, а фактом залишається те, що сучасна наука налічує понад 350 тих структур, які прийнято називати елементарними частинками. При цьому виникає питання: якщо відомий нам світ складається з протонів, нейтронів і електронів, які за допомогою фотонів, гравітонів, нейтріно та трьох різновидностей мезонів, об’єднуються в атомні ядра, атоми, молекули, тіла, космічні об’єкти та Всесвіт загалом, то звідки береться таке величезне різноманіття відомих елементарних частинок?
Намагаючись розібратись в цьому надскладному питанні, відразу ж зауважимо, що переважна більшість тих елементарних частинок які можна зустріти в наукових каталогах, є тими структурами на які за певних умов перетворюються відомі нам протони, нейтрони, електрони та фотони. Тому не намагайтеся відшукати ту речовину яка б складалася з сігма, лямбда чи омега гіперонів, К+, К–, К01, К02 каонів чи W i Z– бозонів. Бо єдиним місцем на Землі де на певні миттєвості можуть з’являтися всі ці гіперони, каони та бозони, є прискорювачі елементарних частинок. Тобто ті надпотужні прилади, в яких звичні для нас елементарні частинки розганяються до таких енергій при яких вони переходять до якісно нових квантових станів, характеризуючи які і говорять про всі ці гіперони, каони та бозони.
Ясно, що будь який класифікаційний поділ наявного різноманіття елементарних частинок, має спиратись на певну систему кількісних характеристик цих частинок. До числа ж основних характеристик будь якої елементарної частинки відносяться: її маса спокою (m0), електричний заряд (q), спін (s) та середня тривалість життя (τ). Зазвичай, масу спокою елементарної частинки виражають не в кілограмах, а в атомних одиницях маси (а.о.м.), в одиницях маси спокою електрона (me), або в одиницях енергії (МеВ). Наприклад, маса спокою протона: mp = 1,00727а.о.м = 1836me = 938МеВ. Якщо ж елементарна частинка рухається, то її реальна маса збільшується. Збільшується на величину тієї додаткової маси яка у відповідності з рівнянням Ейнштейна Е=mc2 є еквівалентною енергії руху частинки Е=mv2/2.
За величиною маси спокою, елементарні частинки поділяються на:
1) легкі частинки, або лептони (m0 ˂ 250me);
2) проміжні частинки, або мезони (250me ˂ m0 ˂ 1000me);
3) важкі частинки, або баріони (m0 ˃ 1000me).
При цьому, проміжні та важкі частинки (мезони та баріони) утворюють більш загальну групу, яку прийняти називати адронами.
Елементарні частинки можуть бути як електрично зарядженими так і електронейтральними. При цьому, якщо елементарна частинка заряджена, то величина її заряду завжди елементарна (неподільна) і чисельно рівна е=1,6·10–19Кл. Знак же цього заряду може бути як додатнім (позитивним) так і від’ємним (негативним).
Елементарні частинки мають певний спін (власний момент імпульсу), одиницею вимірювання якого є стала Планка, а точніше ћ = h/2π = 1,055·10–34Дж·с При цьому, кількість цих одиниць є строго визначеною і може дорівнювати 0; 1/2; 1; 3/2; 2. Частинки з цілим спіном (0; 1; 2) називають бозонами. До їх числа відносяться фотони, гравітони та всі частинки середніх мас (мезони). Частинки з напівцілим спіном (1/2; 3/2) називаються ферміонами. До них належать всі легкі частинки (лептони) та всі важкі частинки (баріони).
Важливою характеристикою будь якої елементарної частинки є її середня тривалість життя (τ). Прийнято вважати що протони, електрони, нейтріно, фотони та гравітони є частинками стабільними тобто такими, тривалість життя яких безкінечно велика (τ=∞). Нейтрони, вважаються частинками умовно стабільними: будучи складовою частиною атомного ядра, вони є стабільними, а у вільному стані – не стабільними (τ=1010с=16,8хв). Решта ж елементарних частинок є надзвичайно не стабільними. Тривалість їх життя становить від декількох мікросекунд (2·10–6с) до 10–24с. Гранично не стабільні частинки (τ = 10–22 – 10–24с) прийнято називати резонансами.
Потрібно зауважити, що реальна тривалість життя елементарної частинки і та величина яку прийнято називати її середньою тривалістю життя (τ), це абсолютно різні тривалості. Скажімо, коли ми стверджуємо що середня тривалість життя фотона є безкінечно великою, то це зовсім не означає що світлові фотони живуть безкінечно довго. Адже пролітаючи через оптично позору речовину, фотон мільйони разів за секунду помирає (поглинається) і стільки ж разів – народжується (випромінюється). По суті, середня тривалість життя елементарної частинки (τ) є не мірою її реальної тривалості життя, а мірою її стабільності.
Елементарні частинки характеризуються не лише масою спокою, електричним зарядом, спіном та середньою тривалістю життя, а й іншими величинами, зокрема баріонним зарядом, лептонним зарядом, ізотонічним спіном, дивністю, парністю, тощо. Однак, в межах програми загально освітньої школи, визначати ці величини нема ані сенсу, ані потреби.
Різноманіття натепер відомих елементарних частинок можна розділити на чотири групи:
1). Ті стабільні та умовно стабільні елементарні частинки з яких фактично складаються звичні для нас речовинні об’єкти: атомні ядра, атоми, молекули, макротіла. Цими частинками є протони (р), нейтрони (n) та електрони (е).
2). Ті зазвичай стабільні елементарні частинки які забезпечують різні види взаємодій частинок першої групи та цілісність тих об’єктів які вони утворюють. До числа цих частинок відносяться: фотони (γ) – забезпечують електромагнітні взаємодії; гравітони (g) – забезпечують гравітаційні взаємодії; π-мезони (π) – забезпечують міжнуклонні взаємодії; нейтрино (ν) – приймають участь в слабких та гравітаційних взаємодіях. Що правда, останнє твердження є досить умовним. Адже слабкими взаємодіями називають ті процеси що відбуваються всередині елементарних частинок. А ці процеси якщо і можна представити у вигляді певних взаємодій між окремими частинками, то лише гіпотетично та гранично умовно.
3). Ті гранично не стабільні елементарні частинки, які за певних умов виникають як з вище названих частинок так і одна з одної. Різноманіття подібних частинок вимірюється сотнями найменувань. Зазвичай, ці не стабільні частинки отримують за допомогою надпотужних прискорювачів елементарних частинок. В прискорювачах, стабільні частинки (головним чином протони, електрони та їх античастинки), розганяються до надвисоких швидкостей та зіштовхують одну з одною. В процесі цього зіткнення енергія взаємодіючих частинок трансформуються в такі енергетичні згустки які можна назвати тією чи іншою новою елементарною частинкою. Ледь з’явившись, ці не стабільні частинки практично миттєво розпадаються і у підсумку знову перетворюються на стабільні або умовно стабільні частинки.
Ми не будемо заглиблюватись в деталі того, як та чому виникають ці не стабільні частинки, які їх властивості та назви. Ми просто зауважимо, що за певних умов, ті енергетичні згустки матерії, які називаються протонами, нейтронами, електронами, фотонами, тощо, у повній відповідності з фундаментальними законами Природи, перетворюються на такі енергетичні згустки які можна назвати каонами, мюонами, гіперонами та багатьма сотнями інших слів.
Зауважимо також, що наявне різноманіття нестабільних, взаємно перетворюваних елементарних частинок, по суті є ще одним проявом квантових властивостей мікросвіту. Адже фактично мова йде про те, що одна і та ж елементарна частинка при переході на більш високий енергетичний рівень, набуває таких якісно нових властивостей, сукупність яких дозволяє говорити про появу нової елементарної частинки.
4). Ті елементарні частинки, які прийнято називати античастинками. Античастинки надзвичайно схожі на відповідні частинки і фактично є їх дзеркальними відображеннями. Частинка та античастинка мають однакові маси, однакові спіни, однакові середні тривалості життя. Однак їх електричні заряди (а для незаряджених частинок – баріонні заряди або лептонні заряди) є взаємно протилежними.
Історія античастинок починається з 1928 року. В цьому році англійський фізик Поль Дірак (1902–1984) на основі аналізу законів квантової механіки, дійшов висновку, що в Природі має існувати частинка надзвичайно схожа на електрон, але позитивно заряджена. Цю частинку назвали позитроном (позначається е+). Дане теоретичне передбачення було експериментально підтверджене в 1932 році американським фізиком Карлом Андерсеном (1905–1991). Позитрони та електрони мають однакові маси (me+=me–=0,511МеВ), однакові спіни (se+=se–=1/2), однакові тривалості життя (τe+=τ–=∞), однакові але протилежні за знаком електричні заряди (qe+=+1,6·10–19Кл; qe–= –1,6·10–19Кл).
Не зважаючи не те, що позитрон є частинкою стабільною, в природних умовах Землі та всього Всесвіту, він не може існувати достатньо довго. Скажімо, в умовах земної атмосфери, тривалість життя позитрона не перевищує 10–6с. Це пояснюється тим, що позитрон (е+) неминуче зустрічається з електроном (е–). А результатом такої зустрічі є анігіляція частинок: е+ + е– → 2γ. Анігіляція (від лат. annihilation – зникнення, перетворення в ніщо), це такий квантовий процес, при якому частинка та античастинка перетворюються в те що прийнято називати чистою енергією, а фактично на кванти відповідного поля (в нашому випадку, на два фотони).
Мал.223. Анігіляція, це такий квантовий процес, при якому частинка та античастинка перетворюються на квант відповідного поля.
Процес анігіляції може слугувати класичним прикладом того, як зникають та народжуються елементарні частинки. Адже в цьому процесі, дві частинки, кожна з яких має певну масу спокою, певний спін та певний електричний заряд – зникають, а натомість – з’являються дві нові, абсолютно на них не схожі частинки, які не мають маси спокою, мають інший спін та нульовий електричний заряд. І тим не менше, жодних протиріч в такому перетворені нема. Адже в процесі анігіляції, з двох частинок, маса кожної з яких 0,511МеВ, утворюється два фотона енергія кожного з яких 0,511МеВ. Утворюються у повній відповідності з законом збереження енергії, імпульсу, заряду, спіну, тощо.
Потрібно зауважити, що зустріч позитрона з електроном далеко не завжди закінчується їх анігіляцією. Фактично вони анігілюють лише в тих випадках, коли їх відносні кінетичні енергії не надто великі. Якщо ж електрон та позитрон, рухаючись назустріч один одному мають достатньо великі енергії, то при їх зіткненні, можуть народжуватись найрізноманітніші частинки, в тому числі і такі, маси спокою яких в сотні разів більші за масу спокою електрона. Власне одним з найефективніших способів створення нових елементарних частинок є спосіб лобового зіткнення електронів та позитронів.
Електрони та позитрони можуть не лише перетворюватись на фотони, а й навпаки – виникати з них. Зазвичай, народження пари електрон-позитрон відбувається при взаємодії над енергійного фотона (фотона, енергія якого більша за 2mе=1,022МеВ) з масивною зарядженою частинкою, наприклад з атомним ядром: γ + Я → Я + е+ + е–.
Все вище сказане про взаємодії електронів та позитронів, стосується й інших частинок та античастинок: протон – антипротон; нейтрон – антинейтрон; нейтрино – антинейтрино і т.д.
Частинка та античастинка можуть бути абсолютно однаковими не лише за масою, спіном та тривалістю життя, а й за електричним зарядом. Це трапляється в тому випадку коли мова йде про електронейтральні частинки, наприклад нейтрони, нейтрино, тощо. В подібних випадках, частинка та античастинка відрізняються іншими параметрами, зокрема: бозонним зарядом; лептонним зарядом; дивністю. Втім, існує невелика група частинок які називаються істинно нейтральними. Їх частинки та античастинки є абсолютно однаковими (у всякому разі однаковими за тим загально прийнятим набором параметрів, які описують властивості елементарних частинок. Прикладом істинно нейтральної частинки є фотон.
В принципі, згідно з відомими законами Природи, з елементарних античастинок можна створити антиатоми, антимолекули, антиречовину, антиматерію і загалом – антивсесвіт. Однак, сталося так, що наш Всесвіт створений не з антиречовини, а з речовини. І нема жодних вагомих підстав стверджувати, що в певних місцях нашого Всесвіту є суттєві запаси антиречовини.
Факт існування великої кількості елементарних частинок (понад 350) наводить на думку: а чи не складаються ці частинки з більш простих, субелементарних частинок? Реалізацією цієї ідеї, стала наукова теорія, яку прийнято називати квантовою хромодинамікою. Згідно з цією теорією, всі адрони, тобто всі важкі та проміжні елементарні частинки, складаються з певного набору субелементарних частинок, які називаються кварками. Кварк – безструктурна елементарна частинка, яка входить до складу адронів, заряд якої кратний е/3 і яка не існує у вільному стані. На сьогоднішній день теорія говорить про 6 різновидностей кварків та відповідно 6 різновидностей антикварків.

Мал.224. Загальна структура речовини у відповідності з квантовою хромодинамікою.
Кваркова хромодинаміка достатньо повно пояснює відомі властивості адронів. Однак, беззаперечних доказів того, що кварки можуть існувати як певні самостійні частинки, на сьогоднішній день нема. Більше того, сама теорія стверджує, що у вільному стані, тобто в стані обособлених самостійних елементарних частинок, кварки існувати не можуть. По суті це означає, що у сучасної науки нема розуміння того, чи є кварки тими обособлено існуючими, самостійними частинками з яких дійсно складаються всі інші частинки. Чи це просто констатація факту того, що в «тілі» відповідної елементарної частинки відбуваються певні процеси, результатом яких є певна структурованість цієї частинки.
Існує думка і про те, що кварки, це лише вдало підібрані математичні величини, які дозволяють кількісно пояснити загальні властивості відомих елементарних частинок. Та як би там не було, а фактом залишається те, що переконливих доказів того, що саме кварки є тими субелементарними самостійно існуючими частинками, з яких складаються всі інші елементарні частинки, на сьогоднішній день нема.
Узагальнюючи вище сказане, можна дати наступне визначення. Елементарна частинка – це такий мікрооб’єкт, який представляє собою певний неподільний згусток мас-енергії, що має певні корпускулярно-хвильові властивості, характеризується певним набором фізичних величин і за певних умов може перетворюватись в інші елементарні частинки та навпаки – виникати з них.
Контрольні запитання.
- Які величини характеризують параметри елементарної частинки?
- Які групи елементарних частинок називають лептонами; мезонами; баріонами; адронами?
- Виразіть масу нейтрона (1,67495·10-27кг) в: а) а.о.м.; б) електронних масах; в) МеВ.
- Мірою чого є величина, яку називають тривалістю життя елементарної частинки (τ)?
- Які функції виконують фотони, гравітони та π-мезони?
- Чим схожі та чим відрізняються частинки і античастинки?
- Чому в нашому Всесвіті, по суті стабільні античастинки не можуть існувати довго?
- В яких випадках частинки та античастинки анігілюють, а в яких перетворюються на інші частинки з наявною масою спокою?
- Що стверджується в квантовій хромодинаміці і чи є ці твердження безумовно правильними?
.
§57. Фундаментальні взаємодії.
Пояснюючи яким чином елементарні частинки об’єднуються в атомні ядра, атоми, молекули, живі та неживі макротіла, планети, зірки, галактики та Всесвіт загалом, сучасна наука стверджує, що все різноманіття цих об’єднань можна пояснити на основі чотирьох фундаментальних взаємодій: гравітаційні взаємодії, електромагнітні взаємодії, сильні взаємодії та слабкі взаємодії. Кожна з цих взаємодій має свою сферу переважного застосування та виконує свої надважливі функції. Однак, лише в своїй нерозривній сукупності вони забезпечують гармонічну цілісність Природи. Гранично стисло пояснюючи суть, прояви та механізм дії кожної з фундаментальних взаємодій, можна сказати наступне.
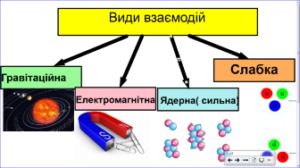
Гравітаційні взаємодії – це такий вид матеріального зв’язку, який існує між тими об’єктами що мають масу і носієм якого є гравітаційне поле та його неподільні кванти які називаються гравітонами. Гравітаційні взаємодії є гранично універсальними, тобто такими які діють практично між усіма матеріальними об’єктами Природи. Адже всі ці об’єкти мають масу, якщо не масу спокою, то масу руху. Гравітаційні взаємодії є зарядово незалежними, тобто такими які діють як між зарядженими так і між не зарядженими об’єктами. Гравітаційні взаємодії є далекодіючими, тобто такими, радіус дії яких необмежено великий. Гравітаційні сили є силами притягування, тобто такими які завжди прагнуть безмежно наблизити взаємодіючі об’єкти. Гравітаційні взаємодії є взаємодіями наднизької інтенсивності, тобто такими питома силова потужність яких є надзвичайно малою. Скажімо та гравітаційна сила з якою два протони взаємодіють в атомному ядрі, приблизно в 1035 разів менша за силу їх електростатичної взаємодії і практично в 1038 разів менша за силу їх ядерної взаємодії. Іншими словами: Fел/Fгр ≈ 1035 ; Fя/Fгр ≈ 1038 .
Потрібно зауважити, що на сьогоднішній день, загально прийнятої та загально визнаної методики оцінювання питомої силової потужності всіх видів взаємодій нема. Зазвичай, цю питому потужність оцінюють величиною, яка називається відносною інтенсивністю взаємодій (k). Цей параметр по суті показує у скільки разів питома сила даної взаємодії більша за визначену в схожих умовах питому силу гравітаційних взаємодій. За сучасними даними, значення відносних інтенсивностей різних видів взаємодій є наступними:
– гравітаційні взаємодії k = 1;
– електромагнітні взаємодії k = 1035;
– сильні (ядерні) взаємодії k = 1038;
– слабкі взаємодії k = 1032.
Внесок гравітаційних взаємодій в ті події які відбуваються в світі елементарних частинок, атомних ядер, атомів, молекул та тіл земних масштабів, є мізерно малим. Однак, якщо мова заходить про об’єкти космічних масштабів, як то планети, зірки, галактики та Всесвіт вцілому, то для них гравітаційні взаємодії є визначальними. Адже саме гравітаційні сили збирають величезні маси речовини в планети та зірки. Формують з них планетарні системи, галактики та метагалактики. Запалюють в надрах зірок термоядерні топки та створюють умови для їх стабільної роботи. З рештою, саме гравітаційні сили утримують молекули атмосферного повітря та нас з вами біля поверхні Землі.
Механізм дії гравітаційних сил полягає в наступному. Будь який масивний об’єкт, створює в навколишньому просторі певне силове збурення, яке називається гравітаційним полем. При будь якому просторовому зсуві (переміщенні) цього об’єкту створюється відповідна гравітаційна хвиля, яка розповсюджуючись з швидкістю с=3·108м/с, передає силову інформацію про цей зсув навколишнім об’єктам. За сучасними уявленнями, гравітаційні хвилі випромінюються та поглинаються певними неподільними порціями (квантами), які називаються гравітонами. Гравітон – це елементарна частинка, яка є неподільним квантом гравітаційного поля та носієм гравітаційних взаємодій. Гравітон є частинкою стабільною (τ=∞), має нульову масу спокою (m0=0), нульовий електричний заряд (q=0) та спін величиною в дві одиниці (s=2ћ). В існуючих на Землі умовах, інтенсивність гравітаційних взаємодій є надзвичайно малою і тому експериментально довести факт існування гравітонів поки що не вдається. І тим не менше, практично всі вчені переконані в тому, що гравітони дійсно існують і що їх фізичні властивості в точності відповідають теоретично передбаченим.
Електромагнітні взаємодії – це такий вид матеріального зв’язку, який існує між тими об’єктами що мають електричний заряд або магнітний момент і носієм якого є електромагнітне поле та його неподільні кванти які називаються фотонами. Електромагнітні взаємодії не є універсальними. Адже вони притаманні лише тим об’єктам які є носіями електричного заряду або магнітного моменту. Електромагнітні взаємодії є далекодіючими та зарядово залежними. Вони є взаємодіями високої інтенсивності (k=1035). Сили електромагнітної взаємодії можуть бути як силами притягування так і силами відштовхування.
Прояви електромагнітних взаємодій є надзвичайно різноманітними: сили електростатичної взаємодії, сили магнітної взаємодії, сили міжмолекулярного зв’язку, сили іонного, ковалентного, металічного, водневого та інших видів хімічного зв’язку, сили пружності, поверхневого натягу, тертя, світлового тиску, – ось далеко не повний перелік проявів електромагнітних взаємодій.
Електромагнітні взаємодії об’єднують атомні ядра та електрони у відповідні атоми. Атоми, об’єднують у відповідні молекули. Атоми, молекули та іони – у відповідні тіла в тому числі і такі надскладні як живі організми. Сили електромагнітної взаємодії надають тілам певних механічних, хімічних, біологічних, електромагнітних та інших властивостей. Ці взаємодії значною мірою відповідальні за альфа-розпад атомних ядер, за взаємодії заряджених елементарних частинок, за анігіляцію електрон-позитронних пар та за багато інших процесів. Однак, якщо мова йде про обособлені космічні об’єкти, то для них електромагнітні взаємодії не мають суттєвого значення. Не мають тому, що ці об’єкти є практично не зарядженими. Втім, це стосується лише тієї частини електромагнітних взаємодій яка описується законом Кулона.
Механізм дії електромагнітних сил полягає в наступному. Будь який носій електричного заряду або магнітного моменту, створює в навколишньому просторі певне силове збурення, яке називають електромагнітним полем. При будь якому просторовому зсуві цього носія, створюється відповідна електромагнітна хвиля, яка розповсюджуючись з швидкістю 3·108м/с передає силову інформацію про цей зсув. Електромагнітні хвилі випромінюються та поглинаються певними неподільними порціями (квантами), які називаються фотонами. Фотон – це елементарна частинка яка є неподільним квантом електромагнітного поля та носієм електромагнітних взаємодій. Фотон є частинкою стабільною (τ=∞), має нульову масу спокою (m0=0), нульовий електричний заряд (q=0) та спін величиною в одну одиницю (s=1ћ).
Сильні взаємодії – це такий вид матеріального короткодіючого зв’язку який виникає між важкими елементарними частинками (адронами) і носієм якого, за сучасними уявленнями, є глюонне поле та його неподільні кванти які називаються глюонами (m0=0; q=0; s=1ћ). Оскільки сильні взаємодії притаманні лише певному набору елементарних частинок, то їх не можна вважати універсальними. Сильні взаємодії є зарядово незалежними. Серед відомих фундаментальних взаємодій, сильні взаємодії є найпотужнішими (мають надвисоку інтенсивність k=1038). Сильні взаємодії є короткодіючими, тобто такими радіус дії яких обмежений і становить 2·10–15м. В залежності від відстані між взаємодіючими частинками, сильні взаємодії можуть бути як силами притягування так і силами відштовхування.
Найвідомішим проявом сильних взаємодій є ядерні сили, тобто ті сили які об’єднують протони та нейтрони у відповідні атомні ядра. Важливим проявом сильних взаємодій є ті реакції, які називаються термоядерними і які є основним джерелом енергії Сонця та інших активних зірок. За певних умов, сильні взаємодії призводять до появи найрізноманітніших важких, енергетично нестійких елементарних частинок. Сильні взаємодії є визначальними при тих процесах які відбуваються в атомних ядрах, при взаємних перетвореннях елементарних частинок та при між ядерних взаємодіях. Однак, якщо мова йде про міжатомні та міжмолекулярні взаємодії, про властивості та взаємодії макротіл, то в цьому випадку, сильні взаємодії не мають суттєвого значення.
Елементарно пояснити сучасну теорію сильних взаємодій практично не можливо. Тому просто зауважимо, що ця теорія називається квантовою хромодинамікою. Якщо ж говорити про історично першу наукову теорію сильних взаємодій, то її автором є японський фізик Хідекі Юкава. Суть теорії Юкави полягає в тому, що в атомному ядрі, сильно взаємодіючі частинки (нуклони), постійно обмінюються частинками-посередниками, які називаються π-мезонами.
Теорія Юкави не є такою що пояснює всі прояви сильних взаємодій. По суті, ця теорія пояснює лише один з цих проявів – внутріядерні міжнуклонні взаємодії, які прийнято називати ядерними силами. А оскільки в межах програми загальноосвітньої школи вивчають лише той прояв сильних взаємодій який називають ядерною силою, то механізм дії цієї сили доречно пояснювати саме з позицій теорії Юкави. Це тим більш доречно, якщо зважити на факт того, що порівняно з квантовою хромодинамікою, теорія Юкави є гранично простою, зрозумілою та логічно обгрунтованою.
Слабкі взаємодії – це такий вид матеріального короткодіючого зв’язку, який обумовлений тими процесами що відбуваються всередині елементарних частинок і який призводить до взаємоперетворення цих частинок. Слабкі взаємодії є взаємодіями помірно високої інтенсивності (k=1032). Ці взаємодії є надзвичайно короткодіючими. Радіус їх дії становить 2·10–18м. Слабкі взаємодії можуть спричиняти як розпад так і об’єднання елементарних частинок. І в цьому сенсі вони можуть бути як силами відштовхування так і силами притягування. Слабкі взаємодії відбуваються як в заряджених так і в електронейтральних частинках. І в цьому сенсі їх можна вважати зарядово незалежними. Втім, по відношенню до слабких взаємодій, застосовувати такі критерії оцінювання як зарядово залежні чи зарядово не залежні, сили відштовхування чи сили притягування, є не коректним. Адже мова йде не про взаємодію окремих обособлених частинок, а про ті процеси які відбуваються всередині певної елементарної частинки.
Найвідомішим проявом слабких взаємодій є бета-розпад нейтронів, тобто такий процес при якому електронейтральна частинка – нейтрон (1n0), розпадається на три частинки: протон (1p+1), електрон (0e–1) та нейтріно, а точніше – антинейтрино (0ν0): 1n0 → 1p+1 + 0e–1 + 0ν0 . Характерною особливістю цього процесу є факт того, що він не пов’язаний з будь якими сторонніми впливами на нейтрон. А це означає, що бета-розпад нейтрона є результатом тих процесів які відбуваються в самому нейтроні.
В 1934 році, італійський фізик Енріко Фермі створив теорію бета-розпаду нейтрона. Теорію яка фактично стала основою сучасної теорії слабких взаємодій. В теорії Фермі стверджується, що ті електрони та антинейтрино які вилітають з нейтрона при його бета-розпаді, не є складовими частинками нейтрона, а виникають в процесі цього розпаду. В певному сенсі, процес цього виникнення схожий на процес випромінювання фотонів світла енергетично збудженим атомом: електрон при переході на більш низький енергетичний рівень випромінює відповідний світловий фотон. Згідно з теорією Фермі, в енергетично збудженій (енергетично не збалансованій) елементарній частинці, відбувається щось подібне: в процесі переходу енергетично збудженої частинки до більш стабільного стану, випромінюється певна частинка параметри якої відповідають наявній кількості надлишкової енергії. А для нейтрона цією частинкою є пара електрон – антинейтрино.
За сучасними уявленнями, слабкі взаємодії є одним з проявів електромагнітних взаємодій. Просто ті умови в яких відбуваються ці фактично електромагнітні взаємодії є настільки специфічними, що результуючі ефекти виявляються абсолютно не схожими на звичні для нас електромагнітні взаємодії.
Слабкі взаємодії відповідальні не лише за бета-розпад нейтрона та бета-радіоактивність, а й за спонтанний розпад переважної більшості відомих елементарних частинок. Ці взаємодії спричиняють так званий електронний захват та нейтронізацію ядер надмасивних зірок. Слабкі взаємодії відповідальні за взаємодію нейтрино з речовиною, за надпотужні вибухи старіючих зірок (червоних гігантів) та за багато інших важливих процесів.
Говорячи про фундаментальні взаємодії, не можна не згадати про ту надважливу силу, яку називають силою інерції. На перший погляд, сила інерції не є різновидністю жодної є фундаментальних взаємодій. Адже поява цієї сили обумовлена не взаємодією даного тіла (частинки) з тими чи іншими сторонніми об’єктами і не тими взаємодіями які відбуваються всередині цього тіла. Поява сили інерції обумовлена фактом прискореного руху самого тіла. Втім, твердження про те, що поява сили інерції не обумовлена взаємодією даного тіла з певним фізичним об’єктом, не є безумовно правильним. Адже поява сили інерції по суті обумовлена взаємодією даного тіла (частинки) з тим фізичним об’єктом, який прийнято називати простором, а отже, з всією сукупністю тих силових збурень цього простору які називаються гравітаційними, електромагнітними, глюонними та іншими полями.
Та як би там не було, а в загальній теорії відносності стверджується, що силові прояви гравітаційної сили та сили інерції є еквівалентними (принцип еквівалентності). А це означає, що сила інерції є певною різновидністю гравітаційних взаємодій. Тому, твердження про те, що гравітаційні сили можуть бути лише силами притягування, не зовсім відповідає дійсності. Адже зважаючи на факт еквівалентності гравітаційних та інерційних сил, цілком обгрунтовано можна стверджувати, що сили гравітаційної взаємодії можуть бути як силами притягування (істинно-гравітаційні сили) так і силами відштовхування (інерційно-гравітаційні сили). Власне факт існування нашої Сонячної системи, нашої Галактики та інших подібних систем є прямим наслідком факту того, що діючі на елементи цих систем істинно-гравітаційні сили притягування, зрівноважуються інерційно-гравітаційними силами відштовхування.
Завершуючи розмову про фундаментальні взаємодії додамо, що ці взаємодії нерозривно пов’язані між собою та утворюють єдиний цілісний організм. Організм, в якому кожна взаємодія виконує певні функції та органічно доповнює функціональні обов’язки інших взаємодій. При цьому вчені переконані в тому, що всі відомі фундаментальні взаємодії, є певними проявами єдиного цілого, і що це єдине ціле можна пояснити в рамках єдиної цілісної теорії. Інша справа, що на сьогоднішній день, такої загально визнаної та безумовно доведеної теорії не існує. Що ж, у вас є реальна можливість проявити свої інтелектуальні здібності та навічно закарбувати своє ім’я серед найвидатніших вчених всіх часів і народів.
Контрольні запитання.
- Дайте загальну характеристику гравітаційних взаємодій
- Поясніть механізм передачі гравітаційних взаємодій.
- Дайте загальну характеристику електромагнітних взаємодій.
- Поясніть механізм передачі електромагнітних взаємодій.
- Дайте загальну характеристику сильних взаємодій.
- Дайте загальну характеристику слабких взаємодій.
- Який зв’язок між силою інерції та гравітаційною силою?
- Які функції в загальному устрою Всесвіту виконують: гравітаційні взаємодії; електромагнітні взаємодії; сильні взаємодії; слабкі взаємодії.