ТЕПЛОВІ ПРОЦЕСИ

Тема 2.5. Теплові процеси.
Тема 2.5. Теплові процеси.
§27. З історії наукових поглядів на природу теплоти.
§28. Про внутрішню енергію тіла та кількість
теплоти. Рівняння теплового балансу.
§29. Нагрівання – охолодження.
Питома теплоємність речовини.
§30. Загальні відомості про енергетичні параметри
нагрівання, пароутворення та горіння.
§31. Про особливості потенціальної енергії молекул.
§32. Теплове розширення тіл. Особливості
теплового розширення води.
§33. Загальні відомості про термодинаміку.
§34. Перше начало термодинаміки.
§35. Друге начало термодинаміки.
§36. Теплові двигуни.
Тема 2.5 Теплові процеси.
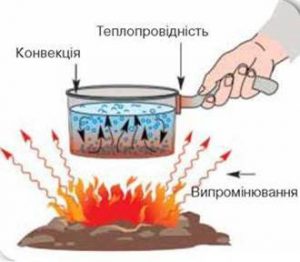
Нагадаємо. Молекулярна фізика – це розділ фізики, в якому вивчають загальні властивості твердих, рідких і газоподібних речовин та ті теплові процеси які відбуваються з ними. До тепер, ми фактично вивчали загальні властивості речовин. А якщо і згадували про теплові процеси, то лише в сенсі способу переходу речовини з одного агрегатного стану в інший. Наразі ж прийшов час поговорити про енергетичну суть теплових процесів та про пояснення цієї суті з точки зору молекулярно-кінетичної теорії. Втім, зважаючи на те, що загальні відомості про суть та прояви більшості теплових процесів ви отримали при вивченні фізики за восьмий клас, наша розмова буде гранично стислою та узагальнюючою.
.
§27. З історії наукових поглядів на природу теплоти.
Про те, що таке теплота люди замислювались дуже давно. Ще за 350 років до нашої ери, давньогрецький філософ Аристотель (384 – 322 р.р. до н.е.) стверджував, що Всесвіт складається з чотирьох речовинних субстанцій – вологості, сухості, теплоти і холоду, які в певних співвідношеннях утворюють все різноманіття твердих, рідких та газоподібних тіл. Іншими словами, Аристотель вважав, що тепло і холод, це ті базові матеріали з яких складається Всесвіт.
В середині вісімнадцятого століття уявлення про теплоту, як певну речовинну субстанцію набули обрисів наукової теорії. Згідно з цією теорією, теплота – це певна надлегка речовина (теплець, теплород), яка існує сама по собі, яка може переходити від одного тіла до іншого і загальна кількість якої при будь яких переходах залишається незмінною: при теплообміні, кількість теплоти (теплецю) втраченої одними тілами системи (Qвтр), дорівнює кількості теплоти отриманої (Qотр) іншими тілами цієї системи, тобто Qвтр=Qотр. В сучасній науці цей закон називають рівнянням теплового балансу.
Теорія теплецю достатньо успішно пояснювала широке коло теплових явищ починаючи від нагрівання, плавлення та пароутворення і закінчуючи тепловим розширенням тіл та їх нагріванням в процесі тертя. Скажімо вважалося, що в гарячому тілі теплецю багато, а в холодному – мало, і що тому при контакті цих тіл, певна кількість теплецю перетікає від гарячого тіла до холодного. Вважалося, що в процесі тертя, ударів, згинань та інших механічних дій, теплець видавлюється з тіла і тому виділяється відповідна кількість теплоти. Вважалося, що в процесі нагрівання, тиск теплецю всередині тіла збільшується і що тому відповідне тіло розширюється.
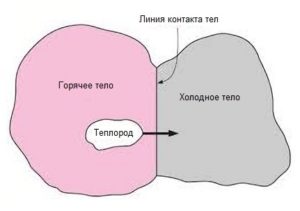

Мал.81. Згідно з теорією (гіпотезою) теплецю, теплота – це певна надлегка речовина (теплець), яка існує сама по собі і яка може переходити від одного тіла до іншого.
Слабким місцем теорії теплецю були ті процеси при яких речовина переходила з одного агрегатного стану в інший. Адже наприклад при плавленні, надана тілу теплота не призводила до нагрівання тіла (до підвищення його температури). А це виглядало таким чином, ніби в процесі плавлення теплець зникав. Натомість в процесі кристалізації, теплота виділялась і теплець ніби виникав нізвідки. А потрібно зауважити, що до середини 18-го століття поняття «температура» і «кількість теплоти» вважалися тотожними і тому кількість теплецю в тілі оцінювали за температурою цього тіла.
Пояснюючи факт того, що процеси переходу речовини з одного агрегатного стану в інший, супроводжуються поглинанням або виділенням теплоти (теплецю) і не супроводжуються зміною температури речовини, шотландський вчений Джозеф Блек (1728–1799) по перше розмежовує поняття кількість теплоти (Q) та температура (t), а по друге вводить в наукову практику поняття «прихована теплота». Згідно з Блеком, в процесі плавлення та пароутворення, теплець не зникає, а накопичується у вигляді прихованої теплоти. Натомість при зворотних процесах, ця прихована теплота знову перетворюється на теплоту явну.
Крім поняття «прихована теплота» (за сучасною термінологією – теплота плавлення і теплота пароутворення), Джозеф Блек вводить в наукову практику таку важливу кількісну характеристику речовини як питома теплоємність, тобто величину яка характеризує теплові властивості даної речовини і яка показує скільки теплоти (Q) накопичує один кілограм цієї речовини при її нагріванні на один градус Цельсія (с=Q/mΔt).
Виходячи з того, що теплота це певний самостійний фізичний об’єкт, в наукову практику було введено відповідну незалежну одиницю вимірювання кількості цього об’єкту (кількості теплоти). Цю одиницю назвали калорією (від лат. calor – теплота). Калорія – це одиниця вимірювання кількості теплоти, що дорівнює такій кількості теплоти, яку потрібно витратити на те щоб нагріти один грам води на один градус Цельсія. Позначається: кал.
Теорія теплецю достатньо успішно пояснювала широке коло теплових явищ починаючи від нагрівання, плавлення та пароутворення і закінчуючи тепловим розширенням тіл та їх нагріванням в процесі тертя. Однак теорія теплецю мала один, але визначально важливий недолік – жоден експеримент не підтверджував факту того, що теплець дійсно існує. А як відомо, в науці єдиним критерієм істини є експеримент. Тому на фоні безуспішних спроб знайти бодай якісь докази існування теплецю, вчені поступово усвідомлювали, що теплота це не якась міфічна речовина, а результат хаотичного руху молекул.
Перші вагомі кроки в цьому напрямку зробив англійський вчений Бенджамін Томпсон (граф Румфорд) (1753–1814). Перебуваючи на військовій службі, Томпсон не раз спостерігав за тим, яка велика кількість теплоти виділяється в процесі свердлення стволів гармат. При цьому він звертає увагу на те, що кількість тієї теплоти яка виділяється в процесі свердлення, обернено пропорційна кількості тієї стружки що є результатом свердлення: чим менше стружки (чим тупіше свердло), тим більше теплоти. Пояснення теорії теплецю здавалися Томпсону непереконливими. Адже згідно з цією теорією, в процесі свердлення теплець вичавлювався із стружки і тому його кількість мала би бути пропорційною кількості вичавленої стружки – чим більше стружки, тим більше теплецю. Крім цього, теплоємність вичавленої стружки мала би бути набагато меншою за теплоємність відповідного невичавленого металу.
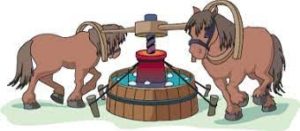
Мал.82. В процесі свердління дула гармати виділяється величезна кількість теплоти.
Перевіряючи свої здогадки, Томпсон провів ряд експериментів, які безумовно доводили, що в процесі тертя теплоту можна отримувати в практично в безмежно великій кількості, і що питома теплоємність «вичавленої» стружки та питома теплоємність відповідного «невичавленого» металу є однаковою. А це означало, що результати експериментів явно суперечать передбаченням теорії теплецю, і що тому ця теорія є недостовірною.
Не потрібно думати, що теорія теплецю була безнадійно поганою чи антинауковою. В історії науки подібні теорії виникали неодноразово. Наприклад пояснюючи електричні явища говорили про наявність певної електричної рідини (електричного флюїду), пояснюючи магнітні явища говорили про наявність певної магнітної рідини, пояснюючи процес розповсюдження світла – наполягали на наявності світлоносного ефіру. Ці та їм подібні теорії мали певні ознаки наукових теорій. Однак всі вони мали той недолік, що пояснюючи певне обособлене явище, були абсолютно непридатним в ситуаціях, коли це явище виявлялось пов’язаним з іншими явищами. А Природа влаштована таким чином, що вона представляє собою єдиний цілісний організм в якому все взаємопов’язано та взаємообумовлено. І тому більш детальні, більш глибокі дослідження неминуче доводили, що в Природі не існує окремих теплових, окремих електричних, окремих магнітних, світлових чи інших речовин. І що всі ці спеціальні рідини, теплеці, флюїди та ефіри, то різні прояви одних і тих же природних процесів (рухів), кількісною мірою яких є та фізична величина яку прийнято називати енергією.
Потрібно зауважити, що в науковій практиці, слово «енергія» стало загально вживаним лише наприкінці 19-го століття. А до цього, ту величину яку сьогодні називають енергією, зазвичай позначили терміном «сила». При цьому термін «сила» застосовували як в сучасному значенні цього слова (міра взаємодії тіл), так і в сенсі механічної енергії, тобто міри здатності сили виконувати роботу. Певний час сфера застосування терміну енергія, обмежувалась виключно механічними процесами і не виходила за межі ньютонівської механіки. Але поступово, в процесі накопичення знань в царині механічних, теплових, електричних та інших явищ, ставало все більш і більш очевидним, що всі ці явища нерозривно пов’язані з певними різновидностями руху матерії. Що між цими різновидностями руху існує певний кількісний зв’язок. І що енергія, то не просто міра здатності виконати певну роботу, а загальна міра всіх видів рухів та взаємодій.
Першим хто обгрунтовано заговорив про цей зв’язок був німецький вчений Роберт Майєр (1814–1874). В 1842 році Майєр опублікував статтю «Зауваження що до сил неживої природи», в якій стверджував, що в природі існує декілька видів «сил» (енергій) які можуть взаємно перетворюватись в певних кількісних співвідношеннях. При цьому Майєр не просто декларував цю думку, а й теоретично обґрунтовував її правильність. Обгрунтовував на прикладі перетворення теплоти в механічну роботу.
У своїх теоретичних міркуваннях Майєр виходив з того відомого факту, що питома теплоємність газу при постійному тиску (ср) та питома теплоємність того ж газу при постійному об’ємі (сv) є різною. Наприклад для повітря ср = 240кал/кгºС; сv = 170кал/кгºС. Майєр розумів, що цей експериментальний факт є результатом того, що в процесі ізобаричного нагрівання, частина наданої газу теплоти йде на його розширення, тобто на виконання механічної роботи. Тому він абсолютно логічно передбачив, що та різниця яка існує між питомими теплоємностями газу при його ізобаричному та ізохоричному нагріванні (ср – сv) чисельно дорівнює тій механічній роботі яка виконується при ізобаричному нагріванні 1кг газу на 1ºС: ср – сv = Амех = р∆V.
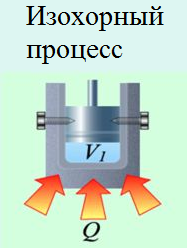
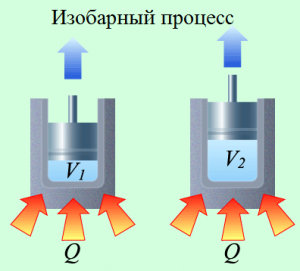
Мал.83. Кількість тієї теплоти яка йде на нагрівання одного й того ж газу при ізохоричному (а) та ізобаричному (б) процесах є суттєво різною.
Виходячи з цього передбачення та відомого на той час закону Гей-Люсака, Майєр робить висновок: виміряна в калоріях теплота перетворюється у виміряну в джоулях механічну роботу, у співвідношенні 1кал≈4,2Дж. (Потрібно зауважити, що в часи Майєра, теплоємності газів були визначені досить приблизно. Тому за його розрахунками виходило що 1кал=3,6Дж).
Майєр був не єдиним хто прийшов до висновку, що між різними проявами енергії існує певний кількісний зв’язок. Приблизно в той же час і незалежно від нього, до аналогічного висновку прийшов англійський експериментатор Джеймс Джоуль (1818–1889). Джоуль не мав вищої освіти. Але будучи людиною обдарованою, він рано зацікавився наукою і швидко досяг в ній успіху. Вже в двадцяти трьох річному віці, він експериментально встановив закон який нині називають законом Джоуля–Лєнца. В цьому законі стверджується: при проходженні електричного струму виділяється теплота, кількість якої пропорційна квадрата сили струму в провіднику: Q = I2Rt.
Проводячи свої експериментальні дослідження Джоуль зрозумів, що між тепловими, хімічними, електричними та механічними явищами існує певний кількісний зв’язок. З’ясуванню цього зв’язку і присвятив свою подальшу наукову діяльність молодий експериментатор. На мал.83 представлена спрощена схема дослідів Джоуля. Суть цих дослідів очевидно проста: в процесі опускання вантажу, а отже в процесі виконання механічної роботи, занурене в рідину тіло обертається та нагріває цю рідину. Визначивши виконану вантажем механічну роботу (А=mgh) та кількість отриманої при цьому теплоти (Q=cm∆t), Джоуль встановив: між теплотою виміряною калоріях і роботою виміряною в джоулях, існує кількісне співвідношення 1кал = 4,2Дж. По суті це означало, що теплота і механічна робота, це різні прояви однієї і тієї ж сутності – енергії, які відрізняються лише тим, що виміряні в різних одиницях. (Сподіваюсь ви розумієте, що в часи Джоуля і Майєра, одиницю вимірювання енергії джоулем не називали).
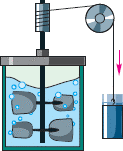
Мал.84. Принципова схема дослідів Джоуля.
Таким чином, експериментальні та теоретичні дослідження багатьох вчених безумовно довели, що теплота, це не певна обособлена та існуюча сама по собі теплова рідина (теплець), а результат хаотичного (теплового) руху частинок речовини та тих взаємодій які відбуваються між ними. Втім, потрібно визнати, що навіть в сучасній науці термін «теплота» не має однозначно чіткого та загально прийнятого визначення. В сучасній науці теплотою називають і енергію теплового руху молекул, і певні прояви цієї енергії, і ту фізичну величину яка характеризує цю енергію. Що ж, сучасна наука – це живий організм, який еволюційно розвивається і який не позбавлений певних вад. Та як би там не було, а на тепер ми достовірно знаємо, що ніякої теплової рідини не існує, що теплота нерозривно пов’язана з енергією хаотичного (теплового) руху молекул, і що кількісною мірою теплоти є фізична величина яка називається кількістю теплоти (позн. Q).
Контрольні запитання.
1. Як теорія теплецю пояснювала факт того, що теплота переходить від гарячого тіла до холодного, а не навпаки?
2. Як теорія теплецю пояснювала виділення теплоти в процесі тертя?
3. Як теорія теплецю пояснювала теплове розширення тіл?
4. Як теорія теплецю пояснювала фак того, що в процесі плавлення поглинання теплоти не спричиняє нагрівання тіла?
5. Який недолік мали ті теорії які пояснювали теплові, електричні, магнітні та інші явища на основі уявлень про існування певної особливої рідини?
6. Дайте визначення терміну «калорія».
7. На основі яких фактів Р. Майєр дійшов висновку, що між механічною роботою і теплотою є певний кількісний зв’язок?
8. Поясніть суть дослідів Джоуля.
.
§28. Про внутрішню енергію та кількість теплоти. Рівняння теплового балансу.
Нагадаємо. Енергія – це фізична величина, яка є загальною мірою всіх видів рухів та взаємодій і яка характеризує здатність тіла, частинки або поля виконати роботу.
Позначається: Е
Визначальне рівняння: різні, в залежності від виду енергії,
Одиниця вимірювання: [Е] = Дж.
Розрізняють дві базові різновидності енергії: кінетична та потенціальна.
Кінетична енергія (енергія руху) – це та енергія, яку має фізичний об’єкт за рахунок того що він рухається і яка дорівнює половині добутку маси об’єкту на квадрат швидкості його руху.
Позначається: Ек
Визначальне рівняння: Ек = mv2/2,
Одиниця вимірювання: [Ек] = Дж.
Якщо мова йде про середню кінетичну енергію поступального руху молекул речовини, то її зазвичай визначають за формулою Ек=(3/2)kT, де k=1,38·10–23Дж/К – стала Больцмана, T – абсолютна температура речовини.
Потенціальна енергія (енергія взаємодії) – це та енергія, яку має фізичний об’єкт за рахунок того, що він так чи інакше взаємодіє з іншими фізичними об’єктами, або за рахунок тих взаємодій які відбуваються всередині самого об’єкту.
Позначається: Еп
Визначальне рівняння: Еп=? (єдиної, універсальної формули, яка б дозволяла визначати величину потенціальної енергії в будь яких її проявах, нема).
Одиниця вимірювання: [Еп] = Дж.
Наряду з силою, енергія є тією фізичною величиною яка має величезну кількість різновидностей. Енергія може бути механічною і електричною, тепловою і хімічною, магнітною і електромагнітною, звуковою і ядерною, повною і внутрішньою, потенціальною сили пружності і потенціальною сили тяжіння, кінетичною поступального руху і кінетичною обертального руху, енергією спокою, енергією зв’язку, енергією активізації, енергією іонізації і т.д. і т.п. Тому говорячи про енергію того чи іншого об’єкту або явища, потрібно визначитись з тим, про яку різновидність енергії йде мова. Це тим більш важливо, зважаючи на те, що в різних обставинах, за однією і тією ж назвою можуть приховуватись суттєво різні величини.
Наприклад сьогодні ми говоримо про внутрішню енергію тіла, тобто ту енергію яка зосереджена всередині (внутрі) даного тіла і яка чисельно дорівнює сумі кінетичних та потенціальних енергій тих частинок з яких це тіло складається. Величина цієї енергії по суті залежить від рівня деталізації внутрішнього устрою тіла. Скажімо якщо виходити з того, що тіло складається з молекул, то його внутрішня енергія має визначатись як сума кінетичних і потенціальних енергій всіх молекул цього тіла. Якщо ж врахувати, що молекули складаються з атомів, то визначаючи внутрішню енергію тіла, потрібно врахувати не лише кінетичну і потенціальну енергію його молекул, а й кінетичну та потенціальну енергію тих атомів з яких ці молекули складаються. А якщо прийняти до уваги факт того, що атоми також мають певний внутрішній устрій, то визначаючи внутрішню енергію тіла потрібно врахувати і енергію тих частинок з яких складаються його атоми.
Чесно кажучи, якщо мова йде про ту загальну кількість енергії яка зосереджена всередині (внутрі) будь якого тіла, то величину цієї енергії визначається за формулою Е=mс2, де m – маса тіла, с=3∙108м/с=соnst. Це означає, що повністю перетворивши все те з чого складається дане тіло, а отже всі його молекули, атоми, атомні ядра, протони, нейтрони, електрони та всі ті процеси які відбуваються з ними, в те що називається чистою енергією, а по суті в світло, ви отримаєте цієї енергії в кількості Е=mс2. Наприклад в будь якому тілі масою 1кг міститься Е=1кг(3·108м/с)2=9·1016Дж енергії. Щоб мати уявлення про величину цієї енергії, достатньо сказати, що аналогічну кількість енергії можна отримати при повному згоранні 4 500 000 тон кам’яного вугілля.
Однак, коли в межах молекулярної фізики, термодинаміки чи повсякденного життя ми говоримо про внутрішню енергію тіла, то маємо на увазі не ту загальну кількість енергії яка в принципі зосереджена в даному тілі і величина якої визначається за формулою Е=mс2, а ту мізерну частину цієї загальної енергії яка обумовлена рухом та взаємодією молекул відповідного тіла. Іншими словами, в молекулярній фізиці:
Внутрішня енергія – це та енергія яка зосереджена всередині даного тіла і яка чисельно дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла.
Позначається: U
Визначальне рівняння: U = ∑Екі + ∑Епі
Одиниця вимірювання: [U] = Дж.

Мал.85. Внутрішня енергія тіла дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла.
В загальному випадку, теоретично визначати внутрішню енергію довільно взятого тіла ми не вміємо. Не вміємо головним чином тому, що на сьогоднішній день не існує тієї універсальної формули, яка б дозволяла визначати потенціальну енергію молекул речовини. А оскільки Еп=? то U=∑Ек+∑Еп =?
Втім, якщо мова йде про ідеальний газ, то для нього енергією взаємодії молекул можна знехтувати, тобто вважати, що Еп=0. А це означає, що для ідеального газу U=∑Екі=NЕк=(3/2)NkT (1), де N – загальна кількість молекул газу; k=1,38·10–23Дж/К – стала Больцмана; Т – абсолютна температура газу.
Оскільки для одного моля газу N = NA = 6,02·1023(1/моль), то можна записати Uмоль= (3/2)NAkT = (3/2)RT, де R = NAk = 8,31Дж/К·моль – універсальна газова стала.
Для довільної кількості молей газу (ν = m/М), рівняння (1) набуває вигляду U = (3/2)mRT/M (2), де m – маса газу, М – молярна маса газу.
Теоретично обгрунтовуючи формулу (2), ми виходили з того, що молекули газу, це пружні кульки. А це означає, що визначаючи кінетичну енергію цих кульок ми не враховували енергію їх обертального руху. Не враховували тому, що енергетичний результат взаємодії пружних кульок, практично не залежить від того обертаються ці кульки чи не обертаються. В загальному ж випадку молекули є багатоатомними, а отже такими, які не надто схожі на круглі кульки. Тому, визначаючи кінетичну енергію багатоатомних молекул потрібно враховувати як кінетичну енергію їх поступального руху Ек=mv2/2, так і кінетичну енергію їх обертального руху Ек=J0ω2/2. Враховуючи ці обставини, можна довести що внутрішня енергія двохатомних молекул (О2, N2, Н2, СО, тощо), має визначатись за формулою U = (5/2)mRT/M. Якщо ж мова йде про гази, молекули яких трьох і більше атомні (СО2, СН4, С2Н2, тощо), то їх внутрішня енергія має визначатись за формулою U = (6/2)mRT/M.
Таким чином, в залежності від того з яких молекул складається газ, величину його внутрішньої енергії можна визначити за однією з наступних формул:
– для одноатомних молекул U = 1,5mRT/M;
– для двохатомних молекул U = 2,5mRT/M;
– для трьох і більше атомних молекул U = 3,0mRT/M.
Говорячи про внутрішню енергію тіла та про ту її складову яка називається потенціальною енергією, потрібно мати на увазі, що ці енергії є відносними величинами. Наприклад, коли ми стверджуємо, що потенціальна енергія молекул газу дорівнює нулю, то це зовсім не означає що вона дійсно дорівнює нулю. Це навіть не означає, що ця енергія дійсно мала. Більше того, це навіть не означає, що потенціальна енергія молекул газу дійсно менша за їх кінетичну енергію. Твердження про те, що потенціальна енергія молекул газу є мізерно малою, означає лише те, що на рівні тих процесів які відбуваються в газі, вплив потенціальної енергії молекул на ці процеси є несуттєвим. Несуттєвим тому, що левова частина потенціальної енергії молекул газу прихована на рівні внутрішньо молекулярних взаємодій і тому на рівні міжмолекулярних взаємодій практично не проявляє себе.
Ситуація нагадує таку, коли перебуваючи на рівні третього поверху, ви проводите експерименти з тими пружними кульками які рухаються гладенькою підлогою цього поверху. Аналізуючи кінематичну поведінку кульок, ви робите висновок, що ця поведінка не залежить від того, що відносно рівнів першого та другого поверхів, кожна кулька має певний запас потенціальної енергії. Та от в підлозі з’являється отвір, потрапляючи в який кульки опиняються на рівні підлоги другого поверху. При цьому неминуче з’ясовується, що та прихована потенціальна енергія, яка на рівні третього поверху жодним чином не проявляла себе, на рівні другого поверху, перетворюється на відповідну кількість кінетичної енергії та відповідним чином впливає на кінематичну поведінку кульок.
Зважаючи на вище сказане, не дивуйтесь тому, що в процесі конденсації виділяється величезна кількість теплової енергії. Просто в процесі конденсації молекули речовини «падають» з більш високого енергетичного поверху (рівня) на більш низький. При цьому та прихована потенціальна енергія яка на рівні поверху «газ» практично не проявляла себе, на рівні більш низького поверху «рідина» перетворюється на відповідну кількість кінетичної енергії (теплоти).
Та якби там не було, а в загальному випадку теоретично визначати внутрішню енергію тіла (U) ми не вміємо: оскільки Еп=? то U=∑Екі+∑Епі=? Однак на практиці, нас завжди цікавить не внутрішня енергія тіла, а те, на скільки вона змінюється в результаті того чи іншого теплового процесу. Іншими словами, на практиці нас цікавить не U, а ∆U. Наприклад, нас не цікавить та загальна кількість внутрішньої енергії яка зосереджена в певній кількості води, пару, заліза чи вугілля. Нас цікавить, скільки енергії ми отримаємо при згоранні певної кількості вугілля; скільки енергії потрібно для того, щоб нагріти дану кількість води на задану кількість градусів Цельсія; скільки енергії ми отримаємо при перетворенні пару в рідину; скільки енергії потрібно для того, щоб розплавити певну кількість заліза; і т.д. Іншими словами, практичне значення має не внутрішня енергія тіла (U), а те на скільки вона змінюється в результаті того чи іншого теплового процесу. Цю зміну внутрішньої енергії тіла (∆U=Uк–Uп) називають кількістю теплоти.
Кількість теплоти – це фізична величина, яка показує на скільки джоулів змінюється внутрішня енергія тіла в результаті того чи іншого теплового процесу.
Позначається: Q
Визначальне рівняння: Q = ∆U
Одиниця вимірювання: [Q] = Дж.
Оскільки в загальному випадку, теоретично визначати внутрішню енергію тіла ми не вміємо, то відповідно не вміємо теоретично визначати і кількість тієї теплоти що виділяється або поглинається при тому чи іншому тепловому процесі (оскільки U=?, то Q=ΔU=?). В подібних ситуаціях, на допомогу теорії завжди приходить експеримент. Про те як експериментальні дослідження допомагають визначати ту кількість теплоти яка виділяється чи поглинається при тому чи іншому тепловому процесі, ми поговоримо в наступних параграфах. Наразі ж зауважимо, що при всьому різноманітті тих процесів які відбуваються при теплообміні, виконується закон який називається рівнянням теплового балансу.
Рівняння теплового балансу – це закон, в якому стверджується: при теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої (енерго ізольованої) системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи. Іншими словами: ∑Qвтр = ∑Qотр. Наприклад, якщо нагріте тіло опустити в посудину з холодною водою, то тіло втратить певну кількість теплової енергії, а вода і посудина аналогічну кількість енергії отримає. А якщо в результаті точних вимірювань з’ясується, що та загальна кількість тієї теплоти яку отримала вода і посудина дещо менша за ту кількість теплоти яку втратило нагріте тіло, то це означатиме лише те, що відповідна система є не замкнутою, і що розв’язуючи задачу ми чогось не врахували. Наприклад того, що частина енергії нагрітого тіла пішла на випаровування рідини.
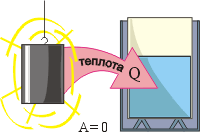
Мал.86. При теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи.
Зверніть увагу на те, що рівняння теплового балансу виконується лише в тому випадку якщо мова йде про теплообмін, тобто такий тепловий процес який відбувається без виконання механічної роботи. Адже якщо наприклад, в процесі нагрівання газ розширюється, то надана йому теплота буде витраченою не лише на нагрівання газу, а й на виконання ним певної механічної роботи (на розширення газу).
Прилад за допомогою якого вимірюють кількість тієї теплоти що виділяється або поглинається в результаті того чи іншого теплового процесу називають калориметром (від лат. calor – теплота і грец. metreo – вимірюю). Сучасні калориметри мають достатньо складну будову. Однак принциповий устрій та принцип дії калориметра є досить простими. В максимально енергоізольованій посудині (мал.87) міститься відома кількість відомої рідини, наприклад води. В цю рідину опускають об’єкт теплового дослідження. При цьому, та теплова енергія яка виділяється або поглинається цим об’єктом, передається рідині. Знаючи масу рідини (m), її теплоємність (с) і те на скільки збільшилась або зменшилась температура рідини (∆t) в процесі теплообміну, визначають величину відповідної енергії (теплоти): Q=cm∆t. Ясно, що при подібних розрахунках потрібно враховувати і ту енергію яку отримують або віддають інші елементи системи, зокрема посудина калориметра, термометр, тощо.
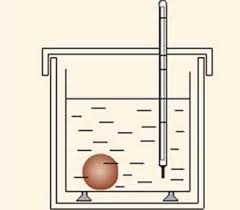
Мал.87. Схема загального устрою калориметра.
Задача 1. Визначте внутрішню енергію того азоту що знаходиться в балоні ємністю 60 літрів при тиску 5атм.
Дано:
N2
V = 60л = 60·10–3м3
p = 5атм = 5·105Па
U = ?
Рішення: Оскільки молекули азоту двохатомні, то внутрішня енергія цього газу має визначатись за формулою U = 2,5mRT/M, де m = ? Оскільки згідно з законом Менделєєва-Клапейрона pV/T =mR/M, звідси m=pVM/TR. Таким чином: U = 2,5mRT/M = 2,5pVMRT/TRM = 2,5pV
Розрахунки: U = 2,5pV = 2,5·5·105Па·60·10–3м3 = 75000(Н·м) = 75кДж.
Відповідь: U = 75кДж.
Загальні зауваження. Із аналізу рішення даної задачі випливає, що в залежності від того з яких молекул складається газ, величину його внутрішньої енергії можна визначити за однією з наступних формул:
– для одноатомних молекул U = 1,5νRT або U = 1,5pV;
– для двохатомних молекул U = 2,5νRT або U = 2,5pV;
– для трьох і більше атомних молекул U = 3,0νRT або U = 3,0pV.
Задача 2. Відомо, що для нагрівання 1кг води на 1°С потрібно витратити 4200Дж енергії. На скільки при цьому збільшується середня потенціальна енергія однієї молекули води?
Дано:
m = 1кг
ΔE = 4200Дж
Δt = 1°C
ΔEп1 = ?
Рішення: Будемо виходити з того, що надана воді енергія ΔE, частково йде на збільшення кінетичної енергії її молекул NΔEк1, а частково – на збільшення їх потенціальної енергії NΔEп1, тобто ΔЕ = NΔEк1 + NΔEп1, де N – кількість молекул в 1кг води: N=m/m0= 1кг/18·1,66·10–27кг = 33,5·1024молекул.
Оскільки молекули води (Н2О) є трьохатомними, то ΔЕк1=3kΔT= 3·1,38·10–23(Дж/К)·1К = 4,14·10–23Дж. При цьому NΔEк1 = 33,5·1024·4,14·10–23Дж = 1380Дж.
Таким чином NΔEп1 = ΔЕ – NΔEк1 = 4200Дж – 1380Дж = 2820Дж. Звідси, ΔЕп1 = 2820Дж/33,5·1024 = 8,4·10–23Дж.
Відповідь: ΔЕп1 = 8,4·10–23Дж.
Загальні зауваження. Факт того, що в процесі нагрівання більша частина наданої воді енергії йде не на збільшення кінетичної енергії її молекул (ΔЕк1= 4,14·10–23Дж), а на збільшення їх потенціальної енергії (ΔЕп1 = 8,4·10–23Дж), зовсім не означає, що відповідним чином змінюється та потенціальна енергія молекул води, яка визначальним чином впливає на фізичні властивості води як рідини. Мова йде лише про те, що в процесі нагрівання, певна частина наданої тілу енергії перетворюється на приховану енергію внутрішньо молекулярних взаємодій.
Контрольні запитання.
1. Чи є визначена за формулою Ек=(3/2)kT енергія молекули, загальною кінетичною енергією цієї молекули? Поясніть.
2. За якою формулою визначають ту загальну кількість енергії яка зосереджена в тілі масою m?
3. Чому внутрішня енергія тіла є відносною величиною?
4. Чи означає твердження: потенціальна енергія молекул газу дорівнює нулю, що ця енергія дійсно гранично мала? Поясніть.
5. Чи можна за визначальним рівнянням внутрішньої енергії, визначити внутрішню енергію: а) твердого тіла; б) рідини; в) газу? Чому?
6. Потенціальна енергія яких молекул більша: а) твердого тіла чи відповідної рідини; б) твердого тіла чи відповідного пару? Чому?
7. У відповідності з формулою U = 2,5mRT/M, внутрішня енергія газу залежить від температури, а у відповідності з формулою U = 2,5pV – не залежить від неї. Чи не суперечать ці формули одна одній? Поясніть.
8. В яких випадках рівняння теплового балансу виконується, а в яких – не виконується?
9. Поясніть загальний устрій та принцип дії калориметра.
Вправа 28.
1. На скільки джоулів зміниться внутрішні енергія одного моля ідеального газу, при його нагріванні на 1,5ºС?
2. На скільки джоулів зміниться внутрішня енергія 200г азоту, при зміні його температури на 20ºС?
3. Визначте внутрішню енергію того вуглекислого газу що знаходиться в балоні ємністю 50 літрів при тиску 5атм.
4. Відомо, що для випаровування 1кг води при постійній температурі (температурі кипіння) потрібно 2,6·106Дж енергії. На скільки збільшується при цьому потенціальна енергія однієї молекули води? На скільки треба нагріти воду, щоб середня кінетична енергія поступального руху її молекул збільшилась на аналогічну величину?
5. При зменшенні об’єму одноатомного газу в 3,6 рази, його тиск збільшився на 20% У скільки разів змінилася внутрішня енергія газу?
6. Доведіть що формули U = 2,5mRT/M та U = 2,5pV є тотожними.
7. Ідеальний одноатомний газ маючи тиск 0,3МПа займає об’єм 4,0л. Визначте внутрішню енергію цього газу.
8. При температурі 27°С внутрішня енергія одноатомного ідеального газу 1,2кДж. Визначте число атомів в цьому газі.
§29. Нагрівання – охолодження. Питома теплоємність речовини.
До числа найпоширеніших теплових явищ відносяться нагрівання та охолодження. Характеризуючи процес нагрівання, можна сказати наступне:
1.Нагрівання відбувається з поглинанням енергії (теплоти). А це означає, що в процесі нагрівання внутрішня енергія відповідної речовини збільшується (Qн→U↑);
2. Нагрівання супроводжується підвищенням температури речовини. А це означає, що в процесі нагрівання відповідно збільшується середня кінетична енергія молекул речовини (якщо Т↑, то Ек↑, адже Ек=(3/2)kT);
3. Нагрівання не супроводжується зміною агрегатного стану речовини. А це означає, що в процесі нагрівання, величина потенціальної енергії міжмолекулярних взаємодій залишається практично незмінною (Еп=const). Потрібно зауважити, що в процесі нагрівання значна частина поглинутої тілом енергії йде на збільшення загальної потенціальної енергії тіла, але тієї прихованої частини цієї енергії, яка практично не впливає на міжмолекулярні взаємодії.
Узагальнюючи вище сказане можна дати наступне визначення. Нагрівання, це такий тепловий процес який відбувається з поглинанням енергії, супроводжується підвищенням температури речовини і не супроводжується зміною її агрегатного стану. При нагріванні, надана речовині теплова енергія йде на збільшення кінетичної енергії її молекул, при цьому потенціальна енергія цих молекул (енергія взаємодії молекул) залишається практично незмінною: Qн → Eк↑; Еп = const.
Мал.88. Нагрівання: 1) теплота поглинається; 2) температура збільшується; 3) агрегатний стан не змінюється.
Оскільки процес охолодження відбувається з виділенням енергії, супроводжується зниженням температури речовини і не супроводжується зміною її агрегатного стану, то можна дати наступне визначення. Охолодження, це такий тепловий процес, який відбувається з виділенням енергії, супроводжується зниженням температури речовини і не супроводжується зміною її агрегатного стану. При охолодженні, виділення енергії відбувається за рахунок зменшення кінетичної енергії молекул речовини та прихованої частини їх потенціальної енергії, при цьому потенціальна енергія міжмолекулярних взаємодій залишається практично незмінною: Qох ← Eк↓; Еп = const.
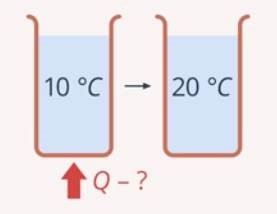
Очевидно, що кількість тієї теплоти яку потрібно витратити на те, щоб певне тіло нагріти на певну кількість градусів Цельсія (кельвінів), залежить від: 1) маси тіла (m); 2) різниці початкової та кінцевої температур тіла (ΔТ=Δt); 3) теплових властивостей матеріалу тіла. Цю залежність можна записати у вигляді Qн = сm∆T, або Qн = сm∆t, де с – питома теплоємність речовини.
Питома теплоємність речовини – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб один кілограм відповідної речовини нагріти на один кельвін (на один градус Цельсія).
Позначається: с
Визначальне рівняння: с = Qн/m∆T
Одиниця вимірювання: [с] = Дж/кг·К.
Теоретично визначити питому теплоємність довільно взятої речовини практично не можливо. Натомість її можна визначити експериментально. З цією метою, виготовлене із даного матеріалу тіло відомої маси (m) нагрівають на задану кількість кельвінів (градусів Цельсія ∆Т=Δt) і визначають ту кількість енергії Qн яка була витрачена на відповідне нагрівання. А потім, за формулою с=Qн/m∆T визначають числове значення питомої теплоємності відповідної речовини і записують його у відповідну таблицю.
Таблиця. Питомі теплоємності деяких речовин.
| Речовина | с (Дж/кг·К) | Речовина | с (Дж/кг·К) |
| Тверді речовини | |||
| алюміній | 880 | платина | 125 |
| залізо, сталь | 460 | свинець | 120 |
| золото | 125 | срібло | 250 |
| лід | 2090 | скло | 840 |
| мідь | 380 | цегла | 750 |
| оливо | 250 | цинк | 400 |
| пісок | 970 | чавун | 550 |
| Рідини | |||
| вода | 4187 | ртуть | 130 |
| гас | 2140 | спирт | 2430 |
| залізо | 830 | нафта | 2100 |
| Гази ( р = const ) | |||
| азот | 1000 | гелій | 5200 |
| аміак | 2100 | кисень | 920 |
| водень | 14300 | повітря | 1000 |
| водяний пар | 2200 | вуглекислий газ | 830 |
Таким чином, маючи у своєму розпорядженні результати попередніх експериментальних досліджень, ту кількість теплоти яку отримує тіло в процесі нагрівання, можна визначити за формулою Qн = сm∆T, або Qн = сm∆t
Дослідження показують, що величина тієї кількості теплоти яку отримує тіло при його нагріванні (Qн), дорівнює тій кількості теплоти яку воно віддає при аналогічному охолодженні Qох=Qн=сm∆T. Втім, потрібно мати на увазі, що мова йде про взаємно протилежні процеси, які характеризуються відповідно протилежними знаками. Власне, ця протилежність міститься в самих формулах. Дійсно. При нагріванні Тк ˃ Тп і тому ∆Т=Тк – Тп ˃ 0, а отже Qн має знак «+». При охолодженні Тк ˂ Тп і тому ∆Т=Тк – Тп ˂ 0, а отже Qох має знак «–».
Не важко бачити, що серед всього різноманіття речовин, питома теплоємність води (с=4187Дж/кг°С) є практично найбільшою. Даний факт має надзвичайно важливе клімат утворююче значення. Це значення полягає в наступному. Питома теплоємність твердої поверхні Землі, приблизно в чотири рази менша за питому теплоємність води. Крім цього сонячне світло не здатне проникати в надра непрозорих поверхонь. В такій ситуації поверхневий шар континентальної землі, швидко нагрівається вдень і відповідно швидко охолоджується вночі. А це означає, що тверда поверхня Землі сприяє так званому різко континентальному клімату, який характеризується великими перепадами денних і нічних, зимових і літніх температур.
Натомість вода має велику питому теплоємність. Крім цього, сонячне світло глибоко проникає в товщу води, та сприяє нагріванню її величезних мас. В такій ситуації води світового океану виконують роль надпотужного теплового акумулятора, який робить клімат Землі більш м’яким та більш придатним для життя. Нагріваючись вдень, вода акумулює в собі величезну кількість теплової енергії, яку віддає вночі. Потужні океанічні течії, нагріту в жарких частин планети воду, переносять в холодні частини планети та роблять їх більш теплими. Натомість холодні води приполярних областей переміщуються в жаркі екваторіальні області та робить їх менш жаркими.
Потрібно зауважити, що коли ми стверджували: теоретично визначити питому теплоємність довільно взятої речовини практично неможливо, то мали на увазі саме довільно взяту речовину. Адже, якщо такою речовиною є газ, а особливо газ ідеальний, то в цьому випадку теоретичні розрахунки є можливими. Дійсно.
Задача 1. Визначити питому теплоємність азоту (N2) при його ізохоричному нагріванні.
Дано:
N2
m=const
V=const
сv=?
Рішення: За визначенням с=Qн/m∆T. Оскільки в процесі ізохоричного нагрівання, вся надана газу енергія (Qн) йде на збільшення його внутрішньої енергії Qн=∆U, та враховуючи що для двохатомних газів U=2,5mRT/M, а ∆U=2,5mR∆T/M, можна записати cv=Q/m∆T=∆U/m∆T=2,5R/M, де R=8,31Дж/К·моль; М(N2)=28г/моль=28·10–3кг/моль.
Таким чином: сv(N2) = 2,5R/M = 2,5·8,31(Дж/К·моль)/28·10–3(кг/моль)=740Дж/кг.
Відповідь: Питома теплоємність азоту (N2) при його ізохоричному нагріванні (m=const, V=const) становить сv(N2) =740Дж/кг.
Узагальнюючи рішення задачі, можна сказати наступне. Питома теплоємність газу при його ізохоричному (сv) нагріванні можна визначити за формулами:
– для одноатомних газів: cv = 1,5R/M;
– для двохатомних газів: cv = 2,5R/M;
– для трьох і більше атомних газів: cv = 3,0R/M.
Якщо ж говорити про питому теплоємність газу при його ізобаричному нагріванні (m=const, p=const), то визначаючи цю теплоємність потрібно врахувати не лише нагрівання самого газу, а і ту механічну роботу, яку виконує газ в процесі цього нагрівання. При цьому можна довести, що: ср = сv + p/ρT, де р – тиск газу, ρ – густина газу, Т – абсолютна температура газу.
Задача 2. Для приготування ванни ємністю 200л змішали холодну воду з температурою 10°С та гарячу з температурою 60°С. Які об’єми тієї й іншої води треба взяти, щоб встановилася температура 40°С?
Загальні зауваження. Літр не є основною одиницею вимірювання об’єму. Однак, зважаючи на те, що в процесі розв’язування задачі, розмірність одиниці вимірювання об’єму не впливає на результат (окрім того, що цей результат буде виміряно в літрах), переводити літри в метри кубічні необов’язково.
Дано:
V = V1+V2 = 200л
t1 = 10°C
t2 = 60°С
tk = 40°С
V1 = ? V2 = ?
Рішення. У відповідності з рівнянням теплового балансу Qотр = Qвтр. В умовах нашої задачі: c1m1Δt1 = c2m2Δt2. А оскільки с1 = с2, то можна записати m1Δt1 = m2Δt2. Зважаючи на те, що m = ρV, а також, що ρ1 = ρ2, отримаємо: ρ1V1Δt1 = ρ2V2Δt2, V1Δt1 = V2Δt2, де Δt1 = 40°C–10°С = 30°С; Δt2 = 60°С–40°С = 20°C.
Таким чином, ми отримуємо систему двох рівнянь з двома невідомими:
1) V1+V2=200
2) 30V1=20V2.
Стандартним чином розв’язуємо цю систему, та визначаємо невідомі величини.
Із рівняння (1) випливає V1 = 200 – V2. Підставляючи в рівняння (2), отримуємо
30(200 – V2) = 20V2, або 6000 – 30V2 = 20V2. Звідси
50V2 = 6000, звідси V2 = 6000/50 = 120л.
Таким чином: V2 = 120л, V1 = 200 – V2 =200 – 120 = 80л.
Відповідь: V2 = 120л, V1 = 80л.
Загальні зауваження. Зверніть увагу на те, що різницю температур (Δt) ми фактично визначали не за формулою Δt = tк–tп, а як різницю між більшою та меншою температурою. Це пов’язано з тим, що для ситуації нагрівання–охолодження, рівняння Qотр = Qвтр по суті треба записувати у вигляді Qотр = –Qвтр. І тоді різниця температур в кожному випадку визначається за базовою формулою Δt = tк – tп. Якщо ж для ситуації нагрівання–охолодження рівняння теплового балансу записують у вигляді Qотр = Qвтр, то в цьому випадку Δt визначають як різницю між більшою та меншою температурами.
Задача 3. Мідний калориметр масою 150г містить 200г води при температурі 15°С. В калориметр опустили залізну деталь масою 260г та температурою 100°С. Визначити загальну температуру системи після теплообміну.
Дано:
m1 = 150г = 0,15кг
m2 = 200г = 0,20кг
m3 = 260г = 0,26кг
t1 = t2 = 15°С
t3 = 100°С
tк = ?
Рішення. В умовах даної задачі рівняння теплового набуває вигляду: Qн1 + Qн2 = Qох3, або c1m1(tк – t1) + c2m2(tк – t1) = c3m3(t3 – tк), або c1m1tк – c1m1t1 + c2m2tк – c2m2t1 = c3m3t3 – c3m3tк, або c1m1tк + c2m2tк + c3m3tк = c1m1t1 + c2m2t2 + c3m3t3, або tк(c1m1 + c2m2 + c3m3) = c1m1t1 + c2m2t2 + c3m3t3.
Звідси tк = (c1m1t1 + c2m2t2 + c3m3t3)/(c1m1 + c2m2 + c3m3), де
с1 = 380Дж/кг·°С, с2 = 4200Дж/кг·°С, с3 = 460Дж/кг·°С.
Розрахунки:
tк = (380·0,15·15+4200·0,20·15+460·0,26·100)/(380·0,15+4200·0,20+460·0,26) = 25°С.
Відповідь: tк = 25°С.
Контрольні запитання.
1. Визначальне рівняння кількості теплоти має вигляд Q=∆U. Який недолік цього рівняння?
2. Дайте загальну характеристику процесу: а) нагрівання; б) охолодження.
3. Від чого залежить та кількість теплоти яка потрібна для нагріванні тіла?
4. Чи можна теоретично визначити питому теплоємність: а) рідини; б) газу?
5. Як ви думаєте, за допомогою якого приладу і яким чином визначають питому теплоємність речовини?
6. На яку енергію перетворюється та енергія яка надається тілу в процесі його нагрівання?
7. Звідки береться та енергія яка виділяється в процесі охолодження тіла?
8. В чому полягає клімат утворююче значення високої теплоємності води?
9. Чому питома теплоємність газу виміряна при постійному об’ємі завжди менша за питому теплоємність того ж газу виміряній при постійному тиску?
Вправа 29.
1. Щоб нагріти 110г алюмінію на 90ºС знадобилось 9,1Дж енергії. Визначити питому теплоємність алюмінію.
2. Мідний калориметр масою 150г містить 200г води при температурі 15°С. В калориметр занурили тіло масою 220г та температурою 100°С. При цьому температура системи підвищилась до 30°С. Визначити питому теплоємність тіла.
3. З якої висоти має впасти трьох кілограмова цеглина, щоб своєю кінетичною енергією нагріти літр води на 1ºС?
4. На скільки нагріється при штампуванні сталева деталь масою 1кг від удару молота масою 100кг, якщо швидкість молота в момент удару 20м/с, а на нагрівання деталі йде 40% його енергії?
5. Склянку ємністю 200см3 на три чверті заповнили окропом, а рештою водою з температурою 20ºС. Якою буде температура води в склянці?
6. В скляну посудину масою 100г в якій міститься 300г води при 20ºС, опустили 400г заліза з температурою 5ºС і 300г міді з температурою 25ºС. Визначити кінцеву температуру системи.
7. Мідне тіло нагріте до 100°С занурили у воду маса якої дорівнює масі мідного тіла. При цьому вода нагрілась до 30°С. Визначити початкову температуру води.
8. Визначити питому теплоємність гелію та вуглекислого газу при постійному об’ємі та постійному тиску.
.
§30. Загальні відомості про енергетичні параметри плавлення, пароутворення та горіння.
До числа найбільш поширених теплових процесів, окрім нагрівання та охолодження, відносяться плавлення, кристалізація, пароутворення, конденсація та горіння. З фізичною суттю більшості з цих процесів ви знайомі. Тому наразі стисло зупинимся лише на кількісній оцінці енергетичних параметрів цих процесів.
Плавлення, це такий тепловий процес який відбувається з поглинанням енергії, супроводжується переходом речовини з твердого (кристалічного) стану в рідкий і не супроводжується зміною температури речовини. При плавленні, надана речовині теплова енергія йде на збільшення потенціальної енергії її молекул, при цьому кінетична енергія цих молекул залишається практично незмінною: Qпл → Eп↑; Ек = const.
Зворотний до плавлення процес, тобто процес переходу речовини з рідкого стану в твердий кристалічний стан, називається кристалізацією. Кристалізація, це такий тепловий процес який відбувається з виділенням енергії, супроводжується переходом речовини з рідкого стану в твердий (кристалічний) і не супроводжується зміною температури речовини. При кристалізації виділення енергії відбувається за рахунок зменшення потенціальної енергії молекул речовини, при цьому кінетична енергія цих молекул залишається практично незмінною: Qкр ← Eп↓; Ек = const.
Кількість тієї теплоти яку потрібно витратити на те щоб при певній постійній температурі (температурі плавлення) розплавити певне тіло, залежить від маси тіла (m) та теплових властивостей відповідного матеріалу. Цю залежність можна записати у вигляді Qпл=λm, де λ – питома теплота плавлення.
Питома теплота плавлення – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб розплавити один кілограм відповідної речовини, за умови що вона вже знаходиться при температурі плавлення.
Позначається: λ, (лямбда)
Визначальне рівняння: λ = Qпл/m
Одиниця вимірювання: [λ] = Дж/кг.
Питому теплоту плавлення визначають експериментально і записують у відповідну таблицю, наприклад таку.
| Речовина | tпл (ºC) | λ (Дж/кг) | Речовина | tпл (ºC) | λ(Дж/кг) |
| алюміній | 659 | 3,8·105 | олово | 232 | 0,58·105 |
| вода, лід | 0 | 3,35·105 | ртуть | –39 | 0,13·105 |
| вольфрам | 3410 | 0,26·105 | свинець | 327 | 0,25·105 |
| залізо | 1530 | 2,5·105 | срібло | 960 | 0,88·105 |
| золото | 1063 | 0,66·105 | чавун білий | 1200 | 1,3·105 |
| Мідь | 1083 | 1,8·105 | чавун сірий | 1150 | 0,97·105 |
Дослідження показують, що величина тієї кількості теплоти яку отримує тіло при його плавлені (Qпл), дорівнює тій кількості теплоти яку воно віддає при кристалізації Qкр=Qпл=λm.
Пароутворення, це такий тепловий процес, який відбувається з поглинанням енергії та супроводжується переходом речовини з рідкого стану в газоподібний. При пароутворенні, надана речовині теплова енергія йде на збільшення потенціальної енергії її молекул, при цьому кінетична енергія цих молекул залишається практично незмінною: Qпар → Eп↑; Ек ≈ const.
На відміну від процесу плавлення, який відбувається при постійній температурі, пароутворення може відбуватися при будь якій температурі рідини. Інтенсивна фаза пароутворення називається кипінням. Кипіння – це таке інтенсивне пароутворення, яке відбувається при певній постійній температурі (температурі кипіння) і при якому утворення пару відбувається в усьому об’ємі рідини. Візуальною ознакою кипіння є утворення наповнених паром бульбашок.
Зворотний до пароутворення процес, тобто процес переходу речовини з газоподібного стану в рідкий, називається конденсацією. Конденсація, це такий тепловий процес, який відбувається з виділенням енергії та супроводжується переходом речовини з газоподібного стану в рідкий. При конденсації виділення енергії відбувається за рахунок зменшення потенціальної енергії молекул речовини, при цьому кінетична енергія цих молекул залишається практично незмінною: Qкр ← Eп↓; Ек ≈ const.
На практиці, кількість тієї теплоти що поглинається в процесі пароутворення, або виділяється в процесі конденсації, визначають за формулою: Qпар= rm, де m – маса випаруваної (сконденсованої) рідини; r – питома теплота пароутворення речовини.
Питома теплота пароутворення – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує, скільки енергії потрібно витратити на те, щоб при певній постійній температурі (зазвичай при температурі кипіння) випарувати один кілограм відповідної речовини.
Позначається: r
Визначальне рівняння: r = Qпар/m
Одиниця вимірювання: [r] = Дж/кг.
Питома теплота пароутворення кожної конкретної речовини визначається експериментально. А результати цих експериментів записуються у відповідну таблицю, наприклад таку:
| Речовина | t (ºС) | r (Дж/кг) | Речовина | t (ºС) | r (Дж/кг) |
| аміак | –33,4 | 13,7·105 | ртуть | 357 | 2,85·105 |
| ацетон | 56,2 | 5,2·105 | спирт | 78 | 8,57·105 |
| бензин | 150 | 3,0·105 | Фреон–12 | –29,8 | 16,8·105 |
| вода | 100 | 22,6·105 | ефір етиловий | 35 | 3,52·105 |
| залізо | 3050 | 0,6·105 |
Нагрівання–охолодження, пароутворення–конденсація, плавлення–кристалізація, це відносно прості теплові процеси, які не супроводжуються хімічними перетвореннями речовини. Натомість горіння, це такий тепловий процес, який супроводжується певними хімічними реакціями, інтенсивним виділенням великої кількості теплової та певної кількості світлової енергії.
Зазвичай, горіння це досить складний процес, який представляє собою сукупність великої кількості екзотермічних, ланцюгових хімічних реакцій, протіканню яких сприяє низка суто фізичних явищ, як-то нагрівання, випаровування, дифузія, конвекційний теплообмін, тощо. Однак, якщо говорити про фізичну суть горіння, то вона досить проста. І ця суть полягає в тому, що в процесі горіння потенціальна енергія хімічних зв’язків, або хімічно взаємодіючих речовин, перетворюється в кінетичну енергію продуктів згорання (Еп → Ек). Адже те, що ми називаємо полум’ям, по суті представляє собою сукупність величезної кількості молекул які мають надзвичайно велику кінетичну енергію та є продуктами згорання палива. Фізичну суть горіння можна представити у вигляді наступної узагальнюючої формули: С6Н12О6 + 6О2 → 6СО2 + 6Н2О + Qгор.

Мал.89. В процесі горіння потенціальна енергія хімічних зв’язків, або хімічно взаємодіючих речовин, перетворюється в кінетичну енергію продуктів згорання (Еп → Ек).
На практиці кількість тієї теплоти, що виділяється в процесі горіння, визначають за формулою: Qгор = qm, де m – маса того палива, q – питома теплота згорання палива.
Питома теплота згорання – це фізична величина, яка характеризує теплові властивості даного виду палива і яка показує скільки енергії виділиться в процесі повного згорання одного кілограма цього палива.
Позначається: q
Визначальне рівняння: q = Qгор/m
Одиниця вимірювання: [q] = Дж/кг.
Питома теплота згорання кожного виду палива визначається експериментально та записується у відповідну таблицю, наприклад таку:
| Речовина | q (Дж/кг) | Речовина | q (Дж/кг) |
| Тверде паливо | |||
| буре вугілля | 9,3·106 | кам’яне вугілля марки АⅠ | 20·106 |
| деревне вугілля | 30·106 | кам’яне вугілля марки АⅡ | 30·106 |
| дрова сухі | 8,5·106 | торф | 15·106 |
| Рідке паливо | |||
| бензин, нафта | 46·106 | мазут | 40·106 |
| дизельне паливо | 42·106 | спирт | 27·106 |
| гас | 43·106 | ||
| Газоподібне паливо (для 1м3 за нормального тиску) | |||
| коксовий газ | 16·106 | ацетилен | 48·106 |
| природний газ | 40·106 | водень | 120·106 |
Потрібно зауважити, що та кількість тієї теплоти яка виділяється в процесі горіння, практично не залежить від режиму цього горінні. Наприклад шматок деревини, в одних умовах може згоріти за дві хвилини, в інших – за десять хвилин, а в третіх (в процесі гниття) – за десять років. При цьому кількість тієї теплоти що виділяються в процесі відповідних згорань буде практично однаковою. Звичайно за умови що згорання буде повним.
На певно ви звернули увагу на те, що природні явища симетричні. Симетричні в тому сенсі, що кожному природному процесу можна поставити у відповідність певний зворотній процес. Нагрівання та охолодження, плавлення та кристалізація, пароутворення та конденсація – ось лише деякі приклади симетричності Природи. А от горіння. Чи існує процес зворотній до нього? Виявляється, існує. І цей процес називають фотосинтезом (від грец. photos – світло; synthesis – з’єднувати, створювати). Адже напевно ви чули про те, що колись всі ці нафти, вугілля, торфи та горючі гази були деревами, кущами, папоротниками, травою та іншою рослинністю. А це означає, що та енергія яка акумульована у вугіллі, нафті, природному газі та інших подібних матеріалах, по суті є законсервованою енергією фотосинтезу.
Фотосинтез, це складний багатоступеневий фотохімічний процес, суть якого полягає в тому, що в клітинах рослин та деяких бактерій, під дією енергії сонячного світла, із води та вуглекислого газу синтезуються енергоємні молекули простих вуглеводнів, зокрема глюкози. Фізичну суть фотосинтезу можна представити у вигляді наступної узагальнюючої формули: 6СО2 + 6Н2О + Е☼ → С6Н12О6 + 6О2.
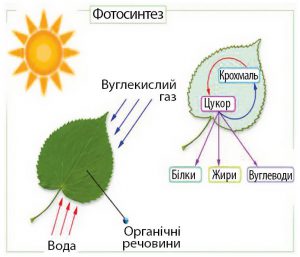
Мал.90. В процесі фотосинтезу енергія Сонця трансформується в енергію хімічних сполук.
Таким чином, в процесі фотосинтезу кінетична енергія фотонів світла перетворюється на потенціальну енергію молекул палива та окислювача (Q☼=Ек → Еп). В процесі ж горіння, відбувається зворотнє перетворення. Перетворення потенціальної енергії молекул системи паливо-окислювач в кінетичну енергію продуктів згорання, тобто в ту енергію яку прийнято називати енергією горіння (Еп → Ек = Qгор).
Задача 1. До якої температури треба нагріти алюмінієвий куб, щоб він, будучи покладений на лід, повністю в нього занурився? Температура льоду 0°С.
Дано:
алюміній (1)
лід (2)
t0 = 0°С
t1 = ?
Рішення. Будемо виходити з того, що та кількість теплоти, яку нагрітий алюмінієвий куб має віддати льоду Qн = c1m1(t1–t0), повністю витрачається на плавлення льоду Qпл = λ2m2. Іншими словами, будемо виходити з того, що у відповідності з рівнянням теплового балансу c1m1(t1–t0) = λ2m2. А оскільки t0 = 0°С, то c1m1t1 = λ2m2.
Враховуючи, що m = ρV, а також виходячи з того, що об’єм алюмінієвого куба (V1) має дорівнювати об’єму ним розплавленого льоду (V1 = V2), можна записати c1ρ1V1t1 = λ2ρ2V2, або c1ρ1t1 = λ2ρ2. Звідси t1 = λ2ρ2/c1ρ1, де ρ2 = 0,9·103кг/м3; ρ1 = 2,7·103кг/м3; с1 = 880Дж/кг°С; λ2 = 3,35·105Дж/кг.
Розрахунки: t1 = 3,35·105·0,9·103/880·2,7·103 = 127°С
Відповідь: ta = 127°С.
Задача 2. Скільки потрібно спалити спирту, аби 2кг льоду взятого при температурі 0°С розплавити і 1кг отриманої води перетворити на пару. ККД спиртівки 40%.
Загальні зауваження. Доречно нагадати, що рішення тих задач в яких так чи інакше фігурує коефіцієнт корисної дії, практично завжди треба починати з визначального рівняння ККД тобто з формули η = Акор/Азатр
Не зайвим буде нагадати і про те, що в умовах задач фізики часто зустрічаються ситуації коли величина певного параметру вказується не явно, а опосередковано. Наприклад, в умові даної задачі опосередковано мається на увазі, що кінцевою температурою води та її пару є 100°С.
Дано:
m1 = 2кг
t1 = 0°C
t2 = 100°C
m2 = 1кг
η = 40% = 0,4
m3 = ?
Рішення. За визначенням η = Акор/Азаг. В умовах нашої задачі, корисною є та робота (енергія) яка йде на плавлення льоду, нагрівання до температури кипіння отриманої води та на перетворення частини цієї води на пар з температурою 100°С, тобто Акор = Qпл + Qн + Qпар = λ1m1 + c1m1Δt1 + r1m2. Загальною (затраченою) є та енергія (робота) яку отримують при згоранні спирту, тобто Азаг = Q = qm3.
Таким чином, в умовах нашої задачі η = (λ1m1+c1m1Δt1+r1m2)/ qm3.
Звідси випливає m3 = (λ1m1+c1m1Δt1+r1m2)/qη,
де λ1 = 3,35·105Дж/кг; с1 = 4187Дж/кг°С; r1 = 22,6·105Дж/кг; q = 27·106Дж/кг.
Розрахунки: m3 = ….= 0,35кг = 350г.
Відповідь: m3 = 0,35кг = 350г.
Контрольні запитання.
1. Дайте загальну характеристику процесу: а) плавлення; б) кристалізація.
2. Питома теплота плавлення заліза 2,5·105Дж/кг. Що це означає?
3. Дайте загальну характеристику процесу: а) пароутворення; в) конденсація.
4. Опишіть ті теплові процеси які відбуваються на кожній ділянці представленого на малюнку графіку.
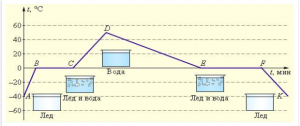
5. Чим горіння відрізняється від нагрівання, пароутворення та плавлення?
6. Яка фізична суть процесу горіння?
7. Що представляє собою полум’я?
8. Звідки береться та енергія яка виділяється в процесі згорання деревини?
9. Яка фізична суть фотосинтезу?
10. Який зв’язок між тією енергією яка виділяється в процесі згорання вугілля, та фотосинтезом?
Вправа 30.
1. Порівняйте величину тієї енергії що йде на випаровування 1кг води, з кінетичною енергією смертельної для людини кулі, маса якої 5г, а швидкість 300м/с. Зробіть висновок.
2. Яку максимальну кількість льоду з температурою 0ºС потрібно покласти в 1,5кг води з температурою 30ºС, щоб лід повністю розтанув?
3. З якої висоти має впасти трьох кілограмова цеглина, щоб своєю кінетичною енергією а) розплавити 1кг льоду; б) випарувати 1кг води? Що можна сказати з цього приводу?
4. Скільки водяного пару з температурою 100ºС потрібно ввести в мідний стакан масою 200г в якому знаходиться 150г льоду з температурою –20ºС щоб увесь лід розтанув?
5. До якої температури потрібно нагріти мідний куб, щоб він будучи покладеним на лід, повністю занурився в нього? Температура льоду 0ºС.
6. В каструлю налили воду з температурою 10ºС і поставили на плиту. Через 10хв вода закипіла. Через який час ця вода повністю випарується?
7. На спиртівці нагріли 300г води від 20°С до 80°С, витративши при цьому 8г спирту. Визначити ККД нагрівальної установки.
8. Визначити ККД двигуна автомобіля, який маючи середню потужність 70кВт витрачає 17кг бензину за годину.
.
§31. Про особливості потенціальної енергії молекул.
Уявити сучасну науку без величини яка називається енергією (від грец. energeia – дія, діяльність) практично не можливо. Адже саме енергія є тією стержневою фізичною величиною яка об’єднує найрізноманітніші явища Природи в цілісну наукову картину. Сучасне розуміння суті того, що називають енергією, це результат тривалого еволюційного розвитку науки, вінцем якого є теорія відносності. Лише після створення цієї теорії, стало зрозумілим, що енергія є загальною мірою всіх видів рухів та взаємодій, і що будь який фізичний об’єкт масою m, представляє собою згусток енергії загальна кількість якої визначається за формулою Е=mс2, де с=3∙108м/с=соnst. Це означає, що повністю перетворивши все те з чого складається дане тіло, а отже всі його молекули, атоми, атомні ядра, протони, нейтрони, електрони та всі ті процеси які відбуваються з ними, в те що називається чистою енергією, а по суті в світло, ви отримаєте цієї енергії в кількості Е=mс2. Наприклад в будь якому тілі масою 1кг міститься Е=1кг(3·108м/с)2=9·1016Дж енергії. Щоб мати уявлення про величину цієї енергії, достатньо сказати, що аналогічну кількість енергії можна отримати при повному згоранні 4 500 000 тон кам’яного вугілля. Для перевезення такої кількості вугілля потрібно більше 75000 вщерть заповнених залізничних вагонів, загальна довжина яких майже 1000км.
Твердження про те, що енергія це загальна міра всіх видів рухів і взаємодій, є загально прийнятою та вичерпною характеристикою того, що називають енергією. Однак воно має той суттєвий недолік, що не дозволяє визначати величину конкретного виду енергії в тій чи іншій конкретній ситуації. А потрібно зауважити, що на практиці говорячи про енергію тіла, мають на увазі не ту загальну енергію яка зосереджена в даному тілі і кількість якої визначається за формулою Е=mс2, а певну, зазвичай мізерну частину цієї енергії яка пов’язана з тим чи іншим конкретним явищем. Наприклад коли ми стверджуємо, що рухоме тіло має певну енергію, то маємо на увазі не повну енергію цього тіла (Е=mс2), а ту її мізерну частину яка обумовлена фактом механічного руху тіла і яка визначається за формулою Е=mv2/2. Коли ми стверджуємо, що підняте над підлогою тіло має певну енергію, то маємо на увазі не повну енергію тіла (Е=mс2), а ту її мізерну частину яка обумовлена взаємодією даного тіла з Землею і яка визначається за формулою Е=mgh. Коли ми стверджуємо, що деформована пружина має певну енергію, то маємо на увазі не повну енергію пружини (Е=mс2), а ту її мізерну частину яка обумовлена взаємодією атомів та молекул пружно деформованого тіла і яка визначається за формулою Е=k∆ℓ2/2. Коли ми стверджуємо, що шматок вугілля має певну енергію, то маємо на увазі не повну енергію цього шматка (Е=mс2), а ту її мізерну частину яка виділяється в процесі згорання вугілля і величина якої визначається за формулою Е=qm.
Задача 1. Яка частина наявної в шматку вугілля енергії, виділяється при його згоранні, якщо питома теплота згорання вугілля 2·107Дж/кг ?
Дано:
q = 2·107Дж/кг
E/Qгор = ?
Рішення. Оскільки величина тієї загальної енергії згустком якої є будь яке тіло визначається за формулою Е = mс2, де с=3·108(м/с), а та кількість енергії яка виділяється при згоранні вугілля визначається за формулою Qгор=qm, то E/Qгор = mс2/qm = c2/q = 3·108м/с)2/2·107Дж/кг = 9·1016(м2/с2)/2·107(м2/с2) = 4,5·109.
Відповідь: при згоранні вугілля виділяється 1/4,5·109 частина наявної в ньому енергії.
З практичної точки зору твердження про те, що той чи інший об’єкт має певну енергію, по суті означає, що за певних умов відповідний об’єкт може виконати певну роботу, тобто певну енергозатратну дію. Власне енергія і є мірою здатності фізичного об’єкту виконувати роботу. Наприклад, коли ми стверджуємо, що підняте над підлогою тіло має енергію Е=mgh, то це означає, що за певних умов (за умови падіння тіла) буде виконана певна робота: в процесі удару об підлогу, тіло деформується і деформує підлогу; в процесі падіння та удару, тіло, підлога та повітря нагріються; в процесі удару, тіло заб’є гвіздок, створить звукову хвилю, тощо, і що загальна величина цієї роботи дорівнюватиме А=mgh. Коли ми стверджуємо, що тіло масою m, рухаючись з швидкістю v, має енергію Е=mv2/2, то це означає, що за певних умов (за умови зустрічі тіла з перешкодою) буде виконана певна робота, і що загальна величина цієї роботи дорівнюватиме А=mv2/2. Коли ми стверджуємо, що деформована пружина має енергію Е=k∆ℓ2/2, то це означає, що за певних умов (за умови випрямлення пружини), буде виконана певна робота, і що загальна величина цієї роботи дорівнюватиме А=k∆ℓ2/2. Коли ми стверджуємо, що шматок вугілля має енергію Е=qm, то це означає, що за певних умов вугілля буде горіти і що в процесі горіння буде виконана певна робота, загальна величина якої дорівнюватиме А=qm.
Мал.91. Коли ми стверджуємо, що певний фізичний об’єкт має певну енергію, то це означає, що цей об’єкт здатний виконати певну роботу.
Зважаючи на вище сказане, можна дати наступне визначення: Енергія – це фізична величина, яка є загальною мірою всіх видів рухів та взаємодій і яка характеризує здатність тіла, частинки або поля виконати роботу (певну енергозатратну дію).
Позначається: Е
Визначальне рівняння: 1) для загальної кількості енергії: Е = mс2;
. 2) для конкретних видів енергії: різні.
Одиниця вимірювання: [E] = Дж = Н∙м = кг∙м2/с2, джоуль.
Вивчаючи фізику ви неодноразово переконувались і ще неодноразово переконаєтесь в тому, що енергія невичерпно різноманітна у своїх проявах. Різноманітна в тій же мірі як і самі явища Природи. Наприклад говорять про енергію гравітаційних, електричних, електромагнітних та інших полів. Про енергію механічну, теплову, звукову, світлову, хімічну, біологічну, електричну, магнітну, електромагнітну, ядерну, внутрішню. Про енергію піднятого тіла та енергію пружно деформованого тіла, про енергію нагрітого тіла та енергію тіла що горить, про енергію хімічних реакцій та енергію термоядерного синтезу. І навіть те що не називають енергією, як то температура, кількість теплоти, робота чи маса, фактично характеризує ті чи інші прояви енергії.
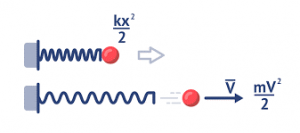
Та якими б різноманітними не були прояви енергії, а будь який з цих проявів можна представити у вигляді певної комбінації двох базових різновидностей енергії: енергії руху (кінетична енергія Ек) та енергії взаємодії (потенціальна енергія Еп). При цьому кінетична енергія є явною, очевидною, активною формою енергії, наявність і величину якої легко встановити: якщо той чи інший фізичний об’єкт, будь то камінь, планета, атом, фотон світла, чи що завгодно, маючи масу m рухається з швидкістю v, то цей об’єкт має кінетичну енергію величина якої визначається за формулою Ек=mv2/2. Але окрім цією активної енергії, практично з кожним тілом нерозривно пов’язана певна кількість пасивної, прихованої енергії, яку прийнято називати потенціальною.
Потенціальна енергія (енергія взаємодії) – це та енергія яку має фізичний об’єкт за рахунок того, що він так чи інакше взаємодіяє з іншими об’єктами, або за рахунок тих взаємодій які відбуваються в середині цього об’єкту.
Позначається: Еп
Визначальне рівняння: Еп=?, це означає, що єдиної, універсальної формули для визначення потенціальної енергії не існує.
Одиниця вимірювання: [Еп] = Дж.
Потенціальна енергія, це дуже складний вид пасивної, прихованої енергії, величину якої в загальному випадку ми не вміємо визначати. Не вміємо в тому сенсі, що на сьогоднішній день нема тієї універсальної формули, яка б дозволяла визначати потенціальну енергію системи в усьому різноманітті проявів цієї енергії. Втім, це зовсім не означає, що ми не вміємо визначати величину потенціальної енергії в тих чи інших конкретних випадках. Наприклад, в механіці ми вивчали дві різновидності потенціальної енергії, кожна з яких мала певне визначальне рівняння: потенціальна енергія сили тяжіння (Еп=mgh), та потенціальна енергія сили пружності (Еп=kΔℓ2/2), Але як би там не було, а фактом залишається те, що на сьогоднішній день універсальної формули для визначення потенціальної енергії не існує.
Складність потенціальної енергії полягає не лише у відсутності тієї універсальної формули за якою ця енергія визначається, а й у прихованості проявів цієї енергії. При цьому часто буває так, що за одних обставин потенціальна енергія жодним чином не проявляє себе, а за інших – виникаючи ніби нізвідки, ця енергія стає очевидно наявною. Скажімо вивчаючи молекулярну фізику, та виходячи з того, що енергія взаємодії молекул прагне об’єднати ці молекули в єдине ціле, а енергія руху прагне розірвати зв’язки між молекулами і розкидати їх, ми зробили висновок про те, що в твердих тілах потенціальна енергія молекул значно більша за їх середню кінетичну енергію Еп > Ек, а в газоподібних тілах – навпаки Еп < Ек. На перший погляд даний висновок є очевидно правильним. Однак не будемо поспішати. Адже якщо мова йде про потенціальну енергію, то відносно неї навіть очевидно правильні висновки можуть виявитися хибними і навпаки. Ілюструючи дане твердження розв’яжемо наступну задачу.
Задача 2. Лід, вода і водяний пар мають температуру 0ºС. В якому з цих станів потенціальна енергія молекул води є найбільшою, а в якому найменшою?
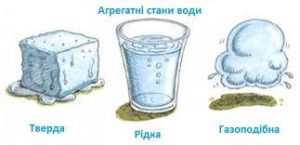
. Еп > Ек Еп ≈ Ек Еп < Ек
. 0ºС 0ºС 0ºС
Загальні зауваження. Факт того, що в твердому льоді молекули води міцно з’єднані між собою, а в газоподібному парі ці молекули практично не взаємодіють, очевидно вказує на те, що потенціальна енергія молекул льоду Епл має бути більшою за потенціальну енергію молекул рідкої води Епв, а та в свою чергу – більшою за потенціальну енергію молекул пару Епп. Іншими словами, логіка очевидних міркувань вказує на те, що Епл > Епв > Епп.
Втім, якщо мова йде про об’єктивне оцінювання наявної в системі кількості енергії, а тим більше про порівняння цієї кількості в різних станах системи, то потрібно керуватися не логікою суб’єктивних міркувань, а законом збереження енергії. А це означає, що відповідаючи на запитання «в якому стані системи енергії більше?», потрібно запитати «а що треба зробити (добавити енергію або відібрати її), щоб перейти від одного стану системи до іншого?». Зважаючи на вище сказане, розв’язуємо дану задачу.
Рішення. Оскільки температура льоду, води і пару однакова (tл=tв=tп=0ºС), то середня кінетична енергія молекул Н2О в льоді, воді і пару, є однаковою Екл = Екв = Екп =(3/2)kT. З іншого боку, для того щоб при температурі 0ºС лід перетворився на воду, необхідно до наявної в ньому внутрішньої енергії (Uл=∑Ек+∑Еп) додати ту енергію яка піде на плавлення льоду Qпл=λm. А це означає, що у відповідності з законом збереження енергії Uв = Uл + Qпл. А оскільки загальна кінетична енергія молекул льоду і води є однаковою, то можна записати (∑Еп)в = (∑Еп)л + Qпл. А це означає, що при температурі 0ºС потенціальна енергія молекул Н2О у рідкій воді більша аніж у твердому льоді, тобто Епв > Епл. Аналогічно можна стверджувати: Uп = Uв + Qпар, тому (∑Еп)п = (∑Еп)в + Qпар, а отже Епп > Епв.
Відповідь: при температурі 0ºС потенціальна енергія молекул пару є найбільшою, а молекул льоду – найменшою: Епл < Епв < Епп.
Говорячи про потенціальну енергію молекул, потрібно мати на увазі, що ця енергія є відносною величиною. Наприклад, коли ми стверджуємо, що потенціальна енергія молекул газу дорівнює нулю, то це зовсім не означає що вона дійсно дорівнює нулю. Це навіть не означає, що ця енергія дійсно мала. Більше того, це навіть не означає, що потенціальна енергія молекул газу дійсно менша за їх кінетичну енергію. Твердження про те, що потенціальна енергія молекул газу є мізерно малою, означає лише те, що на рівні тих процесів які відбуваються в газі, вплив потенціальної енергії молекул на ці процеси є несуттєвим. Несуттєвим тому, що левова частина потенціальної енергії молекул газу прихована на рівні внутрішньо молекулярних взаємодій які на рівні міжмолекулярних взаємодій практично не проявляє себе.
Ситуація нагадує таку, коли перебуваючи на рівні третього поверху, ви проводите експерименти з тими пружними кульками які рухаються гладенькою підлогою цього поверху. Аналізуючи кінематичну поведінку кульок, ви робите висновок, що ця поведінка не залежить від того, що відносно рівнів першого та другого поверхів, кожна кулька має певний запас потенціальної енергії. Та от в підлозі з’являється отвір, потрапляючи в який кульки опиняються на рівні підлоги другого поверху. При цьому неминуче з’ясовується, що та прихована потенціальна енергія, яка на рівні третього поверху жодним чином не проявляла себе, на рівні другого поверху, перетворюється на відповідну кількість кінетичної енергії та відповідним чином впливає на кінематичну поведінку кульок.

Мал.92. Потенціальна енергія є відносною величиною.
Зважаючи на вище сказане, не дивуйтесь тому, що в процесі конденсації виділяється величезна кількість теплової енергії. Просто в процесі конденсації молекули речовини «падають» з більш високого енергетичного рівня (поверху) на більш низький. При цьому та прихована потенціальна енергія яка на рівні поверху «газ» практично не проявляла себе, на рівні більш низького поверху «рідина» перетворюється на відповідну кількість кінетичної енергії (теплоти).
Загалом, говорячи про внутрішню енергію тіла та про її потенціальну і кінетичну складові, потрібно пам’ятати, що мова йде про певну відносну величину значення якої залежить від рівня деталізації внутрішнього устрою тіла. Скажімо якщо виходити з того, що тіло складається з молекул, то його внутрішня енергія визначається як сума кінетичних і потенціальних енергій всіх молекул цього тіла. Якщо ж враховувати факт того, що молекули складаються з атомів, атоми – з ядра і електронів, атомні ядра – з протонів та нейтронів, то визначаючи внутрішню енергію тіла потрібно враховувати кінетичні та потенціальні енергії його атомів, атомних ядер, електронів, протонів, нейтронів, а зрештою і ту енергію згустками якої є самі протони, нейтрони та електрони. А оскільки будь яке тіло є певною цілісною системою всі елементи та події якої взаємопов’язані і взаємообумовлені, то нема нічого дивного в тому, що при фазових переходах (плавлення – кристалізація, пароутворення – конденсація, сублімація – десублімація), певна кількість раніше прихованої потенціальної енергії, перетворюється на відповідну кількість явної кінетичної енергії і навпаки. Втім, потрібно зауважити, що перетворення потенціальної енергії молекул в їх кінетичну енергію і навпаки, відбувається не лише при фазових переходах речовини, а й в процесі її нагрівання та охолодження. Кількісно ілюструючи такі перетворення розв’яжемо наступну задачу.
Задача 3. Відомо, що для нагрівання 1кг води на 1°С потрібно витратити 4200Дж енергії. На скільки при цьому збільшується середня потенціальна енергія однієї молекули води?
Дано:
m = 1кг
ΔE = 4200Дж
Δt = 1°C
ΔEп1 = ?
Рішення. Будемо виходити з того, що надана воді енергія ΔE, частково йде на збільшення кінетичної енергії її молекул NΔEк1, а частково – на збільшення їх потенціальної енергії NΔEп1, тобто ΔЕ = NΔEк1 + NΔEп1, де N – кількість молекул в 1кг води: N = m/m0 = 1кг/18·1,66·10–27кг = 33,5·1024молекул. Оскільки молекули води (Н2О) є трьохатомними, то ΔЕк1=3kΔT= 3·1,38·10–23(Дж/К)·1К = 4,14·10–23Дж. При цьому NΔEк1 = 33,5·1024·4,14·10–23Дж = 1380Дж.
Таким чином NΔEп1 = ΔЕ – NΔEк1 = 4200Дж – 1380Дж = 2820Дж.
Звідси, ΔЕп1 = 2820Дж/33,5·1024 = 84·10–24Дж = 8,4·10–23Дж
Відповідь: ΔЕп1 = 8,4·10–23Дж.
Загальні зауваження. Факт того, що в процесі нагрівання більша частина наданої воді енергії йде не на збільшення кінетичної енергії її молекул (ΔЕк1= 4,14·10–23Дж), а на збільшення їх потенціальної енергії (ΔЕп1 = 8,4·10–23Дж), зовсім не означає, що відповідним чином змінюється та потенціальна енергія молекул води, яка визначальним чином впливає на фізичні властивості води як рідини. Мова йде лише про те, що в процесі нагрівання, певна частина наданої тілу енергії перетворюється на приховану енергію тих процесів які відбуваються всередині молекул Н2О і які майже не впливають на фізичні властивості води як рідини.
Контрольні запитання.
1.Що означає твердження: загальна кількість зосередженої в тілі енергії визначається за формулою Е=mс2?
2. Про який вид енергії йде мова, коли величину цієї енергії визначають за формулою: а) Е=mv2/2; б) Е=mgh; в) Е=k∆ℓ2/2; г) Е=qm ?
3. Що означає твердження: визначальне рівняння потенціальної енергії Еп = ?.
4. На підставі яких міркувань ми стверджуємо, що для твердих тіл Еп > Ек, а для газоподібних Еп < Ек ?
5. Де більше енергії в суцільній склянці чи в тих осколках на які ця скляна розбилась?
6. Коли ми стверджуємо, що потенціальна енергія молекул газу дорівнює нулю, то що означає це твердження?
7. Наведіть докази того, що в реальності потенціальна енергія молекул газу набагато більша за потенціальну енергію молекул відповідної рідини, а та в свою чергу більша за потенціальну енергію молекул відповідного твердого тіла.
8. Що означає твердження: величина внутрішньої енергії тіла залежить від рівня деталізації його внутрішнього устрою?
Вправа 31.
1.Яка частина наявної в тілі енергії виділяється при його падінні з висоти 1м?
2. Скільки дров потрібно спалити щоб отримати ту енергію згустком якої є тіло масою 1кг, якщо питома теплота згорання дров 8·106Дж/кг? Скільки залізничних вагонів потрібно для того щоб перевезти ці дрова, якщо в один вагон можна завантажити 20т дров?
3. Відомо, що питома теплота плавлення води 3,35·105Дж/кг. На скільки збільшується потенціальна енергія однієї молекули води в процесі плавлення?
4. Відомо, що при температурі кипіння питома теплота пароутворення води 22,6·105Дж/кг. На скільки збільшується потенціальна енергія однієї молекули води в процесі кипіння?
5. Відомо, що питома теплоємність заліза 460Дж/кг·К. На скільки збільшується потенціальна енергія одного атому Fe при нагріванні заліза на 1ºС?
.
§32. Теплове розширення тіл. Особливості теплового розширення води.
Загально відомо, шо при нагріванні як тверді тіла так і рідини розширюються. Однак далеко не всі розуміють, чому це відбувається.
Мал.93. При нагріванні тіла розширюються.
Пояснюючи причини теплового розширення тіл, зазвичай говорять про те, що в процесі нагрівання амплітуда коливань молекул збільшується, і що тому відповідно збільшується відстань між молекулами. З одного боку, це правильно: необхідною умовою теплового розширення твердих і рідких речовин, є збільшення амплітуди коливань їх молекул. Але з іншого боку, збільшення амплітуди коливань молекул, ще не гарантує того, що відстань між молекулами буде збільшуватись. Дійсно. Якщо, наприклад, в зображеній на мал.94 ситуації, амплітуду коливань кульки збільшити, то це не призведе до зміни координати центру динамічної рівноваги цієї кульки. Не призведе тому, що профіль тієї ями в якій відбуваються коливання кульки є симетричним. По суті це означає, що збільшення амплітуди коливань молекул, є необхідною, але не достатньою умовою теплового розширення тіл. Адже якби поведінка молекул була аналогічною поведінці кульки в симетричній ямі, то збільшення амплітуди коливань молекул не призводило б до збільшення відстані між центрами їх рівноваги, а отже і до розширення відповідної речовини.
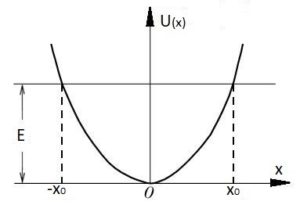
Мал.94. Зміна амплітуди коливань кульки, не призводить до зміни координати її центру динамічної рівноваги.
В §3 ми говорили про те, що енергетичні параметри та поведінку взаємодіючих молекул, описує так звана потенціальна яма, тобто та крива яка описує залежність потенціальної енергії взаємодіючих молекул від відстані між ними (мал.95а). По суті потенціальна яма описує поведінку молекули в процесі її взаємодії з іншими молекулами. А ця поведінка є наступною. У відповідності з принципом мінімуму (будь яка система прагне до того, щоб кількість зосередженої в ній енергії була мінімально можливою), молекула прагне перебувати на дні потенціальної ями, тобто на тій відстані r0 де сили міжмолекулярного притягування зрівноважуються силами міжмолекулярного відштовхування. Однак в реальності молекула, маючи певний запас кінетичної енергії здійснює певні коливання відносно точки рівноваги. А оскільки крива потенціальної енергії взаємодіючих молекул несиметрична, то при збільшенні амплітуди коливань молекул, центр їх динамічної рівноваги певним чином зміщується, а відповідно змінюється і відстань між молекулами (мал.95б).
Таким чином, основною причиною теплового розширення рідин і твердих тіл, є факт того, що та крива яка описує поведінку молекули при її взаємодії з іншими молекулами (потенціальна яма) є несиметричною. Результатом цієї асиметрії є те, що при збільшенні температури речовини, а отже і збільшенні амплітуди коливань молекул, відстані між цими молекулами збільшуються і навпаки – при зниженні температури, ці відстані зменшуються.
а)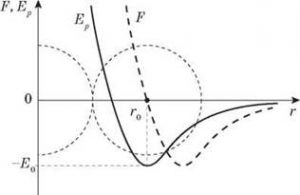 б)
б)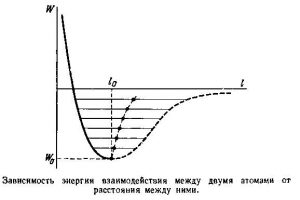
Мал.95 При збільшенні амплітуди коливань молекули, центр її динамічної рівноваги зміщується і тому відстань між молекулами збільшується.
Теплове розширення твердих тіл зазвичай характеризують величиною, яка називається температурним коефіцієнтом лінійного розширення. Температурний коефіцієнт лінійного розширення – це фізична величина, яка характеризує теплове лінійне розширення твердого тіла (даного матеріалу) і яка чисельно дорівнює тому лінійному видовженню (∆ℓ) яке отримує тіло довжиною 1м при його нагріванні на 1ºС.
Позначається: α
Визначальне рівняння: α=∆ℓ/ℓ0∆t, де ∆ℓ – теплове видовження тіла при його нагріванні на ∆t (ºС), ℓ0 – початкова довжина тіла;
Одиниця вимірювання: [ℓ] = 1/ºС = ºС–1.
Наприклад, якщо для міді α = 17·10–6(1/ºС), то це означає, що при нагріванні мідного стержня довжиною 1м на 1ºС, цей стержень видовжується на 17·10–6м тобто на 0,017мм. Величина температурного коефіцієнту лінійного розширення кожного матеріалу визначається експериментально і записується у відповідну таблицю, наприклад таку:
Таблиця. Температурний коефіцієнт лінійного розширення деяких матеріалів в інтервалі температур від 0ºС до 100ºС.
| Матеріал | α, 10–6 (1/ºС) | Матеріал | α, 10–6 (1/ºС) |
| алюміній | 23 | срібло | 20 |
| золото | 14 | скло | 9 |
| залізо, сталь | 12 | чавун | 10 |
| мідь | 17 | цинк | 29 |
| свинець | 29 | вольфрам | 4 |
Оскільки в процесі нагрівання змінюються не лише лінійні розміри тіла, а і його об’єм, то теплове розширення характеризують не лише температурним коефіцієнтом лінійного розширення, а й температурним коефіцієнтом об’ємного розширення: β=∆V/V0∆t. Із визначального рівняння β=∆V/V0∆t випливає, що температурний коефіцієнт об’ємного розширення β чисельно дорівнює тому збільшенню об’єму ∆V, яке отримує тіло об’ємом 1м3 при його нагріванні на 1ºС: якщо V0=1м3, ∆t=1ºС, то β=∆V.
Можна довести, що для ізотропних матеріалів β≈3α. Дійсно. Розглянемо куб, довжина ребра якого 1м. Якщо цей куб нагріти на 1ºС, то кожне його ребро видовжиться на α метрів і стане рівним 1+α. З іншого боку, об’єм цього ж куба при нагріванні на 1ºС збільшиться на β метрів кубічних і стане рівним 1+ β. А це означає, що: (1+α)3 = 1+β. Враховуючи, що (1+α)3 = 1+3α+3α2+α3, де 3α2 і α3 – гранично малі величини (3α2~3(10–6)2 = 3·10–12; α3~(10–6)3= 10–18), можна записати: 1+β ≈ 1+3α, звідси β ≈ 3α.
Зазвичай температурним коефіцієнтом об’ємного розширення характеризують теплове розширення рідин. Величина цього коефіцієнту визначається експериментально і записується у відповідну таблицю, наприклад таку:
Таблиця. Температурний коефіцієнт об’ємного розширення деяких рідин, визначений для температури 20ºС
| Рідина | β, 10–6 (1/ºС) | Рідина | β, 10–6 (1/ºС) |
| бензин | 1100 | ртуть | 181 |
| вода | 200 | сірчана кислота | 570 |
| гліцерин | 505 | етиловий спирт | 1080 |
| нафта | 1000 | етиловий ефір | 1600 |
Теплове розширення рідин відбувається з тих же причин, що і теплове розширення твердих тіл, тобто у зв’язку з несиметричністю кривої потенціальної енергії. Температурний коефіцієнт об’ємного розширення рідини, зазвичай значно більший за величину відповідного параметру твердого тіла. При цьому в процесі збільшення температури, величина коефіцієнту об’ємного розширення рідин зростає швидше аніж твердих тіл. Обгрунтованість даних тверджень, випливає з аналізу все тієї ж кривої потенціальної енергії (мал.95). Дійсно. Молекули рідини мають гранично великі амплітуди коливань. А це означає, що в процесі цих коливань молекули заходять в ту частину потенціальної кривої, де навіть незначні зміни температури, призводять до значних змін міжмолекулярних відстаней, а отже до значного розширення.
Безумовно найважливішою рідиною нашого життя є вода. Вода має велику кількість надзвичайних властивостей. І одна з них полягає в тому, що в певному температурному інтервалі, вода в процесі нагрівання не розширюється а ущільнюється (стискається). Ілюструючи достовірність даного твердження звернемося до експерименту, суть якого представлена на мал.96. Візуально зафіксувавши рівень води при температурі 0ºС і поступово нагріваючи воду, ви неодмінно з’ясуєте, що при збільшенні її температури від 0ºС до +4ºС, вода не розширюється, а навпаки – ущільнюється. І лише після того як при температурі +4ºС вода досягне максимального ущільнення, подальше її нагрівання буде супроводжуватись об’ємним розширенням.
Мал.96. В процесі нагріванні від 0ºС до +4ºС вода не розширюється, а ущільнюється – експериментальний факт.
Факт того, що в процесі нагрівання від 0ºС до +4ºС вода не розширюється, а ущільнюється має своє пояснення. І це пояснення полягає в наступному. Як відомо, в кристалічній структурі льоду, молекули води розташовані у вигляді не надто щільних об’ємних шестикутників (мал.97). Результатом такого розташування є те, що густина льоду значно менша за густину води. Дослідження показують, що утворення окремих стійких, просторово упорядкованих груп молекул Н2О, починається задовго до початку явної кристалізації води (приблизно з 7ºС) і що по мірі зниження температури, кількість таких груп неухильно збільшується. Це означає, що при температурі 0ºС рідка вода представляє собою певну суміш як хаотично розташованих молекул Н2О, так і тих що об’єднані в об’ємні шестикутні групи. В процесі нагрівання води, кількість об’ємних шестикутних груп поступово зменшується, а густина рідини відповідно збільшується і досягає своєї максимальної величини при температурі +4ºС.


Мал.97. Щільність розташування молекул Н2О в рідкій воді значно більша аніж в твердому льоду.
Той факт, що густина води є максимально великою не при 0ºС, а при +4ºС, має величезне значення для багатьох природних процесів. Наприклад, якби вода не мала таких властивостей, то при тривалих мінусових температурах, ставки, річки та озера, достатньо швидко промерзали б до дна. Промерзали б тому, що та вода яка контактує з холодним повітрям, охолоджуючись опускалась би на дно водойми. При цьому, в результаті конвекційного кругообігу, температура всієї води досить швидко досягала б нулевої позначки і вся вода швидко перетворювалась би на лід. І якщо цього не відбувається, то це тільки тому, що подібним конвекційним чином, вода охолоджується лише до температури 4ºС. Подальше ж зниження температури відбувається лише за рахунок теплопровідності, яка для води є досить низькою. Крім цього, коли верхній шар води перетворюється на лід, то цей лід автоматично стає певним тепловим ізолятором, який додатково знижує інтенсивність процесу кристалізації води.
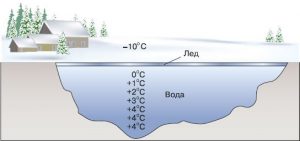
Мал.98. Характер розподілу температур в покритій кригою водоймі.
Складний характер залежності коефіцієнту об’ємного розширення води від температури, вкотре доводить, що реальні властивості реальних фізичних об’єктів, залежать від цілого комплексу обставин. Тому, коли ми стверджуємо, що причиною теплового розширення тіл є несиметричність кривої потенціальної енергії, то маємо на увазі лише те, що ця причина є загальною та визначальною. Але це не виключає того, що за певних конкретних обставин, на теплове розширення тіла можуть суттєво впливати й інші фактори. Або наприклад, коли ми стверджуємо, що коефіцієнт об’ємного розширення рідини сильно залежить від температури, то маємо на увазі лише той факт, що для більшості рідин, така залежність має місце. Однак це зовсім не означає, що подібна залежність характерна для всіх рідин. Скажімо, коефіцієнт об’ємного розширення ртуті, в достатньо широкому інтервалі температур, залишається практично незмінним. Власне тому, саме ртуть застосовують для виготовлення точних термометрів.
Теплове розширення тіл, потрібно враховувати при спорудженні мостів, колій залізничних доріг, ліній електропередач, трубопроводів, тощо. Його обов’язково враховують при виготовлені цілісних конструкцій складовими елементами яких є різнорідні матеріали. Наприклад, при виготовлені залізобетонних конструкцій, марки сталі і бетону добирають таким чином, щоб їх температурні коефіцієнти були приблизно однаковими.

Мал.99. Деякі приклади боротьби з шкідливими проявами теплового розширення.
Про ефекти теплового розширення, потрібно пам’ятати і в тих випадках, коли тіло перебуває під дією різких перепадів температур. Наприклад, скляну банку з окропом не можна опускати в холодну воду. Пам’ятаючи про факт розширення води при її замерзанні, потрібно не допускати цього замерзання в трубах, деталях машин, відрах, тощо. Теплове розширення потрібно враховувати при виконанні вимірювальних робіт, при виготовлені вимірювальних інструментів, тощо.
Ефекти теплового розширення мають і певне корисне застосування. Наприклад, в терморегуляторах електронагрівальних приладів, в різноманітних протипожежних системах, в спеціальних термометрах, часто застосовують так звані біметалеві пластини (від лат. bini – пара, два). Ці пластини складаються з двох, жорстко з’єднаних різнорідних металів, температурні коефіцієнти яких, суттєво різні. В процесі нагрівання, складові елементи біметалевої пластини деформуються суттєво по різному. При цьому пластина відповідним чином вигинається і виконує певну корисну дію, наприклад включає чи виключає електронагрівальний прилад.
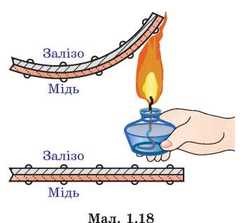
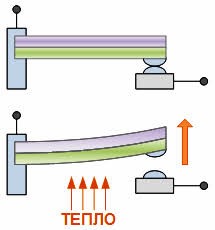
Мал.100. Загальний устрій та приклад застосування біметалевої пластини.
В процесі нагрівання розширюються не лише рідини і тверді тіла, а й гази. При цьому гази розширюються не тому, що крива потенціальної енергії є не симетричною, а за рахунок того, що в процесі нагрівання, кінетична енергія молекул збільшується, а відповідно збільшується і їх тиск на стінки посудини. В 1802 році, французький фізик Гей-Люсак експериментально встановив: при ізобаричному нагріванні, всі гази розширюються однаково, при цьому їх температурний коефіцієнт об’ємного розширення становить 1/273(1/ºС). Таким чином, на відміну від рідин та твердих тіл, характер теплового розширення яких у кожному конкретному випадку є індивідуальним, всі гази розширюються практично однаково, тобто з однаковим коефіцієнтом об’ємного розширення: β = 1/273(1/ºС) або β= 3660·10–6(1/ºС).
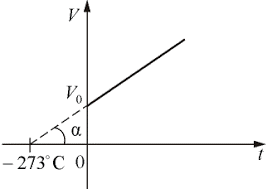
Мал.101. При ізобаричному нагріванні, всі гази розширюються однаково, при цьому їх температурний коефіцієнт об’ємного розширення становить 1/273(1/ºС).
Потрібно зауважити, що коли ми говоримо про теплове розширення тіл, то маємо на увазі, що зовнішній тиск на ці тіла залишається незмінним. Адже якщо, наприклад, рідина знаходиться в жорсткій, міцній, герметичній посудині, то навіть при значному збільшенні температури, об’єм рідини залишиться незмінним (звичайно, якщо не враховувати розширення самої посудини).
Задача 1. При температурі 10ºС сталева ферма залізничного моста має довжину 75м. На скільки переміщується вільний кінець ферми при зміні температури від –35ºС до +40ºС?
Дано:
сталь
t0 = 10ºС
ℓ0 = 75м
t1 = –35ºС
t2 = 40ºС
∆ℓ = ?
Рішення: Із аналізу умови задачі ясно ∆ℓ = ∆ℓ1 + ∆ℓ2 Оскільки α = ∆ℓ/ℓ0∆t, то ∆ℓ = αℓ0∆t, де α(сталі) = 12·10–6(1/ºС).
∆ℓ1 = 12·10–6(1/ºС)·75м·45(ºС) = 4,1·10–2м = 4,1см;
∆ℓ2 = 12·10–6(1/ºС)·75м·30(ºС) = 2,7·10–2м = 2,7см
∆ℓ = 4,1см + 2,7см = 6,8см.
Відповідь: ∆ℓ = 6,8см.
Задача 2. На скільки відсотків збільшиться об’єм бензину при його нагріванні від 5°С до 25°С, якщо в цьому температурному інтервалі, коефіцієнт об’ємного розширення бензину 12,0·10–4(1/°С)?
Загальні зауваження. В фізиці, на перший погляд незначні нюанси умови задачі загалом і поставленого запитання зокрема, часто мають надзвичайно велике значення. Наприклад, якби в даній задачі запитувалось: «на скільки зміниться об’єм бензину?», то це б означало, що потрібно визначити ΔV = Vк –Vп. А от запитання: «на скільки відсотків зміниться об’єм бензину?», означає що треба визначити ΔV/V0. При цьому визначити у відсотках: ΔV/V0 = (ΔV/V0)100%.
Дано:
t1 = 5°С
t2 = 25°С
β =12,0·10–4(1/°C)
(ΔV/V0)100% = ?
Рішення: Оскільки за визначенням β = ΔV/V0Δt, то ΔV/V0 = βΔt = β(t2 – t1).
Розрахунки: ΔV/V0 = 12,0·10–4(1/°C)(25°С – 5°С) = 240·10–4 = 0,0240 = 2,4%
Відповідь: ΔV/V0 = 2,4%
Висновок: влітку, восени і взимку, за одних і тих же показань лічильника, водії отримують суттєво різну кількість бензину.
Контрольні запитання.
1.Чому збільшення амплітуди коливань молекул є необхідною але не достатньою умовою теплового розширення тіл?
2. Температурний коефіцієнт лінійного розширення заліза 12·10–6(1/ºС). Що це означає?
3. Температурний коефіцієнт об’ємного розширення бензину 1240·10–6(1/ºС). Що це означає?
4. Поясніть, чому величина температурного коефіцієнту об’ємного розширення твердих та рідких речовин, при збільшені температури збільшується?
5. Поясніть, чому вода при її нагріванні від 0ºС до 4ºС не розширюється а стискається?
6. Поясніть, чому навіть за тривалих тріскучих морозів ставки, річки та озера не перемерзають до дна?
7. Поясніть будову та принцип дії біметалевої пластини.
8. Чим теплове розширення газів принципово відрізняється від теплового розширення твердих тіл та рідин?
Вправа 32.
1.При температурі 20ºС відміряли 500м алюмінієвого і 500м мідного дроту. Якою буде різниця довжин цих дротів при температурі 100ºС?
2. Сталеві залізничні рейки (α=14·10–61/ºС) довжиною 12м монтують при температурі 15ºС. Який зазор потрібно встановити між рейками, якщо експлуатаційні перепади температур від –30ºС до 60ºС?
3. При проходженні струму через алюмінієвий дріт довжиною 6,00м, ця довжина збільшилась на 20мм. Наскільки градусів збільшилась довжина дроту?
4. Густина алюмінію при 20ºС становить 2,7·103кг/м3. Визначити цю густину при 300ºС.
5. В танкер при температурі 40ºС завантажили 30 000м3 нафти. На скільки меншим буде цей об’єм при розвантаженні нафти, якщо її температура становитиме 5ºС?
6. На скільки відсотків зміниться об’єм води при її охолоджені від 40 до 20°С, якщо в цьому температурному інтервалі коефіцієнт об’ємного розширення води 3,0·10–4(1/°С)?
7. При температурі 20ºС чавунне колесо трамваю має діаметр 1150мм, а діаметр призначеного для нього сталевого бандажу 1145мм. До якої температури потрібно нагріти бандаж, щоб зазор між ним і колесом становив 1,0мм?
.
§33. Загальні відомості про термодинаміку.
Вивчаючи молекулярну фізику, ми виходили з того, що навколишній світ складається з молекул які рухаються та певним чином взаємодіють між собою. Спираючись на ці прості базові твердження, ми збудували струнку наукову теорію, яка дозволяє пояснити широке коло природних явищ. І ці пояснення виявилися не лише достовірними а й гранично наглядними. Тому сьогодні нам важко уявити, що властивості твердих, рідких і газоподібних речовин, процеси нагрівання, плавлення, пароутворення, дифузії, горіння, тощо, можна пояснити не згадуючи про молекули. Тим не менше, це можливо. А доказом тому є наука, яка називається термодинамікою. Термодинаміка – це розділ фізики, в якому вивчають загальні властивості твердих, рідких і газоподібних речовин, та ті теплові процеси які відбуваються з ними.
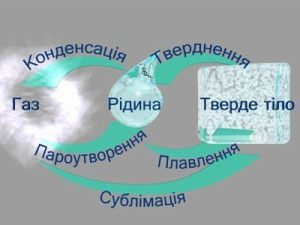
Мал.102. Термодинаміка вивчає загальні властивості речовин та ті теплові процеси які відбуваються з ними.
Термодинаміка одна з небагатьох наук, яка має точну дату свого народження – 1824 рік. Саме цього року вийшла в світ книга молодого французького інженера Саді Карно (1796 – 1832), яка називалась «Роздуми про рушійну силу вогню і про машини здатні розвивати цю силу». В цій книзі Карно не лише пояснив закономірності перетворення теплоти в механічну роботу а й заклав основи тієї науки, яку сьогодні називають термодинамікою.
Потрібно зауважити, що поява науки про закономірності перетворення теплоти в механічну роботу, була очікуваною подією. Адже на початку 19-го століття з’явилися перші парові машини, які з одного боку дали колосальний поштовх для розвитку машинного виробництва, а з іншого – мали надзвичайно низьку енергетичну ефективність. Адже коефіцієнт корисної дії тогочасних парових машин не перевищував 4%. Ясно, що в такій ситуації потреби виробництва вимагали створення більш ефективних машин. А створити таку машину без розуміння тих процесів які в ній відбуваються практично неможливо. Тому перед тогочасною наукою постала цілком конкретна та практично важлива задача: дослідити закономірності перетворення теплоти в механічну роботу і з’ясувати умови за яких це перетворення буде максимально ефективним.
Саме таку задачу поставив перед собою і блискуче розв’язав військовий інженер Саді Карно. Дослідивши роботу тогочасних парових машин, Карно не лише сформулював та пояснив закономірності переходу теплоти в механічну роботу і не лише визначив ті умови за яких цей перехід буде гранично ефективним, а й розробив такий механізм дослідження властивостей речовин, який не передбачав певних знань про внутрішній устрій цих речовин. Цей механізм виявився настільки дієвим та ефективним, що дозволив створити абсолютно нову науку – термодинаміку.
По суті термодинаміка і молекулярна фізика вивчають та пояснюють одне і теж: загальні властивості твердих рідких і газоподібних речовин та ті теплові процеси які відбуваються з цими речовинами. Однак вивчають і пояснюють по різному. Молекулярна фізика виходить з того, що всі речовини складаються з надзвичайно дрібненьких частинок (молекул) які безперервно рухаються і певним чином взаємодіють між собою. Термодинаміка ж, пояснюючи те саме, виходить з іншого: при будь яких процесах що відбуваються в замкнутій системі, загальна кількість енергії цієї системи залишається незмінною, при цьому теплова енергія сама по собі не може переходити від холодного тіла до гарячого.
Звичайно, твердження про те, що молекулярна фізика і термодинаміка, це дві науки про одне і теж, є певним перебільшенням. Адже мова йде про дві різні, в певному сенсі протилежні науки, кожна з яких має свої специфічні особливості та сфери переважного застосування. Однак за великим рахунком, ці дві різні науки дійсно вивчають та пояснюють одну і туж групу споріднених явищ.
Якщо ж говорити про те, яким чином та чому виникли дві різні науки про одне і теж, то цей факт має певні історичні передумови і певні історичні пояснення. А ці передумови та пояснення полягають в наступному. Про існування молекул люди здогадувались дуже давно. Принаймі ще за 400 років до нашої ери давньогрецькі вчені обгрунтовано стверджували, що всі тіла складаються з надзвичайно дрібненьких частинок, які певним чином взаємодіють між собою. Однак факт того, що молекули дійсно існують був науково доведений лише в 1908 році. В такій ситуації, ті вчені які вірили в існування молекул, створили молекулярну фізику, тобто науку в якій загальні властивості речовин пояснювались виходячи з того, що ці речовини складаються з молекул.
З іншого боку, були вчені які намагались не приймати на віру ті твердження достовірність яких була сумнівною. Адже якби там не було, а до 1908 року, факт існування молекул не був науково доведеним. Тому ті вчені, які грубо кажучи не вірили в існування молекул, створили термодинаміку – науку, в якій загальні властивості речовин пояснювались на основі певних, на той час достовірно встановлених фактів, зокрема того, що прийнято називати законом збереження енергії.
Ви можете запитати: «якщо дві різні теорії, одні і ті ж події пояснюють по різному, то чи не означає це, що бодай одна з них є хибною?» Ні, не означає. Бо правильність чи неправильність теорії визначається не тим, подобається нам ця теорія чи не подобається. І навіть не тим, розуміємо ми її чи не розуміємо. Правильність чи неправильність теорії визначається тим, співпадають її передбачення з результатами відповідних експериментів чи не співпадають. І якщо передбачення теорії в точності співпадають з результатами експериментів, то ця теорія є науковою і правильною. А якщо не співпадають – то ми маємо справу з чим завгодно, тільки не з тим що прийнято називати науковою теорією. І в цьому сенсі як молекулярна фізика так і термодинаміка є безумовно науковими та безумовно достовірними теоріями. Адже всі передбачення кожної з них, в точності співпадають з результатами відповідних експериментів, при цьому не існує жодного експериментального факту який би суперечив цим теоріям. Звичайно в межах достовірності відповідних теорій.
Та як би там не було, а молекулярна фізика і термодинаміка, це дві абсолютно різні науки. Ці науки відрізняються не лише своїми базовими твердженнями, а й тими методами наукових досліджень які складають їх методологічну основу. Загалом, розрізняють три базових методи наукових досліджень: динамічний (або механічний), статистичний та термодинамічний. Скажімо, вивчаючи механіку ми практично завжди застосовували так званий динамічний метод досліджень. Суть цього методу полягає в тому, що знаючи початкові параметри руху тіл та ті закони за якими вони рухаються і взаємодіють, однозначно визначають параметри руху відповідних тіл в будь який момент часу. Наприклад, якщо дві пружні кульки відомих мас і відомих швидкостей, рухаються назустріч одна одній, то на основі законів ньютонівської механіки можна однозначно передбачити поведінку цих кульок як до так і після їх взаємодії.
Ясно, що застосувати динамічний метод досліджень до системи яка складається з мільярдів трильйонів молекул, практично не можливо. І не тільки тому, що цих молекул надто багато. А й тому, що самі молекули, це надзвичайно складні системи, поведінка яких описується не менш складними законами квантової механіки. Зважаючи на ці обставини, в молекулярній фізиці застосовують статистичний метод досліджень, тобто такий метод наукових досліджень при якому поведінку складної системи описують на основі відомих законів механіки та статистично усереднених параметрів окремих елементів цієї системи.
Скажімо в молекулярній фізиці ми говорили не про швидкість окремо взятої молекули, не про її кінетичну та потенціальну енергію, а про певним чим усереднену швидкість молекул, про їх середню кінетичну енергію, середню потенціальну енергію, тощо. При цьому, на основі цих усереднених характеристик молекул, та базі законів ньютонівської механіки, ми успішно пояснили широке коло тих явищ які є предметом вивчення молекулярної фізики.
Але виявляється, що поведінку складної системи можна спрогнозувати і не говорячи про її внутрішню будову. Наприклад не говорячи про те що тіла складаються з молекул. Таке прогнозування здійснюють на основі термодинамічного методу досліджень. Суть цього методу полягає в тому, що поведінку складної системи описують на основі тих параметрів які характеризують цю систему вцілому та тих законів які відображають взаємопов’язаність цих параметрів. Наприклад, охарактеризувавши стан певної маси газу (m=const) його об’ємом (V), тиском (р) та температурою (Т) і визначивши ті зв’язки що існують між цими величинами, не важко визначити відповідні параметри газу в тій чи іншій конкретній ситуації. При цьому не важливо знаєте ви про те що гази складаються з молекул, чи не знаєте. Розумієте що тиск, це усереднений результат ударів молекул чи не розумієте. Важливо лише те, що вам відомо: для постійної маси газу виконується співвідношення рV/T = const. А знаючи це співвідношення ви можете визначити параметри газу в тій чи іншій конкретній ситуації. Саме такий підхід і реалізується в термодинаміці.
В межах програми загальноосвітньої школи, переважна більшість тих явищ що є предметом вивчення термодинаміки, вивчається та пояснюється в молекулярній фізиці. Головна перевага молекулярної фізики в її наочності, а отже зрозумілості. Адже в молекулярній фізиці кожен об’єкт, кожну фізичну величину і кожне явище можна представити у вигляді певних наочних образів. Наприклад, молекули можна представити у вигляді пружних кульок; температуру – можна представити як міру середньої кінетичної енергії хаотичного руху молекул; тиск – як усереднений результат ударів молекул; пароутворення – як процес вильоту молекул з рідини і т.д.
Якщо ж говорити про термодинаміку, то ця наука є менш наочною і тому менш зрозумілою. Однак не потрібно думати, що термодинаміка чимось гірша за молекулярну фізику. Зовсім ні. Більше того. В певному сенсі, термодинаміка є більш точною і більш загальною наукою. Адже її висновки та передбачення отримують без використання спрощених моделей на кшталт ідеальний газ, ідеальна рідина, кристалічна решітка, тощо. Молекулярна ж фізика, обійтись без таких моделей не може.
Об’єктивно сильною і в той же час суб’єктивно слабкою стороною термодинаміки є те, що до вирішення поставлених задач вона підходить виключно з формально математичних позицій. В термодинаміці не важливо на скільки добре ви розумієте суть того що називаєте речовиною, теплотою, температурою, тиском, внутрішньою енергією чи ентропією. В термодинаміці важливо знати її базові аксіоми і вміти на основі цих аксіом та математичного аналізу, отримувати формальні рішення конкретних задач. Такий підхід дозволяє одержувати точні, достовірні результати, що є безумовним плюсом термодинаміки. В той же час, подібний формалізм позбавляє термодинаміку наочності і зрозумілості, що є безумовним недоліком цієї науки.
Оскільки переважна більшість того, що є предметом вивчення термодинаміки вивчається і пояснюється в молекулярній фізиці, та зважаючи на малоприємний формалізм термодинаміки, в межах програми загальноосвітньої школи нема нагальної потреби вивчати термодинаміку як окремий розділ фізики. Цілком достатньо стисло ознайомитись з базовими законами термодинаміки. Власне про ці закони ми і поговоримо в двох наступних параграфах. Втім, для тих хто має потребу, бажання і наснагу до більш детального вивчення загальних основ термодинаміки, ці основи викладені у відповідній додатковій темі, вивчення якої не є обов’язковим.
Контрольні запитання.
1.Чим схожі та чим відрізняються молекулярна фізика і термодинаміка?
2. Як склалося так, що для пояснення однієї і тієї ж групи явищ, було створено дві різні науки?
3. Якщо молекулярна фізика і термодинаміка по різному пояснюють одні і ті ж явища, то чи не означає це, що пояснення однієї з цих наук з хибними? Чому?
4. Чому в межах шкільної програми властивості речовин пояснюють головним чином на основі молекулярної фізики а не термодинаміки?
5. Поясніть суть динамічного методу досліджень.
6. Поясніть суть статистичного методу досліджень.
7. Поясніть суть термодинамічного методу досліджень.
8. Чим схожі і чим відрізняються динамічний і статистичний методи досліджень?
9. Чим схожі і чим відрізняються статистичний і термодинамічний методи досліджень?
.
§34. Перше начало термодинаміки.
Закон збереження енергії, це фундаментальний закон Природи, який виконується у всіх відомих фізичних, хімічних, біологічних та інших процесах. При цьому, в різних розділах сучасної науки ви можете зустріти велике різноманіття на перший погляд різних, а по суті споріднених законів, які є прямими або опосередкованими формулюваннями закону збереження енергії. Наприклад, золоте правило механіки, закон Бернуллі, рівняння теплового балансу, другий закон Кірхгофа, перше начало термодинаміки, рівняння Ейнштейну для фотоефекту, це певні формулювання або опосередковані наслідки одного і того ж закону – закону збереження енергії. Закону в якому стверджується: При будь яких процесах, що відбуваються в замкнутій системі, загальна кількість енергії цієї системи, залишається незмінною, тобто зберігається. Іншими словами: ∑Едо = ∑Епісля (загальна кількість енергії до події, дорівнює загальній кількості енергії після події).
В термодинаміці, закон збереження енергії прийнято формулювати у вигляді першого начала (закону) термодинаміки. В цьому законі стверджується: Надана системі теплота (Q) частково йде на збільшення внутрішньої енергії системи (∆U), а частково, на виконання нею механічної роботи(А). Іншими словами: Q=∆U+A.
В науково-технічній практиці, той об’єкт який отримавши теплову енергію виконує механічну роботу, часто називають робочим тілом. Зважаючи на ці обставини, перше начало термодинаміки можна сформулювати наступним чином. Надана робочому тілу теплова енергія Q, частково йде на збільшення внутрішньої енергії робочого тіла ∆U (тобто на його нагрівання, плавлення, випаровування, тощо), а частково – на виконання ним певної механічної роботи А (на розширення робочого тіла). Наприклад, якщо газу що знаходиться під рухомим поршнем циліндру (мал.103) надати певну кількість теплоти (Q), то ця теплота частково піде на нагрівання газу, тобто на збільшення його внутрішньої енергії (∆U=Qн=cm∆t), а частково на розширення газу, тобто на виконання ним механічної роботи (А). При цьому буде виконуватись співвідношення Q=∆U+A.
Мал.103. Надане робочому тілу тепло (Q) частково йде на збільшення його внутрішньої енергії (∆U), а частково на виконання ним механічної роботи (А).
Співвідношення Q=∆U+A виконується в незалежності від того, яка речовина знаходиться в циліндрі умовної теплової машини. В незалежності від її хімічного складу, агрегатного стану чи будь яких інших властивостей. Це співвідношення виконується і в тому випадку, коли робоче тіло не отримує теплову енергію, а навпаки – втрачати її. Просто в цьому випадку, внутрішня енергія робочого тіла не збільшується, а зменшується і виконана ним механічна робота буде від’ємною, тобто такою яка виконана не робочим тілом, а над ним.
Оскільки в термодинаміці загалом і в першому началі термодинаміки зокрема, важливою дійовою особою є механічна робота, то буде не зайвим нагадати. Робота – це фізична величина, яка характеризує затрати енергії на виконання роботи, тобто певної енергозатратної дії і яка дорівнює цим затратам.
Позначається: А
Визначальне рівняння: А=ΔЕ
Одиниця вимірювання: А=Дж, джоуль.
Формула А=ΔЕ є базовим, визначальним рівнянням роботи. Однак, якщо мова йде про механічну роботу, то її зазвичай визначають за формулою А=Fℓcosα, де F – усереднена величина тієї сили що виконує роботу, ℓ – величина того переміщення яке відбувається при виконанні роботи, α – кут між напрямком вектора сили (F) та напрямком вектора переміщення (ℓ). Якщо напрям тієї сили що виконує роботу співпадає з напрямком переміщення тіла (α=0°; cos0°=1), то величина виконаної силою роботи визначається за спрощеною формулою А=Fℓ.
Не важко довести, що при ізобаричному розширенні газу (m=const, p=const), величина виконаної ним механічної роботи, визначається за формулою A=pΔV, де р – тиск газу, ΔV – зміна об’єму газу. Дійсно.
Задача 1. В процесі ізобаричного нагрівання, об’єм газу збільшився на ΔV. Визначити виконану газом механічну роботу.

Дано:
m=const
p=const
ΔV
Амех = ?
Рішення: За визначенням А = F·Δh. Оскільки в умовах нашої задачі, тією силою яка виконує роботу є сила тиску газу, та враховуючи що р=F/S, а отже F=pS, можна записати А = F·Δh = pSΔh = pΔV.
Загальні зауваження. Формула А=pΔV справедлива при будь якому ізобаричному (m=const, p=const) розширенні газу. Наприклад, якщо в процесі ізобаричного нагрівання повітря, частина цього повітря об’ємом ΔV була виштовхнута з вашої кімнати, то виконана при цьому механічна робота становитиме А=pΔV. Більше того, формула А=pΔV буде справедливою не лише при ізобаричному розширенні газу (ΔV>0), а й при його ізобаричному стисненні (ΔV<0). Просто в цьому випадку робота буде не додатною а від’ємною (газ протидіє його стисненню і тому виконує від’ємну роботу.
Знаючи фізичну суть того, що називають внутрішньою енергією тіла (U), кількістю теплоти (Q) та механічною роботою (А), дослідимо перше начало термодинаміки в ситуації, коли тим робочим тілом яке знаходиться в циліндрі умовної теплової машини є газ (точніше – ідеальний газ), а тими процесами які відбуваються з газом є ізотермічний (m=const, T=const), ізобаричний (m=const, p=const) та ізохоричний (m=const, V=const) процеси.
Ізохоричний процес (m=const, V=const). Оскільки при ізохоричному процесі об’єм газу залишається незмінним (V=const, ΔV=0), то при будь яких змінах інших параметрів газу, зокрема при його нагрівання або охолодженні, виконана газом механічна робота дорівнюватиме нулю: A=pΔV=p·0=0. При цьому перше начало термодинаміки Q=∆U+A набуває вигляду Q=∆U. А це означає: 1) якщо при ізохоричному процесі газ отримує теплову енергію (нагрівається), то його внутрішня енергія відповідно збільшується, тобто Q→ΔU; 2) якщо при ізохоричному процесі газ віддає теплову енергію (охолоджується), то його внутрішня енергія відповідно зменшується, тобто ΔU→Q. В координатах тиск–об’єм (р–V), ізохоричному процесу відповідає певна ізохора (мал.104), яка представляє собою направлений вертикальний відрізок: а) газ отримує теплову енергію, б) газ втрачає теплову енергію.
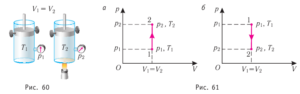
Мал.104. Ізохоричний процес та йому відповідні ізохори: а) при нагріванні газу, б) при охолодженні газу.
Ізобаричний процес (m=const, р=const). Оскільки при ізобаричному процесі об’єм газу змінюється (збільшується ΔV>0, або зменшується ΔV<0), то при будь яких змінах інших параметрів газу, зокрема при його нагріванні або охолодженні, виконується певна додатна або від’ємна робота. При цьому загальний вигляд першого начала термодинаміки Q=∆U+A залишається незмінним. А це означає: 1) якщо при ізобаричному процесі газ отримує теплову енергію (нагрівається), то частина цієї енергії йде на збільшення його внутрішньої енергії, а частина на виконання ним певної механічної роботи, тобто Q→ΔU+А; 2) якщо при ізобаричному процесі газ віддає теплову енергію (охолоджується), то це відбувається як за рахунок зменшення його внутрішньої енергії, так і за рахунок виконання ним від’ємної механічної роботи (в процесі охолодження об’єм газу зменшується, при цьому виділяється певна кількість теплоти), тобто ΔU+A→Q. В координатах тиск–об’єм (р–V), ізобаричному процесу відповідає певна ізобара (мал.105), яка представляє собою направлений горизонтальний відрізок: а) газ отримує теплову енергію, б) газ втрачає теплову енергію.
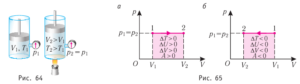
Мал.105. Ізобаричний процес та йому відповідні ізобара: а) при нагріванні газу, б) при охолодженні газу.
Оскільки при ізобаричному процесі величина виконаної газом механічної роботи визначається за формулою A=pΔV, то в системі координат p–V, величина цієї роботи дорівнює площі того прямокутника, який обмежений ізобарою 1→2, віссю 0–V та проведеними з країв ізобари вертикальними відрізками. При цьому: при ізобаричному розширенні газу (ΔV>0), виконана ним робота є додатною (А>0), а при ізобаричному стисненні (ΔV<0) – від’ємною (А<0).
Ізотермічний процес (m=const, Т=const). Оскільки при ізотермічному процесі температура газу залишається незмінним (Т=const, ΔТ=0), то при будь яких змінах інших параметрів газу, зокрема при його стисненні або розширенні, величина внутрішньої енергії газу залишається незмінною (оскільки Т=const, то U=const, а отже ΔU=0). При цьому перше начало термодинаміки Q=∆U+A набуває вигляду Q=А. А це означає: 1) якщо отримуючи теплову енергію, газ ізотермічно розширюється, то вся надана йому енергія йде на виконання механічної роботи, тобто Q→А; 2) якщо під дією зовнішньої сили, газ ізотермічно стискається і одночасно з цим віддає навколишньому середовищу отриману за рахунок стиснення енергію, то виконана над газом механічна робота, повністю перетвориться на теплову енергію навколишнього середовища, тобто А→Q. В координатах тиск–об’єм (р–V), ізотермічному процесу відповідає певна ізотерма (мал.106): а) – газ отримує теплову енергію, б) – газ втрачає теплову енергію.
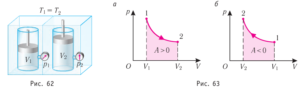
Мал.106. Ізотермічний процес та йому відповідні ізотерми: а) при розширенні газу, б) при стисненні газу.
Не важко довести, що в системі координат p–V, величина тієї роботи яку виконує газ при його ізотермічному розширенні або стисненні, дорівнює площі тієї фігури яка обмежена ізотермою 1→2, віссю 0–V та проведеними з країв ізотерми вертикальними відрізками. При цьому: при ізотермічному розширенні газу (ΔV>0), виконана ним робота є додатною (А>0), а при ізотермічному стисненні (ΔV<0) – від’ємною (А<0). Дійсно, якщо геометричну фігуру V1–1–2–V2 (мал.107) розбити на велику кількість дрібних вертикальних фрагментів, то зміною тиску на кожному з них можна знехтувати. А це означає, що у відповідності з формулою ΔA=pΔV, величина елементарної роботи ΔА дорівнюватиме площі відповідного елементарного прямокутника. Загальна ж площа цих прямокутників, а отже і площа фігури V1–1–2–V2 дорівнюватиме тій загальній роботі яка була виконана при відповідному ізотермічному процесі.
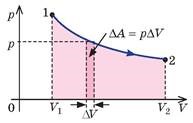

Мал.107. В системі координат р–V величина механічної роботи дорівнює площі відповідної геометричної фігури.
Аналізуючи ізотермічний процес, ми дійшли висновку, що у відповідності з першим началом термодинаміки при ізотермічному розширенні газу, вся надана йому теплова енергія Q повністю перетворюється на механічну роботу Q=A. Однак, якщо ви дійсно спробуєте провести відповідний експеримент, то неодмінно з’ясуєте, що здійснити тепловий процес при якому все надане системі тепло повністю перетворилось би в механічну роботу неможливо. Ви можете робити все що завгодно, придумувати будь які хитромудрі схеми, але повністю перетворити надану системі теплову енергію в механічну роботу ви не зможете. Не зможете тому, що в Природі діє один надзвичайно важливий закон який називається другим началом термодинаміки. В цьому законі стверджується: неможливо здійснити такий тепловий процес при якому все надане системі тепло, повністю перетворилось би в механічну роботу. Втім, про суть та значимість другого начала термодинаміки ми поговоримо в наступному параграфі. На разі ж, розв’яжемо декілька задач, які стосуються першого начала термодинаміки та теплових процесів загалом.
Задача 2. Ідеальний газ із стану 1 в стан 2 може переходити трьома представленими на діаграмі р–V шляхами. Визначте при якому переході виконана газом робота буде: а) найбільшою, б) найменшою.
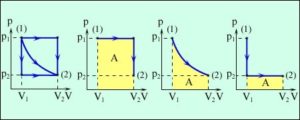
Рішення. Будемо виходити з того, що робота газу чисельно дорівнює площі фігури обмеженої графіком залежності тиску від об’єму, віссю 0V та вертикальними прямими, які відповідають значенням об’єму V1 і V2. Проаналізувавши кожний шлях переходу (мал.б,в,г), можна стверджувати, що при переході (б) виконана газом робота буде найбільшою, а при переході (г) – найменшою.
Задача 3. За заданою р–V діаграмою визначте яку роботу виконує газ при переході з стану 1 до стану 3?
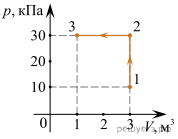
Рішення. На ділянці 1→2, ΔV=0 і тому A12 = pΔV = 0Дж.
На ділянці 2→3, ΔV = 1м3–3м3= –2м3 і тому A23 = pΔV = 30·103Па·(–2м3)= –60·103Дж, де знак «–» вказує на те, що газ виконує від’ємну роботу (на ділянці 2→3 газ ізобарично стискається і тому протидіє цьому стисненню).
Загальні зауваження. Факт того, що на ділянці 1→2 газ не виконує механічну роботу (A=0), зовсім не означає що на цій ділянці не відбуваються певні енергетичні події. Дійсно, оскільки на ділянці 1→2 відбувається ізохоричне стиснення газу (V=const, p↑), то у відповідності з об’єднаним газовим законом (pV/T=const) на цій ділянці неминуче відбувається нагрівання газу(T↑). При цьому у відповідності з першим началом термодинаміки (Q=ΔU+A) надана газу теплова енергія йде на збільшення внутрішньої енергії газу. Іншими словами, на ділянці 1→2: V=const, p↑, Т↑, ΔU↑, А=0.
Задача 4. За заданою р–V діаграмою ідеального одноатомного газу, визначте яку кількість теплоти отримав або віддав цей газ при переході із стану 1 до стану 3?
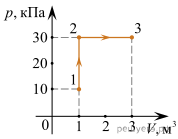
Загальні зауваження. Нагадаємо: в залежності від того з яких молекул складається газ (ідеальний газ), величину його внутрішньої енергії U, а відповідно і зміни цієї енергії ΔU, можна визначити за однією з наступних формул:
– для одноатомних молекул U = 1,5νRT або U = 1,5pV;
– для двохатомних молекул U = 2,5νRT або U = 2,5pV;
– для трьох і більше атомних молекул U = 3,0νRT або U = 3,0pV.
Рішення. На ділянці 1→2: V=const, р↑, оскільки рV/T=const, то Т↑. Оскільки ΔV=const, то А=рΔV=0. Таким чином, оскільки на ділянці 1→2 температура газу зростає, то на цій ділянці він отримує певну кількість енергії Q12, яка повністю йде на збільшення внутрішньої енергії газу (адже А=0), тобто Q12=ΔU12.
Оскільки для одноатомного газу U=1,5νRT, або U = 1,5pV, та зважаючи на те, що на ділянці 1→2 V=const, то ΔU = 1,5VΔр. Тому Q12=ΔU12= 1,5V12(р2 – р1)= 1,5·1(30·103 – 10·103)= 30·103Дж.
На ділянці 2→3: р=const, V↑, оскільки рV/T=const, то Т↑. Оскільки ΔV=3м3 – 1м3=2м3, то А23=рΔV=30·103·2=60·103Дж=60кДж.
Оскільки на ділянці 2→3 газ по перше нагрівається (Т↑), а по друге виконує механічну роботу (А>0), то це означає, що газ отримує певну кількість енергії Q23. При цьому у відповідності з першим началом термодинаміки Q23=ΔU23+A23.
Оскільки для одноатомного газу U=1,5νRT, або U = 1,5pV, та зважаючи на те, що на ділянці 2→3 р=const, то ΔU23 = 1,5рΔV= 1,5р23(V3 – V2)= 1,5·30·103(3 – 1)= 90·103Дж.
Q23=ΔU23+A23 = 90·103+60·103 = 150·103Дж =150кДж
У підсумку: Q = Q12 + Q23 = 30кДж + 150кДж = 180кДж.
Контрольні запитання.
1.Що стверджується в законі збереження енергії.
2. Що спільного між першим началом термодинаміки та рівнянням теплового балансу? Який з цих законів є більш загальним?
3. Якого вигляду набуває перше начало термодинаміки при теплообміні?
4. За якими формулами можна визначити величину виконаної роботи? Яка з цих формул є найбільш загальною?
5. На що йде надана газу теплова енергія при: а) ізохоричному процесі; ізотермічному процесі; в) ізобаричному процесі?
6. При якому ізопроцесі внутрішня енергія робочого тіла залишається незмінною?
7. В якому випадку виконана газом робота є додатною, а в якому – від’ємною?
8. Як ви думаєте, чому механічна робота легко і повністю перетворюється на теплоту, а теплота, якщо і перетворюється в механічну роботу то лише за певних умов і не повністю?
Вправа 34.
1.За заданими р–V діаграмами (мал. а, б), визначте яку роботу виконує газ при переході з стану 1 до стану 3?
а) 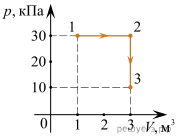 б)
б)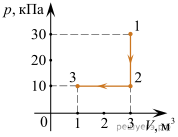
2. За заданими р–V діаграмами (мал. а – г), визначте яку роботу виконує газ при переході з стану 1 до стану 2?
3. Ідеальний газ здійснив зображені на малюнках (а) і (б) циклічні процеси. Визначте виконану газом роботу на кожній ділянці циклу та загальну роботу.
а)  б)
б)
4. За заданою р–V діаграмою ідеального одноатомного газу визначте яку кількість теплоти отримав або віддав цей газ при переході із стану 1 до стану 3?

5. Яку роботу виконає газ масою m та молярною масою М при його ізобаричному нагріванні на ΔТ кельвінів?
6. За нормального атмосферного тиску, температура повітря 0°С, а його об’єм 20м3. Яку роботу виконає це повітря при його ізобаричному нагріванні на 17°С?
7. В циліндрі під поршнем знаходиться 25г повітря. Для його нагрівання на 40ºС при постійному тиску витратили 1кДж теплоти. На скільки змінилась внутрішня енергія повітря. Молярна маса повітря 0,029кг/моль.
.
§35. Друге начало термодинаміки. Або про те, чому природні події відбуваються так, а не навпаки.
Аналізуючи ті події які відбуваються в навколишньому світі, не важко помітити, що вони незворотні. Виведений з рівноваги маятник, рано чи пізно зупиняється. І після цього можна як завгодно довго очікувати зворотних подій, але вони не відбудуться. Не відбудуться тому, що коливання маятника є незворотними. Той газ що знаходиться в одній половині посудини, після прибирання роздільної стінки, займає увесь доступний йому об’єм. При цьому марно очікувати того, що молекули газу самі собою повернуться до попереднього об’єму. Марно тому, що даний процес є незворотним. Нагріта деталь, при занурені в холодну воду швидко охолоджується. І можна чекати скільки завгодно, але система сама собою до початкового стану не повернеться. Не повернеться тому, що процес переходу теплоти від гарячого тіла до холодного є незворотним.

Мал.108. Деякі приклади незворотних процесів.
Звичайно, для всіх вище описаних та їм подібних випадків можна придумати певний «хитрий» пристрій, який би повертав систему до початкового стану: розгойдував маятник, стискав би до попереднього об’єму газ, охолоджував воду та нагрівав би деталь. Але, як ви розумієте, самі собою системи «хитрими» не стають і без певних енергетичних затрат не працюють. А тому ми констатуємо факт того, що природний хід подій є незворотний. Випускаєш з рук склянку, вона падає, розбивається і скільки не очікуй, а друзки самі собою не зберуться в єдине ціле і не стрибнуть назад в руку.
Якщо ви проаналізуєте відомі фізичні процеси та ті закони що їх описують, то неодмінно з’ясуєте, що практично всі вони симетричні. А це означає, що згідно з цими законами природні події можуть відбуватись як в прямому так і в зворотному напрямку. Але якщо закони Природи жодним чинам не протидіють зворотному ходу подій, то чому ж ці зворотні події самі собою не відбуваються? Відповідь на це та йому подібні запитання дає надзвичайно важливий закон, який називається другим началом термодинаміки.
Друге начало термодинаміки можна сформулювати по різному. Наприклад так: теплова енергія не може сама по собі переходити від холодного тіла до гарячого. Або так: неможливо здійснити такий тепловий процес при якому все надане системі тепло, повністю перетворилось би в механічну роботу. А можна і так: будь які процеси що відбуваються в замкнутій системі не можуть призвести до зменшення загальної ентропії цієї системи.
Та якими б не були формулювання другого начала термодинаміки, а його фізична суть залишається незмінною: в природних процесах, порядок легко і сам по собі перетворюється на безпорядок, а от безпорядок якщо і перетворюється на порядок то лише за наявності певної енергетичної доцільності і з певними енергетичними втратами. Ілюструючи цю фізичну суть, проведемо та проаналізуємо наступний простий експеримент.
Візьмемо дві склянки пшениці і зерна однієї з них пофарбуємо в чорний, зелений чи будь який інший колір. Акуратно висипаємо фарбоване та нефарбоване зерно в прозору скляну посудину. Висипаємо так, щоб чорне зерно було зверху а жовте знизу (або навпаки). При цьому ми отримаємо ситуацію, яка ілюструє певний порядок в розташуванні зерен: чорні – зверху, жовті – знизу.
Тепер беремо ложку, виделку, паличку чи що завгодно і починаємо перемішувати зерна. Ви робите один оберт, другий, третій, …, десятий і неодмінно бачите що чорні і жовті зерна перемішуються. Тепер давайте спробуємо повернути хід подій і зробимо ідеально такі ж оберти у зворотньому напрямку. Виконуючи ці зворотні рухи, ви неодмінно з’ясуєте, що система не повертається до попереднього стану. Ви можете як завгодно довго та як завгодно хитро перемішувати зерно в очікувані того що воно знову розташується в початковому порядку, але цього ніколи не відбудеться. І не тому, що цього не може бути взагалі, а тому що ймовірність цієї події є практично нулевою.
Оскільки ми заговорили про ймовірність тієї чи іншої випадкової події, то буде не зайвим з’ясувати суть того, що прийнято називати ймовірністю. За визначенням: ймовірність (р) певної випадкової події, це величина, яка дорівнює відношенню числа тих випадків коли очікувана подія відбувається (z), до загальної кількості можливих випадків (N), тобто: p = z/N. Наприклад, ймовірність того що в результаті неупередженого кидання грального кубика випаде цифра «5» становить р=1/6. Якщо ж ви одночасно кидаєте два кубики і очікуєте випадіння двох п’ятірок, то ця подія відбудеться з ймовірністю р=(1/6)(1/6)=1/36. Якщо ж в експерименті задіяно три кубики, то ймовірність одночасного випадіння трьох п’ятірок становить р=(1/6)(1/6)(1/6)=1/196.
Звичайно, це не означає що очікувана подія відбудеться на 196 киданні кубиків. Це навіть не означає, що в кожній серії яка складається з 196 кидань, один раз обов’язково випаде комбінація з трьох п’ятірок. Твердження: «ймовірність події становить 1/196» – означає лише те, що виконавши N експериментальних серій (де N – достатньо велике число), кожна з яких складається з 196 експериментів, ви отримаєте приблизно N очікуваних подій, тобто в середньому по одній очікуваній події на одну експериментальну серію. При цьому насправді, в деяких серіях очікувана подія може відбутися 2, 3, а то й 10 разів, а в деяких – не відбудеться жодного разу.
Зважаючи на вище сказане і виходячи з того, що в нашому експерименті з зерном приймають участь 200 фарбованих і 200 не фарбованих зернин, не важко визначити ймовірність того, що в процесі перемішування, зерна розташуються в певному порядку, наприклад чорні – зверху, жовті – знизу. Дійсно. Ймовірність того, що певна фарбована зернина опиниться у верхній частині посудини становить р=1/2. При цьому, ймовірність того, що всі 200 фарбованих зернин одночасно опиняться у верхній частині посудини становить р=(1/2)200=1/2200≈1/1063. Ілюструючи величину цієї ймовірності можна сказати наступне. Якщо ви за одну секунду встигнете виконати операцію перемішування зерен, встигнете зупинитись і подивитись на те чи не відбулась очікувана подія, то ймовірніше за все така подія відбудеться один раз на 1063 секунд. Для порівняння зазначимо, що вік нашого Всесвіту не перевищує 14·109 років, що приблизно становить 4,4·1017 секунд.
Тепер, коли ви знаєте що в процесі тих чи інших подій, порядок легко перетворюється на безпорядок, а от безпорядок сам по собі порядком не стає, не важко пояснити чому механічна робота легко та повністю перетворюється на теплоту, а от теплота сама собою роботою не стає. Дійсно. В процесі виконання роботи, певне тіло переміщується як єдине ціле. А це означає що всі частинки цього тіла, всі його атоми, молекули та електрони, рухаються як одне ціле, а отже рухаються упорядковано. Іншими словами, механічна робота (Амех), є енергією упорядкованого руху всіх частинок даного тіла. Якщо ж говорити про теплоту (Q), то вона як за визначенням так і за своєю суттю теплова енергія є енергією хаотичного руху молекул.
Переконатись в тому, що механічна робота (порядок) легко перетворюється на теплоту (безпорядок) не складно. Для цього достатньо потерти долоні рук одна об одну. При цьому неодмінно з’ясується, що виконавши певну механічну роботу (потерши долоні одна об одну) ви отримаєте відповідну кількість теплових відчуттів. Якщо ж говорити про кількісні докази такого перетворення, то першим хто отримав ці докази був Джоуль. В експериментах Джоуля (мал.109), механічна робота (Амех), а точніше енергія обертального руху тіла, повністю перетворювалась в теплоту (Q).
. 
Мал.109. Механічна робота легко і повністю перетворюється на теплоту, а от теплота, сама собою в механічну роботу не перетворюється.
Але, якщо в процесі обертання зануреної у воду крильчатки (мал.109), енергія її механічного руху перетворюється на теплоту, то чому б молекулам води, бодай мізерну частинку своєї енергії не перетворити на механічну роботу? Адже тієї енергії яку можна отримати при охолоджені одного літра води всього на один градус, вистачить на те щоб підняти тіло масою 1кг на висоту 420м. Однак марно очікувати того, що якась мізерна частина наявної у воді теплової енергії, сама собою перетвориться на енергію механічного обертання крильчатки та піднімання бодай мізерного вантажу.
І це закономірно. Адже для того щоб крильчатка почала обертатись, рух молекул рідини має стати упорядкованим. При цьому абсолютно очевидно, що ймовірність події при якій 334·1023 хаотично рухомих молекул (а саме стільки їх міститься в одному літрі води), ні з того ні з сього почнуть рухатись в одному напрямку і що цей упорядкований рух буде тривати так довго, що крильчатка дійсно почне обертатись, практично нулева. Не менш очевидно і те, що в подібних ситуаціях терміни «малоймовірна подія» і «неможлива подія» є тотожними.
Звичайно, вище сказане не означає, що наявну у воді теплову енергію в принципі не можливо перетворити на механічну роботу. Скажімо, якщо пластинку крильчатки з одного боку нагріти, а з іншого – залишити холодною, то тиск молекул води на нагріту поверхню буде дещо більшим. При цьому за наявності достатнього перепаду температур, крильчатка почне обертатись та виконувати відповідну механічну роботу. Але як ви розумієте, самі собою поверхні крильчаток різнонагрітими не стають.
Таким чином, все різноманіття наявних фактів вказує на те, що в природі енергія порядку будь то енергія механічної роботи, енергія електричного струму, хімічних зв’язків чи біологічних процесів, легко перетворюється на енергію хаотичного руху молекул тобто теплоту. А от теплота сама собою енергією порядку не стає. Тому коли та чи інша система знаходяться в стані теплової рівноваги з навколишнім середовищем, то наявна в ній енергія теплового руху молекул сама собою не стає а ні енергією механічної роботи, а ні енергією електричного струму, а ні енергією біологічних структур.
Потрібно зауважити, що друге начало термодинаміки не суперечить ні першому началу термодинаміки, ні закону збереження енергії. В ньому лише констатується той факт, що Природа влаштована таким чином, що в ній енергія порядку легко перетворюється на енергію безпорядку, а от енергія безпорядку, якщо і перетворюється в енергію порядку то лише за наявності певних енергетичних причин.
При цьому, потрібно особливо підкреслити, що в другому началі термодинаміки не стверджується що безпорядок не може перетворюватись на порядок. В ньому говориться лише про те, що за відсутності енергетичних причин, таке перетворення є малоймовірним. Але якщо для подібного перетворення є певні енергетичні підстави, то безпорядок не лише може перетворюватись на порядок, а й практично неминуче цим порядком стає. Наприклад, в процесі кристалізації, хаотично розташовані молекули рідини, вишиковуються в певному, строго визначеному порядку. Вишиковуються тому, що такий порядок є енергетично доцільним. В процесі хімічних взаємодій, певні атоми об’єднуються в більш складні упорядковані структури – молекули. Об’єднуються тому, що таке об’єднання є енергетично доцільним. З плином часу, хаотично розташовані молекули аморфного тіла, вишиковуються в певному, енергетично доцільному порядку. Навіть те що ми називаємо життям і що характеризується надзвичайною складністю та упорядкованістю, є прямим наслідком факту того, що енергетично доцільна подія рано чи пізно відбувається. Втім, про енергетичні передумови виникнення та еволюційного саморозвитку життя на Землі, ми поговоримо ще не скоро.
Контрольні запитання.
1.Що означає твердження: фізичні закони симетричні.
2. Наведіть приклади незворотних подій. Поясніть причини цієї незворотності.
3. В чому суть другого начала термодинаміки?
4. Яка ймомірність того, що в результаті неупередженого викидання п’яти гральних кубиків, випаде п’ять п’ятірок? Що означає ця ймовірність?
5. Чому механічна робота легко і повністю перетворюється на теплоту, а от теплота перетворюється на роботу лише за певних умов і не повністю?
6. Чому енергія електричного струму легко перетворюється на теплоту, а от теплота сама собою електричним струмом не стає?
7. Чому теплові двигуни мають низький ККД?
8. Наведіть приклади того, як безпорядок природним шляхом стає порядком. Чи не суперечать ці перетворення другому началу термодинаміки?
.
§36. Теплові двигуни.
Історія термодинаміки нерозривно пов’язана з тепловими двигунами, тобто машинами які перетворюють внутрішню енергію палива (теплоту) в механічну роботу. Перший повністю автоматизований тепловий двигун (парову машину) було збудовано в 1774 році англійським винахідником Джеймсом Уаттом *)(1736-1819). Парова машина Уатта швидко отримала широке практичне застосування. Але її енергетична ефективність (цю ефективність характеризує коефіцієнт корисної дії) була низькою і не перевищувала 4%.
*) Саме на честь Джеймса Уатта (англ. Watt) названо одиницю потужності – ват.
Ясно, що в такій ситуації інтереси виробництва вимагали створення більш економних машин. Очевидно і те, що створити максимально ефективну машину, без розуміння суті тих процесів які в ній відбуваються, практично неможливо. А це означало, що потреби виробництва вимагали від науки з’ясування закономірностей перетворення теплоти в механічну роботу та з’ясування тих умов за яких таке перетворення є максимально ефективним. В процесі вирішення цих практичних задач і було закладено основи термодинаміки.
Визначальний внесок у справу розбудови теорії теплових двигунів і термодинаміки загалом, зробив французький інженер Саді Карно (1796–1832). Розмірковуючи над будовою та принципом дії відомих на той час парових машин, Карно дійшов висновку: будь який тепловий двигун працює за схемою: 1. Нагрівник (джерело енергії) надає робочому тілу певну кількість теплоти (Q1). 2. Робоче тіло, частину цієї теплоти перетворює на механічну роботу (А), а частину (Q2= Q1–А) – передає холодильнику, яким по суті є навколишнє середовище. Іншими словами, принцип дії будь якого теплового двигуна можна представити у вигляді наступної схеми:

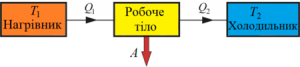
Різноманіття сучасних теплових двигунів надзвичайно велике. За різними ознаками це різноманіття можна класифікувати по різному. Зазвичай за способом перетворення теплоти в механічну роботу, та за характерними конструктивними ознаками, теплові двигуни поділяють на поршневі, турбінні та реактивні. Не заглиблюючись в подробиці загального устрою та деталі принципу дії, про вище згадані різновидності теплових двигунів можна сказати наступне.
Поршневими, називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло, знаходячись в циліндрі двигуна, тисне на поршень та переміщує його. Поршневі двигуни поділяються на парові машини та двигуни внутрішнього згорання.
Паровими машинами, називають такі поршневі двигуни, в яких робочим тілом є нагрітий за межами циліндру пар. Парові машини були тими першими тепловими двигунами, які отримали надзвичайно широке практичне застосування. По суті, саме парова машина стала тією рушійною силою яка спричинила так звану промислову революцію, тобто перехід від мануфактурного ручного виробництва до виробництва машинного. Однак, якщо говорити про теперішній час, то в ньому парові машини не мають суттєвого застосування. Головний недолік парових машин полягає в тому, що в них робочим тілом є не продукти згорання палива, а нагріта цим паливом окрема речовина – пар. А це означає, що в робочому циклі парової машини є додаткова проміжна ланка – пар, як проміжне робоче тіло та паронагрівальний агрегат, як генератор цього пару. Ясно, що в такій ситуації ККД парової машини є значно меншим за ККД тих теплових двигунів в яких продукти згорання палива безпосередньо виконують корисну роботу. Зважаючи на ці обставини, парові машини практично повністю витіснені більш ефективними та компактними тепловими двигунами, зокрема двигунами внутрішнього згорання.
Двигунами внутрішнього згорання, називають такі поршневі двигуни, в яких робочим тілом є високотемпературний газ що утворюється в процесі згорання палива яке відбувається в середині робочого циліндру двигуна. Загальний устрій та етапи роботи типового двигуна внутрішнього згорання представлені на мал.110. Повний робочий цикл представленого на малюнку двигуна здійснюється за чотири етапи (такти). На першому етані відкривається вхідний клапан і циліндр заповнюється горючою сумішшю. На другому – ця суміш стискається. На третьому – горюча суміш підпалюється, згорає і виконує корисну роботу. На четвертому етапі, відкривається випускний клапан і відпрацьовані продукти згорання виштовхуються за межі робочого циліндра.
Мал.110. Загальний устрій та етапи роботи двигуна внутрішнього згорання.
На теперішній час, двигуни внутрішнього згорання є найбільш розповсюдженими і конструктивно найбільш різноманітними тепловими двигунами. Різноманіття цих двигунів можна класифікувати за різними ознаками, зокрема:
– за способом утворення горючої суміші: двигуни з внутрішнім та зовнішнім сумішоутворенням;
– за організацією робочого циклу: двигуни двохтактні та чотирьохтактні;
– за швидкістю згорання палива: двигуни швидкого, повільного та змішаного згорання;
– за видом палива: двигуни газові та на рідкому паливі;
– за кількістю циліндрів: двигуни одноциліндрові, двоциліндрові, чотирьох циліндрові і т.д.
– за способом розташування циліндрів: двигуни з лінійним, V-подібним та круговим розташуванням циліндрів;
– за способом охолодження: двигуни з повітряним та водяним охолодженням;
– за іншими класифікаційними ознаками…
Зазвичай, за низкою ознак двигуни внутрішнього згорання поділяють на карбюраторні та дизельні. В карбюраторних (бензинових) двигунах, горюча суміш утворюється за межами робочого циліндра (в карбюраторі) і в потрібний момент запалюється електричною іскрою яку створює свічка запалювання. В дизельних двигунах нема карбюратора і нема свічки запалювання. Натомість є форсунка – прилад, який в момент гранично сильного стиснення повітря, впорскує в це розжарене повітря паливо яке самозаймається.
В побутовій практиці, ми майже завжди маємо справу з тими чи іншими різновидностями поршневих двигунів внутрішнього згорання. Адже саме такі двигуни стоять на наших автомобілях, мопедах, мотоциклах, моторних човнах, побутових електрогенераторах, тощо. Однак, якщо мова йде про більш потужні прилади, як то кораблі, підводні човни, літаки, генератори теплових електростанцій, тощо, то в них зазвичай застосовують так звані турбінні двигуни. Турбінними двигунами, називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло, направленим струменем викидається на спеціальне лопатчате колесо (ротор) і змушує його обертатись. Сучасні турбінні двигуни мають достатньо складну конструкцію. Однак принциповий устрій (мал.111) та принцип дії цих двигунів є гранично простими. І цей устрій та принцип дії мало чим відрізняється від устрою та принципу дії водяного колеса: потік води падає на лопатчате колесо і обертає його.
Мал.111. Що спільного між водяним колесом та турбінним двигуном?
Ще однією важливою різновидністю теплових двигунів є двигуни реактивні. Реактивними називають такі теплові двигуни, в яких виконання механічної роботи обумовлено тим, що високотемпературне робоче тіло з великою швидкістю вилітає назовню двигуна через так зване сопло. Зазвичай, сопло реактивного двигуна представляє собою певне звуження його камери згорання яке плавно переходить в характерне розширення. Така конструкція забезпечує вирішення двох задач: 1) створює умови за яких швидкість вильоту молекул робочого тіла стає максимально великою; 2) створює умови за яких рух молекул робочого тіла стає максимально упорядкованим (направленим вздовж осі сопла).
Поступальний рух реактивного двигуна та того тіла яке цей двигун переміщує, обумовлений тими ж силовими причинами що і рух тіла гармати, з дула якої вилітає снаряд, або рух човна з корми якого стрибає пірнальник. Просто з тіла реактивного двигуна вилітають не кулі, не снаряди і не пірнальники, а атоми тієї речовини що згорає в двигуні. Реальний устрій реактивних двигунів може бути як гранично простим, так і гранично складним (двигуни сучасних космічних ракет).

Мал.112. Що спільного між гарматою та реактивним двигуном?
Потрібно зауважити, що різноманіття сучасних теплових двигунів не обмежується класифікаційною схемою: двигуни поршневі, турбінні та реактивні. Натепер існує широке різноманіття комбінованих теплових двигунів, зокрема турбореактивні двигуни, роторно-поршневі двигуни, поршневі двигуни з турбонаддувом, тощо. Однак, в будь якому випадку, базовими видами сучасних теплових двигунів є двигуни поршневі, турбінні та реактивні.
Аналізуючи загальний устрій реактивних, турбінних та поршневих двигунів, важко віднайти бодай якісь конструктивні аналогії. Важко тому, що з точки зору технічних рішень, ці двигуни влаштовані по різному. І тим не менше, всі ці абсолютно не схожі двигуни, працюють за однією принциповою схемою. З’ясовуючи суть цієї схеми, задамося питанням: «А які елементи теплового двигуна є найважливішими, тобто такими, без наявності яких не зможе працювати жоден тепловий двигун?» Відповідаючи на це запитання, ви неминуче прийдете до висновку, що найважливішими елементами теплового двигуна є не циліндри, не поршні, не колінчасті вали, не сопла і не турбінні колеса. Бо як би там не було, а всі ці деталі, це лише допоміжні технічні елементи які допомагають перетворити внутрішню енергію палива в механічну роботу. При цьому існують двигуни без поршнів, без циліндрів, без колінчастих валів, без сопел і без турбінних коліс.
А от без чого дійсно не може існувати будь який тепловий двигун, так це без сукупності трьох основних елементів: 1) нагрівника – джерела теплової енергії; 2) робочого тула – речовини, яка отримує від нагрівника теплову енергію та перетворює частину цієї енергії в механічну роботу; 3) холодильника – тієї «помийної ями» в яку викидається відпрацьоване робоче тіло, а разом з ним і та частина енергії, яка залишилась після виконання механічної роботи. І не важко збагнути що цією «помийною ямою» практично завжди є наше навколишнє середовище.
Таким чином, коли ми стверджуємо, що всі теплові двигуни працюють за єдиною принциповою схемою, то маємо на увазі факт того, що загальний принцип дії будь якого теплового двигуна полягає в наступному. 1. Нагрівник (джерело енергії) надає робочому тілу певну кількість теплоти (Q1). 2. Робоче тіло, частину цієї теплоти перетворює на механічну роботу (А), а решту (Q2= Q1–А) – передає холодильнику, яким по суті є навколишнє середовище.
Французький інженер Карно не лише чітко сформулював принцип дії узагальненого теплового двигуна, а й теоретично довів, що максимально можливий ККД такого двигуна визначається за формулою ηmax=(Т1–Т2)/Т1, де Т1, Т2 – температура робочого тіла двигуна, відповідно на початку та вкінці робочого циклу.
Із аналізу формули Карно, з усією очевидністю випливає практично важливий висновок: організовуючи роботу реального теплового двигуна, потрібно прагнути до того, щоб на початку робочого циклу, температура робочого тіла була максимально великою, а в кінці цього циклу – максимально низькою.
Ясно, що прагнучи максимально збільшити температуру робочого тіла, ми неминуче стикнемося з низкою технічних проблем. Наприклад, з проблемою того, що при високих температурах, конструктивні матеріали втрачають свої міцнісні властивості. З іншого боку, можливості максимального зниження температури робочого тіла також суттєво обмежені. Обмежені бодай тим, що робоче тіло не можна змусити виконувати корисну роботу, якщо температура цього тіла нижча за температуру навколишнього середовища.
Вище сказане означає, що ККД найідеальнішого теплового двигуна не може бути гранично великим. Наприклад, якщо максимальна температура робочого тіла становить 2000К, а температура навколишнього середовища 300К, то ККД найідеальнішого теплового двигуна не може перевищувати 85%: ηmax=(2000 – 300)/2000=0,85=85%. Якщо ж говорити про реальні теплові двигуни, з їх реальним перепадом температур та реальним рівнем інших енергетичних втрат, то їх к.к.д. практично завжди менший за 50%.
Таблиця. Коефіцієнти корисної дії сучасних теплових двигунів.
| Тип двигуна | ККД (%) |
| Парова машина Уатта
Двигуни внутрішнього згорання: – карбюраторні – дизельні Турбінні двигуни Турбореактивні двигуни Реактивні двигуни |
3 – 4
25 – 35 30 – 40 25 – 35 25 – 35 30 – 35 |
Не важко бачити, що реальний коефіцієнт корисної дії теплового двигуна практично будь якої конструкції є надзвичайно низьким. Адже в процесі роботи теплового двигуна приблизно 70% тієї енергії що виділяється при згоранні палива, в буквальному сенсі викидається «на вітер». Чому ж енергетична ефективність навіть найсучасніших теплових двигунів є такою низькою? Чому к.к.д. електричного двигуна становить 97 – 99%, а теплового – лише 25 – 40%? Що ж, спробуємо відповісти і на ці слушні та важливі запитання.
Аналізуючи роботу реального теплового двигуна, наприклад двигуна внутрішнього згорання, не важко з’ясувати, що та теплова енергія (Q) яка виділяється в процесі згорання палива витрачається наступним чином:
– йде на виконання корисної механічної роботи (Амех);
– викидається в атмосферу разом з продуктами згорання (Qпр.гор);
– викидаються в атмосфера в процесі роботи системи охолодження (Qox);
– йде на інші неминучі втрати (Qiн).
Іншими словами: Q = Aмех + Qпр.гор + Qох + Qін .
Ми не будемо аналізувати всі джерела тих енергетичних втрат які супроводжують роботу будь якого теплового двигуна. Обмежимся лише стислим аналізом тих неминучих втрат, які пов’язані з фактом того, що велика частина тієї енергії яка виділяється при згоранні палива, викидається в атмосферу разом з продуктами згорання. Дійсно. В камері згорання сучасного карбюраторного двигуна, температура газу досягає 3000К. В процесі розширення, цей газ виконує механічну роботу і охолоджується. Однак, вже при температурі близькій до 1300К, газ викидається за межі циліндра. А разом з ним, викидається і величезна кількість нереалізованої енергії (≈ 43%). Виникає закономірне питання: «А чому теплова енергія газу використовується так неефективно?» Адже якби газ викидали не при 1300К, а скажімо при 400К, то рівень відповідних теплових втрат знизився б з 43% до 13%.
Сподіваюсь, ви не думаєте що ті інженери які проектують теплові двигуни не знають про вище згаданий факт? Звичайно знають. І безумовно працюють над тим, щоб максимально ефективно використати енергетичний потенціал палива. Але ця задача не є такою простою як може здатися на перший погляд. Дійсно. Припустимо, що ви хочете створити двигун в якому рівень теплових втрат є гранично низьким. З цією метою ви прагнете організувати робочий цикл двигуна таким чином, щоб його продукти згорання викидались не при 1300К, а при 400К. Проектуючи такий двигун, ви неодмінно з’ясуєте, що робочий хід його поршня потрібно збільшити в 3 рази. А це означає, що об’ємні розміри, а відповідно маса і ціна практично всіх деталей та вузлів двигуна починаючи від циліндрів, поршнів, шатунів та колінчастих валів і закінчуючи системою охолодження та амортизації, мають збільшитися у 33=27 разів. Крім цього, ви неодмінно з’ясуєте, що робочий цикл вашого «ідеального двигуна» стане більш тривалим. Що погіршаться динамічні параметри процесу. Зменшиться питома потужність двигуна. Збільшаться теплові втрати в системі охолодження. Виникнуть проблеми з організацією безпечного вихлопу продуктів згорання, тощо.
Таким чином, проектуючи реальний тепловий двигун, ви будете змушені вирішувати складний комплекс взаємопов’язаних проблем. Проблем такого ґатунку, що певний виграш в одному напрямку, неминуче призводить до відповідного програшу в інших напрямках. Кінцевим же рішенням цієї системи оптимізаційних задач буде висновок: для карбюраторних двигунів з максимальною температурою робочого тіла 3000К, оптимальна температура вихлопу продуктів згорання має бути близькою до 1300К.
Звичайно, ви можете спробувати підвищити максимальну температуру робочого тіла двигуна, скажімо до 4000К. Але і в цьому випадку, реалії життя неодмінно приготують вам нові сюрпризи. Наприклад вам знадобиться нова, більш дорога та енергетично більш затратна система охолодження. Вам неминуче знадобиться новий, більш дорогий вид палива. Вам знадобляться нові, більш дорогі конструктивні матеріали. Крім цього, ви неодмінно з’ясуєте, що для двигунів з максимальною температурою робочого тіла 4000К, оптимальною температурою вихлопу продуктів згорання є не 1300К, а 1500К. При цьому, ви знову переконаєтесь в тому, що намагаючись зменшити втрати в одному місці, ви будете створювати умови для їх появи в іншому.
Додайте до вище сказаного ті втрати які пов’язані з наявністю сил тертя, з роботою системи охолодження двигуна, з роботою гідравлічних, електричних, гальмівних та інших систем автомобіля, і ви зрозумієте чому ККД навіть найсучасніших теплових двигунів не перевищує 50%.
Таким чином факт того, що сучасні теплові двигуни мають відносно низький ККД, зовсім не означає що ці двигуни недосконалі. Цей факт вказує лише на те, що процес перетворення теплоти в механічну роботу, неминуче супроводжується великими енергетичними втратами, і що величина цих втрат, зазвичай суттєво перевищує 50%. Власне факт того, що енергетична ефективність всього різноманіття сучасних теплових двигунів є відносно низькою, це прямий наслідок того, що ці двигуни перетворюють енергію безпорядку (теплоту) в енергію порядку (механічну роботу). А у відповідності з другим началом термодинаміки енергія безпорядку перетворюється в енергію порядку лише примусово і неповністю, тобто з певними енергетичними втратами.
Якщо ж говорити про двигун електричний, то він перетворює енергію одного порядку (енергію упорядкованого руху заряджених частинок), в енергію іншого порядку (механічну роботу). А таке перетворення, якщо і супроводжується певними енергетичними втратами, то лише такими які пов’язані з механічним або електричним тертям. А такі втрати відносно легко мінімізуються. Тому сучасні електричні двигуни мають високий ККД, величина якого досягає 99%.
Контрольні запитання.
1.Поясніть будову та принцип дії поршневого двигуна.
2. Поясніть будову та принцип дії турбінного двигуна.
3. Поясніть будову та принцип дії реактивного двигуна.
4. Чим схожі та чим відрізняються дизельні і карбюраторні двигуни?
5. Поясніть загальний принцип дії теплового двигуна.
6. Що необхідно зробити для того щоб максимально збільшити ККД теплового двигуна? Чи легко це реалізувати на практиці? Чому?
7. Чому в теплових двигунах продукти згорання палива викидають за межі двигуна при відносно великих температурах?
8. Чому ККД сучасних теплових двигунів значно менший за 50%, тоді як ККД сучасних електричних двигунів близький до 100%?
9. В чому основна складність роботи інженера-конструктора?
Вправа 36.
1. Температура нагрівника ідеального теплового двигуна 2000°С, а його охолоджувача 200°С. Визначити ККД цього двигуна
2. ККД ідеального теплового двигуна 40%. Газ одержує від нагрівача 5кДж теплоти. Яка кількість теплоти віддана холодильнику?
3. Визначити ККД теплового двигуна, який розвиває потужність 95кВт та витрачає за годину 25кг дизельного палива (q=42·106Дж/кг)?
4. Потужність одного з найбільших дизельних двигуні становить 42000кВт. Скільки дизельного палива споживає цей двигун за годину роботи, якщо його ККД 40%
5. Яку кількість бензину витратили двигуни літака, що пролетів 500км з середньою швидкістю 250км/год, якщо середня потужність його двигунів 2000кВт? ККД двигуна 25%.
6. На скільки кілометрів шляху вистачить 8л бензину для двигуна мотоцикла, який маючи ККД 25% при швидкості 72км/год розвиває потужність 9кВт? Густина бензину 0,7·103кг/м3.
7. Визначити потужність двигуна автомобіля, який при швидкості 72км/год витрачає на кожний кілометр шляху 90г бензину. ККД двигуна 30%
8. Двигун реактивного літака з ККД 30% при швидкості польоту 1800км/год розвиває тягове зусилля 90кН. Визначити витрати гасу за годину польоту та потужність двигуна.