РІДИНИ ТА ЇХ ВЛАСТИВОСТІ, ТВЕРДІ ТІЛА ТА ЇХ ВЛАСТИВОСТІ

Тема 2.3 Рідини та їх властивості.
§17. Поверхневий натяг рідини.
§18. Явища на межі рідина – тверде тіло. Капілярні явища.
§19. Гідросфера Землі.
Тема 2.4. Тверді тіла та їх властивості.
§20. Кристалічні тіла та їх властивості.
§21. Види кристалічних структур.
§22. Аморфні тіла та їх властивості.
§23. Фази речовини. Фазові переходи.
§24. Фазові перетворення, як один з проявів закону
переходу кількісних змін в якісні.
§25. Рідкі кристали.
§26. Полімери та їх властивості.
Тема 2.3 Рідини та їх властивості.
Рідинами – називають такі речовинні об’єкти, які мають певний сталий об’єм, але не мають певної сталої форми і в яких середня потенціальна енергія молекул, мінімально більша за їх середню кінетичну енергію, тобто: V=const; Ф≠const; Еп ≥ Ек.
Факт того, що в рідинах потенціальна енергія молекул мінімально більша за їх кінетичну енергію (Еп ≥ Ек), безумовно вказує на те, що пояснюючи фізичні властивості тієї чи іншої рідини, потрібно враховувати величину потенціальної енергії її молекул. А як відомо, теоретично визначати цю величину ми не вміємо (Еп=?). По суті це означає, що стрункої теорії рідин, подібної до теорії газів, не існує. Це звичайно не означає, що сучасна наука не може пояснити властивості тієї чи іншої конкретної рідини. Мова йде лише про те, що фізичні властивості різних рідин є суттєво різними і що різноманіття цих властивостей не можливо описати простою теоретичною схемою, подібною до тієї яка представлена на мал.33.
Про загальні механічні властивості рідин та про ті закони що описують ці властивості, ми говорили в процесі вивчення теми «механіка рідин та газів». Тому наразі коротко зупинимся лише на деяких загально фізичних особливостях рідин та пояснимо їх. Пояснимо виходячи з того, що всі речовини складаються з молекул, які рухаються та взаємодіють між собою.
§17. Поверхневий натяг рідини.
Напевно, ви звертали увагу на те, що поверхневий шар рідини має певні пружні властивості, тобто веде себе так, ніби ця рідина вкрита надтонкою пружною плівкою. Якщо ні, то уважно придивіться до процесу формування краплі води (мал.52). Не важко бачити, що ця вода знаходиться у своєрідному еластичному мішечку, який до певної межі збільшується в розмірах, а потім відривається і у вигляді круглої краплі падає вниз. Ясно, що насправді, ніякого окремого від води мішечка не існує. Адже в краплі води, нічого окрім молекул води нема. Просто сам поверхневий шар рідини має певні властивості пружної плівки.


Мал.52. Процес формування краплі є наочним прикладом того, що поверхневий шар рідини має певні пружні властивості.
Чому ж поверхневий шар рідини веде себе як пружна плівка? Відповідаючи на це не просте запитання, розглянемо дві довільно вибрані молекули (мал.53), одна з яких (1) знаходиться всередині рідини, а інша (2) – в її поверхневому шарі. Не важко бачити, що молекула 1, з усіх сторін щільно і практично рівномірно оточена сусідніми молекулами, кожна з яких притягує її. Ясно, що в такій ситуації, та усереднена результуюча сила з якою сусідні молекули діють на молекулу 1, дорівнює нулю.
Молекула ж поверхневого шару рідини (молекула 2), оточена близькими сусідами лише з одного боку – з боку рідини. І не важко збагнути, що та результуюча сила з якою сусідні молекули притягують молекулу поверхневого шару не дорівнює нулю і є такою що направлена всередину рідини. А це означає, що на кожну молекулу поверхневого шару рідини діє певна результуюча сила, яка намагається втягнути цю молекулу всередину рідини. Цю силу називають силою поверхневого тиску (Fp).
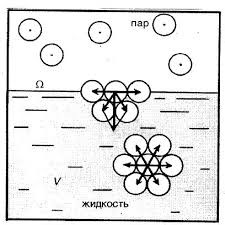
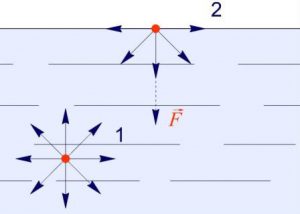
Мал.53. На кожну молекулу поверхневого шару рідини діє певна результуюча сила, яка прагне втягнути цю молекулу всередину рідини.
Прямим наслідком дії сил поверхневого тиску є факт того, що за відсутності зовнішніх силових впливів, будь яка рідина прагне набути форму кулі. І це закономірно. Адже якщо кожна молекула поверхневого шару рідини прагне потрапити всередину рідини, то це означає що рідина прагне набути такої форми, при якій кількість молекул на її поверхні є мінімально можливою. А такою формою є куля. Бо саме куля є тією геометричною фігурою, яка при мінімальній площі поверхні (а отже, при мінімальній кількості молекул на цій поверхні) має максимально можливий об’єм.
Інша справа, що ті сили які прагнуть надати рідині кулястої форми є досить слабкими. Тому, за наявності суттєвих зовнішніх силових впливів, зокрема сили тяжіння, рідина приймає форму тієї посудини в якій вона знаходиться. Однак, навіть в цьому випадку, вільна поверхня рідини прагне бути рівною, тобто такою на якій міститься мінімально можлива кількість молекул.
Сила поверхневого тиску має ту особливість, що її практично не можливо виміряти. Не можливо головним чином тому, що намагаючись максимально ущільнити молекули поверхневого шару рідини, сила поверхневого тиску створює такі умови, при яких між цими молекулами виникають відповідні сили відштовхування. А це означає, що на той прилад за допомогою якого ви будете вимірювати силу поверхневого тиску, неминуче діятимуть дві рівні за величиною і протилежно направлені сили, результуюча яких дорівнює нулю.
Практично важливим наслідком силової дії поверхневого тиску є так званий поверхневий натяг. Поверхневий натяг рідини – це явище, суть якого полягає в тому, що поверхневий шар рідини веде себе як пружна плівка яка прагне до максимального скорочення. Міцнісні властивості поверхневого шару рідини характеризує сила поверхневого натягу. Фізичну суть та механізм дії цієї сили надзвичайно важко пояснити шляхом певних механічних аналогій. Тому просто зауважимо, що сила поверхневого натягу є результуючою всієї сукупності тих міжмолекулярних взаємодій що відбуваються в приповерхневому шарі рідини і яка протидіє збільшенню площі цього приповерхневого шару. Сила поверхневого натягу вигідно відрізняється від сили поверхневого тиску тим, що її можна безпосередньо виміряти.
Сила поверхневого натягу – це направлена вздовж поверхні рідини сила, яка є результуючою всієї сукупності тих міжмолекулярних взаємодій, що відбуваються в приповерхневому шарі рідини і яка протидіє збільшенню площі цього приповерхневого шару.
Позначається: Fпн
Визначальне рівняння: Fпн=σℓ, де σ – коефіцієнт поверхневого натягу; ℓ – довжина тієї лінії поверхні, на якій діє відповідна сила поверхневого натягу.
Одиниця вимірювання: [Fпн] = Н.
Коефіцієнт поверхневого натягу рідини – це фізична величина, яка є силовою характеристикою поверхневого шару рідини і яка дорівнює відношенню сили поверхневого натягу, до довжини тієї лінії поверхні на якій ця сила діє.
Позначається: σ
Визначальне рівняння: σ= Fпн/ℓ
Одиниця вимірювання: [σ] = Н/м.
Величина коефіцієнту поверхневого натягу рідини визначається експериментально і записується у відповідну таблицю.
Таблиця. Коефіцієнт поверхневого натягу деяких рідин (для t = 20ºC)
| Речовина | σ (Н/м) | Речовина | σ (Н/м) |
| Ацетон | 0,024 | Мильний розчин | 0,040 |
| Бензин | 0,029 | Ртуть | 0,465 |
| Вода | 0,073 | Спирт етиловий | 0,023 |
| Гліцерин | 0,059 | Ефір етиловий | 0,017 |
| Гас | 0,024 |
Потрібно зауважити, що пружні властивості поверхневого шару рідини, суттєво відрізняються від властивостей звичайної пружної плівки. З’ясовуючи суть цих відмінностей, звернемось до наступного експерименту (мал.54). П-подібну дротяну рамку опустимо в мильний розчин і за допомогою чутливого динамометра будемо повільна піднімати її (або повільно опускати посудину з рідиною). Спостереження показують, що допоки рамка знаходиться в рідині показання динамометра чисельно дорівнюють вазі рамки (звичайно з врахуванням діючої на неї сили Архімеда). Коли ж горизонтальна частина рамки стикається з поверхневим шаром рідини і починає виходити за його межі, показання динамометра суттєво збільшуються. Збільшуються на величину тієї сили поверхневого натягу, що діє на горизонтальну частину рамки. І от що цікаво, в процесі подальшого піднімання рамки, збільшення площі тієї плівки що тягнеться за нею, не супроводжується збільшенням діючої на рамку сили поверхневого натягу.
Такий стан речей здається дивним. Адже згідно з законом Гука, в процесі пружної деформації плівки, величина деформуючої сили (а відповідно і сили пружності) має збільшуватись. Однак в тому то й справа, що пружні властивості поверхневого шару рідини і пружні властивості звичайної плівки, це абсолютно різні властивості, які мають абсолютно різне походження. Адже коли розтягується гумова плівка, то її пружні властивості є результатом того, що відстані між молекулами гуми збільшуються і відповідно збільшуються сили міжмолекулярної взаємодії. Коли ж розтягується поверхневий шар рідини, то відстані між його молекулами залишаються незмінними, а змінюється лише кількість тих молекул що утворюють відповідний поверхневий шар. При цьому та сила під дією якої збільшується площа поверхневого шару рідини, залишається практично незмінною.
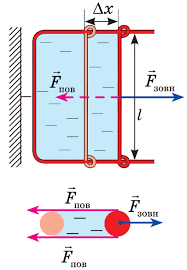
Мал.54. В процесі «розтягування» поверхневого шару рідини, величина деформуючої сили залишається незмінною.
Крім всього іншого, представлений на мал.54 експеримент, відображає суть одного з найбільш ефективних методів визначення коефіцієнту поверхневого натягу – методу відриву тіла від поверхні рідини. А ця суть полягає в наступному. Експериментально вимірявши величину тієї додаткової сили що йде на відрив тіла від поверхні рідини (сили поверхневого натягу Fпн) та довжину тієї лінії на якій ця сила діє (ℓ), визначають відповідне значення коефіцієнту поверхневого натягу (σ). При цьому, потрібно зважити на факт того, що та плівка яка тягнеться за рамкою вимірювального приладу, має дві вільні поверхні. Тому, в умовах даного експерименту σ = Fпн/2ℓ.
В процесі вивчення фізики, ми неодноразово наголошували на тому, що одне і те ж явище може мати декілька наукових пояснень. І в цьому сенсі, явище поверхневого натягу не є винятком. Адже це явище можна пояснити не лише на основі аналізу тих сил що діють на молекули речовини в тій чи іншій ситуації (силовий метод досліджень), а й на основі аналізу енергетичних параметрів цих молекул (енергетичний метод досліджень).
Дійсно. Для того щоб молекула внутрішнього шару рідини (молекула 1, мал.53) перемістилась в поверхневий шар цієї рідини, потрібні певні енергетичні затрати. А це означає, що в поверхневому шарі рідини неминуче зосереджена певна кількість надлишкової енергії. В одному ж з базових законів Природи, який прийнято називати принципом мінімуму стверджується: будь яка система, прагне прийти до такого стану, при якому кількість зосередженої в ній надлишкової енергії буде мінімально можливою. В нашій ситуації, очевидним способом зменшення кількості тієї надлишкової енергії що міститься в поверхневому шарі рідини є граничне зменшення площі цього шару.
Таким чином, у відповідності з базовими законами Природи, поверхневий шар рідини, маючи певну кількість надлишкової енергії, завжди прагне до того щоб гранично зменшити величину цієї надлишкової енергії. Реалізацією цих енергетичних прагнень, є факт того, що поверхневий шар рідини веде себе як пружна плівка яка прагне до максимального скорочення.
На завершення додамо, що застосовуючи енергетичний метод пояснення того явища яке називають поверхневим натягом, замість тієї величини яку прийнято називати силою поверхневого натягу, застосовують величину яку називають енергією поверхневого натягу або поверхневою енергією.
Енергія поверхневого натягу (поверхнева енергія) – це та надлишкова енергія, яку має поверхневий шар рідини (порівняно з її внутрішніми шарами) і яка завжди протидіє збільшенню площі відповідного поверхневого шару.
Позначається: Епн
Визначальне рівняння: Епн= σS, де σ – коефіцієнт поверхневого натягу рідини; S – площа відповідного поверхневого шару рідини.
Одиниця вимірювання: [Епн] = Дж.
Ясно, що при енергетичному методі пояснення поверхневого натягу, та величина яку називають коефіцієнтом поверхневого натягу, набуває нового фізичного змісту.
Коефіцієнт поверхневого натягу – це фізична величина, яка є енергетичною характеристикою поверхневого шару рідини і яка дорівнює відношенню тієї енергії (∆Епн) що йде на збільшення площі вільної поверхні рідини, до величини цієї площі (∆S).
Позначається: σ
Визначальне рівняння: σ = ∆Епн/∆S
Одиниця вимірювання: [σ] = Дж/м2.
І потрібно зауважити, що жодних протиріч між визначальними рівняннями σ=Fпн/ℓ та σ=∆Епн/∆S нема. Дійсно. В умовах представленого на мал.54 експерименту ∆Епн=Fпн∆x; ∆S=ℓ∆x. Тому: σ = ∆E/∆S = Fпн∆х/ℓ∆х = Fпн/ℓ = σ.
Поверхневий натяг рідини суттєво залежить від наявності домішок в ній. При цьому, деякі домішки посилюють поверхневий натяг рідини, а деякі – послаблюють його. Наприклад сіль і цукор дещо збільшують поверхневий натяг води, а спирти та ефіри – зменшують цей натяг. Домішки які суттєво послаблюють поверхневий натяг рідини називають поверхнево активними речовинами. Загально відомим прикладом поверхнево активної речовини є мило.
Наочною демонстрацією дії поверхнево активної речовини є наступний простий експеримент. Наберіть в чисту посудину, наприклад тарілку, чистої води. Більш менш рівномірним шаром посипте поверхню цієї води меленим коріандром, перцем, тальком чи чимсь подібним. Змочіть олівець чи власний палець миючим засобом і торкніться цим олівцем (пальцем) поверхні води (мал.55). При цьому ви побачите, як наявні на поверхні частинки швидко розбігаються від місця дотику. Розбігаються тому, що з тієї сторони де з’являються молекули поверхнево активної речовини, діяча на тверді частинки сила поверхневого натягу зменшується і тому ці частинки рухаються в той бік де ця сили залишилась попередньо великою.
Мал.55. Ілюстрація впливу поверхнево активної речовини на силу поверхневого натягу рідини.
У побуті, поверхнево активні речовини широко застосовуються як миючі засоби (мило, шампуні, пральні порошки). В промисловості, поверхнево активні речовини використовуються при виробництві фарб, клеїв, дезінфікуючих засобів, для очищення поверхонь від пилу жирів та мастил, для покращення умов фарбування, адгезії (прилипання, зчеплення), тощо. В сільському господарстві – для покращення змочуваності поверхонь рослин засобами живлення рослин, боротьби з хворобами та шкідниками. В організмі людини, поверхнево активні речовини приймають участь в процесі дихання та роботі травної системи. Втім, поверхнево активні речовини можуть бути не лише корисними, а й шкідливими. Деякі з них викликають зниження імунітету, алергічні реакції, ураження печінки, нирок, тощо.
Задача 1. Яку роботу треба виконати, щоб видути мильну бульбашку діаметром 12см?
Дано: Рішення:
d = 12см = 0,12м Виходячи з того, що за визначенням А=ΔЕ, де ΔЕ –
А = ? затрати енергії на виконання роботи, та враховуючи,
що в умовах нашої задачі ΔЕ=σΔS, де σ=0,04Н/м=0,04Дж/м2, ΔS – зміна площі поверхні бульбашки в процесі її видування. А оскільки у бульбашки дві поверхні, то ΔS=2·Sсфери =2πd2. Таким чином А= ΔЕ=σΔS=σ2πd2.
Розрахунки: А=2σπd2 = 2·0,04(Дж/м2)3,14(0,12м)2 = 3,6·10–3Дж.
Відповідь: А=3,6·10–3Дж.
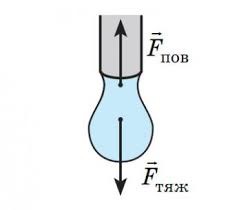
Задача 2. Яку масу має крапля води при витіканні з скляної трубки діаметром 3мм, якщо вважати, що діаметр шийки краплі дорівнює діаметру трубки.
Дано: Рішення:
d = 3мм = 3·10–3м Виконуємо малюнок який відображає
m = ? фізичний зміст задачі. Будемо виходити з
того, що в момент утворення шийки краплі, її маса є максимально можливою, і що діючі на краплю сили (сила тяжіння Fт=mg та сила поверхневого натягу Fпн=σℓ) зрівноважують одна одну: mg=σℓ, де ℓ=πd – довжина тієї лінії поверхні на якій діє сила поверхневого натягу. Таким чином m=σπd/g.
Розрахунки: m=σπd/g = 0,073(Н/м)·3,14·3·10–3м/9,8(м/с2) = 7·10–5кг.
Відповідь: m = 7·10–5кг.
Контрольні запитання.
1. Чим відрізняються ті ситуації в яких знаходяться молекули поверхневого шару рідини та її внутрішніх шарів?
2. Яку силу називають силою поверхневого тиску?
3. Яку силу називають силою поверхневого натягу? Чим сила поверхневого натягу вигідно відрізняється від сили поверхневого тиску?
4. Поясніть суть та причини тих відмінностей які існують між пружними властивостями поверхневого шару рідини та звичайної пружної плівки.
5. Що називають енергією поверхневого натягу?
6. Дайте силове визначення коефіцієнту поверхневого натягу.
7. Дайте енергетичне визначення коефіцієнту поверхневого натягу.
8. Поясніть явище поверхневого натягу на основі енергетичного методу досліджень.
9. Які речовини називають поверхнево активними?
Вправа 17.
1. З якою силою діє мильна плівка на дротину АВ, якщо довжина дротини 3см? Яку роботу потрібно виконати, щоб перемістити дротину на 2см?
2. Яку масу має крапля води що витікає з скляної трубки діаметром 4мм, якщо діаметр шийки краплі дорівнює діаметру трубки?
3. Яке зусилля необхідне для того щоб відірвати тонке кільце масою 4г від поверхні води? Діаметр кільця 8см.
4. Яку роботу потрібно виконати, щоб видути мильну бульбашку діаметром 10см?
5. Однакові маси холодної і гарячої води витікають через однакові крапельниці. При цьому, холодної води витекло 40 крапель, а гарячої – 48 крапель. Порівняйте коефіцієнти поверхневого натягу холодної і гарячої води.
6. Вода з інтервалом 1с, крапля за краплею витікає з бюретки через отвір діаметром 2мм. За який час з бюретки витече 25см3 води.
7. Скільки енергії потрібно витратити на те, щоб краплю ртуті радіусом 1см розділити на дві однакові краплі?
8. Мильна кулька має радіус 2см. Визначити різницю тисків всередині та назовні кульки. Вважати що коефіцієнт поверхневого натягу мильного розчину 0,07Н/м.
§18. Явища на межі рідина – тверде тіло. Капілярні явища.
Дослідження показують, що крапля однієї і тієї ж рідини на одних твердих поверхнях розтікається, а на інших – не розтікається, тобто залишається у вигляді приплюснутої силою тяжіння краплі. Наприклад, крапля води розтікається поверхнею скла (мал.56б) і не розтікається на поверхні парафіну (мал.56а). При цьому говорять, що вода змочує скло і не змочує парафін.
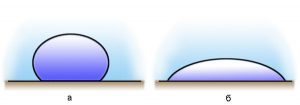

Мал.56. Крапля рідини на одних твердих поверхнях розтікається (змочує поверхню), а на інших – не розтікається (не змочує поверхню).
Пояснюючи факт змочування рідиною твердої поверхні чи не змочування її, можна сказати наступне. Поведінка краплі рідини на тій чи іншій твердій поверхні, визначальним чином залежить від того, які сили більші: сили взаємодії між молекулами самої рідини (fр), чи сили взаємодії між молекулами рідини та молекулами твердого тіла (fт). При цьому ясно, якщо сили взаємодії між молекулами самої рідини більші за сили взаємодії між молекулами рідини та твердого тіла (fр ˃ fт), то рідина не змочує тверду поверхню. А якщо сили взаємодії між молекулами рідини менші за сили їх взаємодії з молекулами твердої поверхні (fр ˂ fт), то рідина відповідну поверхню змочує.
На практиці, факт змочування чи не змочування даної твердої поверхні, визначають наступним чином. На відповідну поверхню кладуть краплю рідини. Змінюючи кут нахилу поверхні, змушують цю краплю переміщуватись. При цьому, якщо в процесі переміщення на поверхні залишається суцільний слід рідини, то це означає що рідина змочує поверхню. Якщо ж крапля рідини скочується поверхнею не залишаючи суцільного сліду, то ця рідина дану поверхню не змочує. Потрібно зауважити, що змочуваність тієї чи іншої поверхні суттєво залежить від того наскільки чистою є ця поверхня. Адже якщо наприклад, скло покрито непомітним шаром бруду чи жиру, то його змочуваність суттєво погіршується.
Зазвичай, ступінь змочуваності тіла рідиною, оцінюють параметром, який називається кутом змочування або краєвим кутом. Кут змочування (краєвий кут) – це величина, яка характеризує ступінь змочуваності твердої поверхні рідиною і яка дорівнює куту між цією твердою поверхнею та дотичною до поверхні рідини проведеною в точці дотику рідини і твердої поверхні та виміряному з боку рідини. Позначається θ. Прийнято вважати, що коли кут змочування менший за 90º (θ < 90º), то відповідна рідина в тій чи іншій мірі змочує тверду поверхню. А якщо цей кут більший за 90º (θ > 90º) – не змочує її.
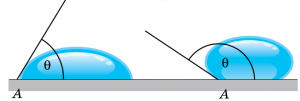
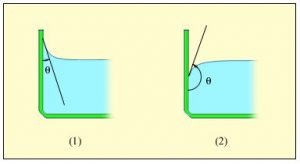
Мал.57. Ступінь змочуваності твердої поверхні рідиною, оцінюють кутом змочування (θ) .
Ступінь змочуваності тіла рідиною, можна оцінити не лише за формою відповідної краплі, а й за параметрами меніску рідини. Меніском (від грец. meniskos – півмісяць) називають те викривлення вільної поверхні рідини, яке відбувається в місці контакту рідини з поверхнею твердого тіла. Наприклад, якщо в скляну посудину налити воду (мал.57в), то можна помітити, що в місці її контакту з поверхнею скла, вода дещо піднята вгору з утворенням відповідного викривлення її поверхні. Факт того, що в місці контакту з скляною поверхнею вода «тягнеться» за склом, є закономірним результатом того, що сили взаємодії між молекулами скла та молекулами води, значно потужніші за сили взаємодії між молекулами самої води.
Якщо ж воду налити в парафінову посудину (або занурити в неї парафінову свічку), то неодмінно з’ясується, що в місці контакту з парафіном, поверхня води закруглюється таким чином, ніби вода відштовхується від парафіну (мал.57г). По суті, ніякого відштовхування води від парафіну не відбувається. Просто молекули води взаємодіють між собою значно сильніше ніж з молекулами парафіну. В такій ситуації, сили їх взаємодії (сили поверхневого натягу), прагнучи надати поверхні води енергетично доцільної круглої форми, створюють ефект відштовхування рідини від тієї поверхні яку вона не змочує.
З тими процесами які відбуваються на межі контакту рідини з твердою поверхнею, тісно пов’язані так звані капілярні явища. Напевно ви добре знаєте про те, що в системі сполучених посудин, рівень наявної в ній однорідної рідини є однаковим (мал.58а). Однак, можливо ви не знаєте, що цей закон (його називають законом сполучених посудин) виконується не завжди. В цьому не важко переконатись за допомогою простого приладу, який представляє собою систему сполучених скляних трубок різних та достатньо малих діаметрів (мал.58б). Наливши в цю систему певну кількість води, ви неодмінно з’ясуєте, що рівень рідини в цих сполучених посудинах є суттєво різним.
а)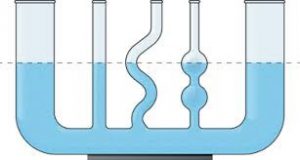 б)
б)
Мал.58. В сполучених посудинах, рівень налитої в них однорідної рідини може бути різним.
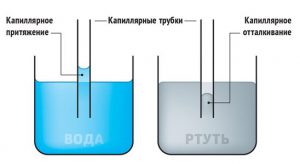
Тепер, коли ви знаєте, що вода змочує скло і що це відбувається завдяки сильному взаємному притягуванню між молекулами води і скла, не важко зрозуміти, чому в вузьких скляних трубках вода піднімається на певну надлишкову висоту. Правильно, скло сильно взаємодіючи з при поверхневою водою, піднімає її на певну додаткову висоту. Власне, скло завжди піднімає певну кількість приповерхневої води. Однак, якщо ця піднята приповерхнева вода знаходиться в посудині відносно великих розмірів, наприклад склянці води, то її кількість здається несуттєво малою. Якщо ж аналогічна кількість піднімається в трубці малого діаметру, то висота цього піднімання стає відповідно великою.
Тонкі трубки, судини, пори, щілини, тощо, прийнято називати капілярами (від лат. capillaris – волосина). Сукупність же тих явищ, які пов’язані з перебуванням та рухом рідин в капілярах, називають капілярними явищами.
З’ясовуючи закономірності поведінки рідини в капілярі, розглянемо ті сили що діють на підняту в капілярній трубці рідину (мал.59). Відразу ж зауважимо, що фактичною причиною піднімання рідини в капілярі є результуюча тих взаємодій, які відбуваються між молекулами рідини і молекулами стінок капіляру. Однак, ця результуюча сила не може підняти рідини більше за ту її кількість, яку спроможні втримати сили поверхневого натягу. Виходячи з цього, прийнято вважати, що тією силою яка утримує підняту в капілярі рідину, є сила поверхневого натягу: Fпн = σℓ, де ℓ – довжина тієї лінії по якій поверхня рідини, взаємодіє з поверхнею капіляру.
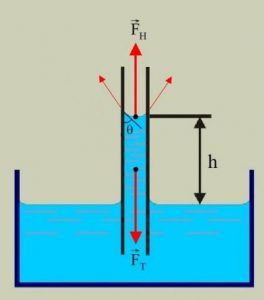
Мал.59. Якщо рідина змочує стінки капіляру, то вона піднімається на певну додаткову висоту, а якщо не змочує – то на відповідну висоту опускається.
Таким чином, на підняту в капілярі рідину діють дві сили: сила тяжіння Fт=mg (де m – маса піднятої в капілярі рідини) та сила поверхневого натягу Fпн=σℓ. При цьому, зважаючи на стан механічної рівноваги рідини, можна записати: Fт= Fпн , або mg=σℓ, де ℓ=πd; m=ρV=ρSh=ρπd2h/4.
Звідси: h = 4σ/ρgd.
Висновок. Та висота на яку піднімається рідина в капілярі, прямо пропорційна величині коефіцієнту поверхневого натягу рідини і обернено пропорційна густині рідини та діаметру капіляру.
Не важко збагнути, що знаючи густину рідини (ρ), та вимірявши діаметр капіляру (d) і ту висоту (h) на яку рідина піднімається в капілярі, можна визначити коефіцієнт поверхневого натягу відповідної рідини: σ = ρgdh/4. Порівняно з іншими методами експериментального визначення коефіцієнту поверхневого натягу, капілярний метод має ряд суттєвих переваг. По перше, він не потребує складного та коштовного обладнання, а отже є дешевим та простим. По друге, ті величини які фігурують в формулі σ = ρgdh/4 є такими що легко і достатньо точно вимірюються. По третє, цей метод є статичним, тобто таким в якому аналізується та ситуація при якій рідина знаходиться в стані механічного спокою.
В капілярній трубці, рідина може не лише підніматись, а й навпаки – опускатись. Це відбувається в тому випадку, коли матеріал капілярної трубки не змочується рідиною. Наприклад, якщо скляний капіляр занурювати у ртуть, то рівень ртуті в капілярі виявиться нижчим за її загальний рівень. Або якщо наприклад, капілярна трубка виготовлена з парафіну, то при її зануренні у воду, рівень води в капілярі буде нижчим за її загальний рівень. При цьому можна довести, що та висота на яку опускається рідина в незмочуваному капілярі, також визначається за формулою h = 4σ/ρgd.
Капілярні явища відіграють надзвичайно важливу роль як в живій так і в неживій природі. Скажімо ґрунт представляє собою певну капілярну систему по якій вода та розчинені в ній речовини піднімаються вгору та живлять коріння рослин. В рослинах, капілярна система забезпечує підйом вологи від дрібних корінців до найвіддаленішого листя. Саме в капілярах відбуваються основні процеси, пов’язані з диханням і живленням організмів. Достатньо сказати, що в капілярній системі організму людини налічується понад 160 мільярдів капілярів, загальна довжина яких майже 80 000 кілометрів.
Капілярні явища застосовуються і в побуті. Скажімо, завдяки наявності капілярів рушники, серветки, марлі та промокальні папери, швидко вбирають наявну вологу. Капілярні явища можуть бути не лише корисними, а й шкідливими. Наприклад будівельна цегла представляє собою певну капіляру систему яка активно поглинає вологу. Тому, за наявності контакту цегли з ґрунтовими водами, цей контакт переривають за допомогою гідроізоляційних матеріалів – бітум, руберойд, тощо.
Задача. Ртутний барометр має внутрішній діаметр трубки 3мм. Яку поправку в показання барометра потрібно внести, щоб врахувати капілярне опускання ртуті?
Дано: Рішення:
d = 3мм = 3·10–3м Будемо виходити з того, що трубка діаметром 3мм
Δh = ? є капіляром, що ртуть не змочує скло і тому її рівень
в капілярі буде нижчим за рівень без урахування капілярності на висоту Δh. Величину цієї висоти можна визначити із наступних міркувань. В умовах ртутного барометра, сила зовнішнього атмосферного тиску прагне підняти ртуть на висоту відповідну цьому тиску. І якщо ця висота на величину Δh виявляється меншою за очікувану, то це тільки тому, що відповідному підніманню протидіє сила поверхневого натягу ртуті Fпн=σℓ=σπd. І величина цієї протидії дорівнює вазі тієї маси ртуті, що відповідає висоті Δh, тобто силі F=mg=ρVg=ρSΔhg=ρ(πd2/4)Δhg. Іншими словами σπd= ρ(πd2/4)Δhg, звідси Δh = 4σ/ρgd, де σ=0,47Н/м коефіцієнт поверхневого натягу ртуті, ρ=13,6·103кг/м3 густина ртуті.
Розрахунки: Δh = 4σ/ρgd = 4·0,47/13,6·103·9,8·3·10–3 = 0,0046м = 4,6мм.
Відповідь: Δh = 4,6мм.
Контрольні запитання.
1. Що означає твердження: а) рідина змочує тверду поверхню; б) рідина не змочує тверду поверхню?
2. Як перевіряють на практиці змочує чи не змочує дана рідина ту чи іншу тверду поверхню?
3. Як пояснюється факт того, що крапля води на поверхні скла розтікається, а на поверхні парафіну – не розтікається?
4. Чому вода піднімається в скляному капілярі?
5. Від чого залежить висота піднімання (опускання) рідини в капілярі?
6. Чи залежить висота підняття рідини в капілярі від температури? Чому?
7. Що стверджується в законі сполучених посудин? Чому цей закон в системі сполучених капілярів різного діаметру не виконується?
8. Поясніть суть капілярного методу визначення коефіцієнту поверхневого натягу? Які переваги цього методу над методом відриву краплі?
Вправа 8.
1. В капілярній трубці діаметром 1мм, бензин піднявся на висоту 17мм. Визначити коефіцієнт поверхневого натягу бензину і його кількість в капілярі. Густина бензину 700кг/м3.
2. Яким має бути діаметр капілярної трубки, щоб вода в ній піднялась на 10см?
3. Визначте масу піднятої в капілярі води, якщо діаметр капіляру: а) 1мм; б) 0,5мм; в) 0,1мм.
4. Дві однакові капілярні трубки, діаметром 0,5мм опустили в воду і бензин. На скільки відрізняються висоти рідин в цих капілярах?
5. Водяний манометр має внутрішній діаметр трубки 3мм. Яку поправку в показання манометра потрібно внести, щоб врахувати капілярне піднімання води?
6. Скляний капіляр діаметром 0,1мм опустили в воду при температурі 20ºС. При нагріванні води до 70ºС висота рідини в капілярі зменшилась на 3,2см. Визначте коефіцієнт поверхневого натягу води при 70ºС. Розширенням води і скла при нагріванні знехтувати.
7. Решето діаметром 20см утворюють паралельні та перпендикулярні тонкі нитки, відстані між якими 1мм. Скільки води можна винести в такому решеті?
§19. Гідросфера Землі.
Гідросферою Землі називають всю сукупність тієї твердої, рідкої та газоподібної води, що міститься на Землі. Складовими цієї сукупності є океани, моря, льодовики, річки, озера, болота, сніги, ґрунтові та підземні води, атмосферна волога і навіть та вода що входить до складу живих організмів. Загальна маса гідросфери Землі близька до 1,46·1021кг. Це в 275 разів більше за масу атмосфери Землі і приблизно 0,025% від загальної маси всієї планети. Левова частина гідросфери Землі (приблизно 96,5%) зосереджена в водах Світового океану, складовими якого є океани та моря, а також океанські та морські затоки. Ще приблизно 3,5% гідросфери Землі відносять до вод суходолу, складовими яких є річки, озера, болота, штучні водойми, льодовики, підземні та грунтові води. При цьому, левова частина вод суходолу зосереджена в льодовиках та підземних водах. Відносно незначна частина гідросфери (приблизно 0,001%) постійно зосереджено в атмосфері Землі.
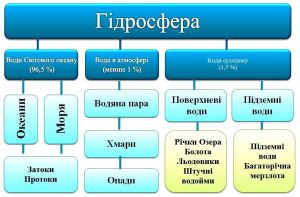
Мал.60. Загальна структура гідросфери Землі.
Роль гідросфери в кругообігу тих подій що відбуваються на Землі важко переоцінити. Ілюструючи значимість цієї ролі, розглянемо лише декілька аспектів того гігантського кругообігу енергії та речовини що постійно відбувається на Землі.
Дослідження показують, що на Землі щорічно випаровується 4,5·105км3 води. Це трохи менше аніж її міститься в такому достатньо великому та глибокому морі як Чорне і в 1750 разів більше аніж її міститься в такому невеликому і неглибокому морі як Азовське.
450000км3 перетвореної на пар води. Щоб уявити енергетичні масштаби цієї величини можна сказати, що для випаровування 450000км3 води знадобиться щонайменше 1·1024Дж енергії. Ви не розумієте скільки це 1·1024Дж енергії? Тоді можливо вам стане зрозумілішим, якщо сказати, що для отримання такої кількості енергії, потрібно спалити 5·1016кг вугілля. Ви не уявляєте скільки це 5·1016кг вугілля? Тоді давайте розв’яжемо простеньку задачу. Відомо, що стандартний вантажний вагон довжиною 13,5м, будучи вщерть заповненим вміщує 60т вугілля. Скільки таких вагонів знадобиться для того щоб перевезти 5·1016кг вугілля. Якої довжини буде відповідний потяг? Порівняйте цю довжину з відстанню до Сонця (L=1,49·1011м).
Розрахунки:
N = m/m0 = 5·1016кг/6·104кг = 83,3·1010 вагонів;
ℓ = Nℓ0 = 83,3·1010·13,3м = 112,5·1011м;
n = ℓ/L = 112,5·1011м/1,49·1011м = 82,2 рази.
Ну що, уявляєте вщерть заповнений вугіллям потяг, довжина якого в понад 82 рази більша за відстань до Сонця, в 30000 разів більша за відстань до Місяця і в 280000 разів більша за довжину периметру Землі виміряного вздовж екватора? Не уявляєте? І тим не менше, щорічно на Землі на випаровування води витрачається така колосальна кількість енергії (Це приблизно 18% від тієї енергії, яка щорічно надходить на Землю з сонячним світлом). Саме за рахунок цієї енергії, утворюються і течуть всі струмки і потужні ріки, йдуть всі дощі, випадають всі сніги, роси, тумани, тощо.
При цьому, ви маєте розуміти, що та енергія яка поглинається в процесі випаровування, в процесі конденсації виділяється. І виділяється її рівно стільки ж, скільки витрачається на процес випаровування. А це означає, що та енергія яка, наприклад, вдень витрачається на випаровування, вночі виділяється в процесі конденсації. Або, наприклад, вода випаровується в тому місці де жарко, а конденсується і відповідно віддає свою енергію в тому місці де холодно.
Додайте до цього той факт, що гідросфера Землі приймає активну участь не лише в процесі випаровування – конденсації, а й в інших теплових процесах, зокрема процесі нагрівання – охолодження. При цьому, та вода яка нагрівається вдень, охолоджується а відповідно і віддає акумульовану енергію вночі. Та вода, яка нагрівається в жарких, екваторіальних областях планети, у вигляді надпотужних океанських течій, рухається в напрямку полярних областей і робить ці області більш теплими. Натомість, холодна вода приполярних областей, рухаючись в зворотньому напрямку, робить жаркий екваторіальний клімат більш прохолодним.
Вище сказане по суті означає, що гідросфера Землі, це надзвичайно потужний та ефективний енерго акумулюючий та енерго регулюючий пристрій, який робить клімат Землі помірно м’яким. І якби цей пристрій не працював, то ми б мали ситуацію при якій денна частина Землі нагрівалась би до майже 120ºС плюс, а нічна – охолоджувалась би до майже 100ºС мінус.
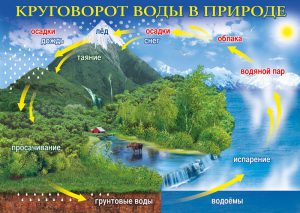
Мал.61. Кругообіг води в природі – одна з основ життя на Землі.
Але гідросфера, це не лише кліматоутворюючий фактор і не лише «кухня» погоди. Гідросфера, це і «колиска» життя на Землі. Адже, якщо на Землі виникло та успішно процвітає життя, то це головним чином завдяки двом визначальним факторам: наявності прийнятного для життя джерела енергії – Сонця, та наявності достатньо великої кількості води. При цьому, вода це не лише необхідна умова існування життя, а і його основна складова частина. Скажімо, тіло людини на 70% складається з води, а тіло огірка є водою на 98%.
Гідросфера Землі перебуває в постійній взаємодії з її атмосферою, літосферою (земною корою) та біосферою. Власне всі ці «сфери» утворюють єдиний цілісний організм. В цьому організмі, атмосфера насичує гідросферу повітряними газами, а гідросфера – насичує атмосферу водяними парами. В цьому організмі, повітряні та водяні маси значною мірою формують ландшафт земної поверхні, а підземні річки та озера є не менш чисельними та повноводними за наземні. В цьому організмі, атмосфера, літосфера та гідросфера у своїй сукупності створюють сприятливі умови для процвітання життя, а те в свою чергу суттєво впливає на ті процеси що відбуваються в повітрі, воді та під землею.
Тема 2.4. Тверді тіла та їх властивості.
Твердими називають такі речовинні об’єкти (тіла), які мають певний сталий об’єм та певну сталу форму і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію, тобто: V=const; Ф=const; Еп ˃ Ек. Факт того, що в твердих тілах енергія взаємодії молекул значно більша за енергію їх руху, по суті означає: 1) фізичні властивості різних твердих речовин є різними; 2) загальної теорії твердих речовин, подібної до теорії газів, не існує.
Все різноманіття твердих тіл, умовно можна розділити на три класифікаційні групи: тіла кристалічні, тіла аморфні та полімери. Однак, якщо мова йде про хімічно прості тверді речовини, то їх зазвичай поділяють на кристалічні та аморфні.
§20. Кристалічні тіла та їх властивості.
Переважна більшість хімічно простих твердих речовин є кристалічними. Кристалічні всі метали, всі солі, всі луги та майже всі ті речовини які називаються мінералами, коштовним та некоштовним камінням, тощо. Кристалічним є лід, цукор, алмаз, граніт, графіт, пісок та безліч інших вам відомих і невідомих речовин.
Кристалічними називають такі тверді речовини (тіла), атоми і молекули яких розташовані в певному періодичному порядку, який називається кристалічною структурою речовини. Переважна більшість природніх кристалічних тіл є полікристалічними, тобто такими які складаються з величезної кількості дрібненьких, міцно з’єднаних монокристалів (від грец. monos – один; polys – багато).
Зазвичай, внутрішній устрій кристалічної речовини, представляють у вигляді певним чином спрощеної (ідеалізованої) моделі, яку називають кристалічною решіткою або кристалічною граткою. Кристалічна решітка (гратка) – це спрощена (ідеалізована) модель внутрішнього устрою кристалічного тіла, в якій його структурні одиниці зображають у вигляді певних умовних символів (точок, кульок, тощо), а їх розташування характеризують відповідними, статистично усередненими значеннями.
Дослідження показують, що практично кожен вид кристалів, має свою індивідуальну кристалічну решітку, яка характеризується певною геометричною формою та певними розмірами. Зображення деяких найпростіших кристалічних решіток представлені на мал.62.
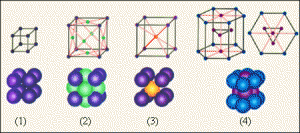
Мал.62. Загальний вигляд характерних для металів кристалічних решіток, представлених у вигляді: а) кулестержневих моделей; б) масштабних моделей.
Упорядкована періодичність в розташуванні частинок, це визначальна ознака будь якої кристалічної речовини. Але як на практиці визначити, існує ця періодичність чи не існує? Чи нема інших, більш явних ознак кристалічності тієї чи іншої речовини? А такі ознаки дійсно існують. Одна з них полягає в тому, що кристалічні тіла мають певну температуру плавлення, тобто таку температуру при якій відбувається перехід речовини від безумовно твердого стану до безумовно рідкого, і яка в процесі цього переходу залишається незмінною. Наприклад, температура плавлення льоду (кристалічної води) 0ºС. Це означає, що при температурі меншій за 0ºС, вода знаходиться в безумовно твердому стані, а при температурі більшій за 0ºС – в безумовно рідкому. Що ж стосується стану води при температурі 0ºС, то його можна охарактеризувати як стан теплової рівноваги між твердою та рідкою фазами води. Це означає, що при цій температурі вода може бути як твердою так і рідкою, і що в залежності від того отримує вона енергію чи втрачає, вода або плавиться або кристалізується.
Плавлення – це процес переходу речовини з кристалічного стану в рідкий, який відбувається при певній постійній температурі (температурі плавлення) та супроводжується поглинанням енергії. Кристалізація – це процес переходу речовини з рідкого стану в кристалічний, який відбувається при певній постійній температурі (температурі плавлення) та супроводжується виділенням енергії.
Те, що кристалічні тіла мають певну температуру плавлення, і що в процесі плавлення ця температура залишається незмінною, є цілком закономірним результатом того внутрішнього порядку який існує в цих тілах. Дійсно. В процесі нагрівання, середня кінетична енергія молекул речовини неухильно зростає. Коли ж величина цієї енергії, стає співрозмірною з величиною потенціальної енергії молекул, зв’язки між молекулами починають руйнуватись. А оскільки в кристалі молекули розташовані в певному порядку, то і руйнація відповідної кристалічної структури відбувається упорядковано-послідовно. Спочатку в рідину перетворюється зовнішній шар кристалу, потім – наступний, наступний і т.д. Аналогічним чином відбувається і процес кристалізації: упорядковано-послідовно, шар за шаром, частинки речовини об’єднується у відповідну кристалічну структуру.
Не важко збагнути, що та енергія яку отримує тіло в процесі плавлення, йде на руйнацію тих зв’язків що існують між його частинками, а по суті – на збільшення їх потенціальної енергії. При цьому кінетична енергія частинок залишається незмінною. В процесі ж кристалізації, навпаки – енергія виділяється. Виділяється подібно до того, як це відбувається при конденсації рідини: молекула пару «падаючи» на рідину, збільшує свою кінетичну енергію і відповідно зменшує потенціальну.
Таким чином, ті тверді речовини, які в процесі нагрівання ведуть себе як лід, тобто плавляться, є кристалічними. До речі, слово «кристал» в перекладі з грецької, означає «лід». По суті, наявність певної температури плавлення є основною зовнішньою ознакою кристалічності речовини. Однак, потрібно мати на увазі, що деякі безумовно кристалічні речовини не плавляться. Не плавляться тому, що не досягнувши температури плавлення, хімічно руйнуються (розпадаються на більш прості речовини), або сублімують (випаровуються). Наприклад, при температурі близькій до 1000ºС карбонат кальцію (СаСО3), а простіше кажучи крейда, розпадається на СаО та СО2. Або, наприклад, за нормально тиску, так званий сухий лід (кристалізований вуглекислий газ) при температурі –78,5ºС інтенсивно випаровується. Таке випаровування називають сублімацією (від лат. sublimo – піднімання).
Сублімація (узгін) – це процес безпосереднього переходу речовини з кристалічного стану в газоподібний, який супроводжується поглинанням енергії і інтенсивна стадія якого відбувається при певній постійній температурі (температурі сублімації). Потрібно зауважити, що як і випаровування, сублімація може відбуватись при будь якій температурі. Однак інтенсивна фаза сублімації, як і інтенсивна фаза випаровування (кипіння), відбувається при певній постійній температурі – температурі сублімації.
Враховуючи вище сказане, будемо вважати, що основною зовнішньою ознакою кристалічності речовини є наявність певної температури плавлення (плавлення, сублімації чи хімічної руйнації). Звичайно за умови, що відповідна кристалічна речовина є хімічно однорідною, а не такою, що складається з певної сукупності різних кристалічних речовин.
Ще однією характерною ознакою кристалічності речовини є те, що її монокристали, тобто обособлені одинарні кристалики, мають певну геометричну форму. І ця форма певним чином відображає параметри кристалічної решітки відповідної речовини. Наприклад, монокристали кам’яної солі (NaCℓ) мають форму куба (мал.63а), монокристали кварцу (SiO2) – форму шестигранної призми з пірамідальними вершинами (мал.63б), монокристали алмазу (С) – форму октаедра (мал.63в), монокристали графіту (С) – форму багатошарової шестигранної призми і т.д.


Мал.63. Загальний вигляд деяких монокристалів.
Потрібно зауважити, що в природних умовах, ідеально правильні та достатньо великі монокристали зустрічається надзвичайно рідко. Рідко по-перше тому, що монокристали взагалі зустрічаються рідко. А по-друге тому, що в природних умовах монокристали формуються за наявності багатьох сторонніх впливів. Тому якщо наприклад, ви візьмете придбану в крамниці сіль (NaCℓ), то скоріш за все з’ясуєте, що її окремі кристалики, рідко схожі на ідеальні кубики. І це закономірно. Адже в процесі видобутку, переробки та транспортування, сіль неодноразово подрібнювалась, перемелювалась, кришилась, тощо. Але от що характерно. Якщо цю неправильну сіль розчинити у воді, а потім воду випарувати, то на дні посудини залишаться кристалики правильної кубічної форми. Форми, яка певним чином відображає той порядок, в якому іони натрію та хлору розташовані у відповідній кристалічній структурі.
Втім, потрібно мати на увазі, що форма обособленого монокристала, залежить не лише від порядку розташування атомів у відповідній кристалічній структурі, а й від тих умов в яких відбувалась кристалізація. Наприклад, на мал.64б зображено велике різноманіття сніжинок, кожна з яких по суті є монокристалом льоду. Ці сніжинки, з одного боку, мають певні, характерні ознаки кристалічного льоду: наявність шести, певним чином орієнтованих пелюсток, які відображають той факт, що утворюючи кристалічну структуру молекули води об’єднуються в характерні шестикутники (мал.64а) З іншого ж боку, кожна сніжинка має свої індивідуальні особливості, які залежать від тих умов в яких вона формувалась.
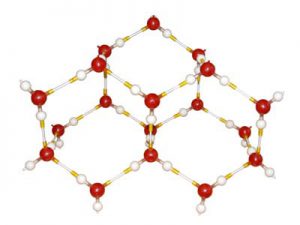

Мал.64. Форма обособленого монокристала, залежить не лише від порядку розташування атомів, а й від тих умов в яких відбувалась кристалізація.
Факт того, що обособлені монокристали мають певну характерну форму, є важливою ознакою кристалічності речовини. Однак, в реальних природніх умовах, достатньо великі монокристали зустрічаються надзвичайно рідко. Переважна більшість природних кристалічних тіл, є полікристалічними, тобто такими, що представляють собою сукупність величезної кількості, з’єднаних в єдине ціле дрібненьких монокристалічних фрагментів.
Певні уявлення про те, як утворюються полікристалічні тіла, можна отримати уважно спостерігаючи за початковим етапом кристалізації все того ж льоду. А цей етап полягає в тому, що поверхня води покривається тонкою, багатопроменевою льодяною кіркою. Власне фрагменти цієї кірки і є певними монокристалами льоду. Однак, в процесі кристалізації, ці окремі кристалики, поступово об’єднуються в цілісне тверде тіло. Тіло, в якому візуально визначити межі окремих кристаликів, практично не можливо. Ясно, що в такій ситуації визначити приналежність полікристалічного тіла до розряду кристалічних речовин, на підставі того, що їх монокристали мають певну форму, майже не можливо.
Щоправда, існує ще одна ознака кристалічності. З’ясовуючи суть цієї ознаки розглянемо наступну ситуацію. Припустимо, що у вашому розпорядженні є два хімічно однакових матеріали: монокристал кварцу (SiO2) і кварцове скло (SiO2). Різниця між цими матеріалами полягає в тому, що в монокристалі кварцу атоми кремнію і кисню, розташовані в певному періодично повторюваному порядку і тому він є кристалічним. В кварцовому ж склі, ті ж атоми розташовані без певного повторюваного порядку і тому воно є аморфним. Припустимо, що із цих матеріалів, шляхом механічної обробки виготовили дві однакові кулі. Запитується: чи можна відрізнити кулю кристалічну від кулі аморфної?
Звичайно, найбільш простим, ефективним та надійним способом вирішення цієї проблеми є нагрівання. Якщо в процесі нагрівання куля почне поступово розм’ягчатись, плавно перетворюючись на в’язку рідину, значить вона аморфна. Якщо ж куля при певній температурі почне плавитись – значить вона кристалічна.
А чи не можна обійтися без теплової руйнації куль? Виявляється, можна. І справа тут ось в чому. В кристалі, атоми (атоми, молекули, іони) розташовані в певному, повторюваному порядку. Одним з наслідків цього порядку є факт того, що монокристали анізотропні (від грец. anisos – не однаковий, tropos – напрямок), тобто такі, фізичні властивості яких в різних напрямках суттєво різні.
Ілюструючи суть того, що називають анізотропією кристалів, розглянемо кристалічну структуру графіту (мал.65б). В графіті, атоми вуглецю (карбону) розташовані певними шарами. При цьому, ті сусідні атоми які знаходяться в вершинах шестигранника, розташовані на відносно малих відстанях (0,14нм) і тому сили взаємодії між ними є відносно великими. Ті ж атоми які знаходіться в сусідніх шарах, розташовані на відносно великих відстанях (0,34нм) і тому сили взаємодії між цими атомами є відносно малими. В такій ситуації, один і той же монокристал графіту, в одному напрямку твердий, а в іншому – м’який. В одному напрямку добре проводить електричний струм, а в іншому – погано. В одному напрямку має блискучу поверхню, а в іншому – матову і т.д.
Якщо ж говорити про монокристал кварцу, то йому притаманна яскраво виражена анізотропія п’єзоефекту. Це означає, що при певній направленій деформації кристалу, між його відповідними, взаємно протилежними поверхнями, виникає певна електрична напруга. І навпаки – при подачі на ці поверхні електричної напруги, відбувається відповідна деформація кристалу. Тому, якщо під дією змінної електричної напруги, куля почне вібрувати, значить вона виготовлена із кристалічного кварцу. А якщо ні – з аморфного скла.
Втім, анізотропія властивостей, притаманна лише монокристалам. Адже в полікристалічних тілах, окремі монокристали орієнтовані хаотично, і тому, результуючі властивості таких тіл в усіх напрямках є усереднено однаковими. А це означає, що якщо ваша куля є полікристалічною, то фактично єдиним доступним способом відрізнити її від кулі аморфної є метод нагрівання.
Узагальнюючи вище сказане, можна дати наступне визначення. Кристалічними називають такі тверді речовини, структурні одиниці яких розташовані в певному періодично повторюваному порядку. Результатом цього внутрішнього порядку є наступні властивості кристалів:
1. Всі хімічно однорідні кристалічні речовини, мають певну температуру плавлення (плавлення, сублімації чи хімічної руйнації).
2. Монокристали мають певну геометричну форму, яка певним чином відображає параметри відповідної кристалічної решітки.
3. Монокристали, анізотропні, тобто такі, фізичні властивості яких в різних напрямках суттєво різні.
Говорячи про внутрішній устрій того чи іншого кристалічного матеріалу, потрібно мати на увазі, що одні і ті ж атоми можуть бути упакованими по різному. При цьому, хімічно однакові речовини можуть мати суттєво різні, іноді діаметрально протилежні властивості. Наприклад, важко повірити, що надтвердий, міцний, крихкий, прозорий, струмонепровідний та надкоштовний алмаз і м’який, не міцний, не крихкий, не прозорий, струмопровідний та дешевий графіт, виготовлені із одних і тих же атомів – атомів вуглецю (карбону). І тим не менше, це дійсно так. Просто в алмазі і графіті, атоми вуглецю упаковані по різному.
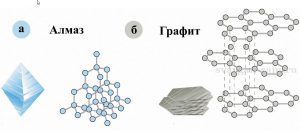
Мал.65. Алмаз і графіт – класичний приклад того, як при різній упаковці одних і тих же атомів, утворюються речовини з діаметрально протилежними властивостями.
Здатність тіл за різних обставин мати різні кристалічні структури, називають поліморфізмом (від грец. polymorphos – багатоликий, багатогранний). Поліморфізм притаманний не лише вуглецю. Більшість хімічно простих речовин, можуть перебувати в декількох кристалічних модифікаціях, кожній з яких відповідає певний інтервал тисків та температур. Наприклад, за нормального атмосферного тиску, але в різних температурних інтервалах, залізо може перебувати в чотирьох, суттєво різних кристалічних модифікаціях. Втім, ситуації при яких в одному і тому ж температурному інтервалі, речовина стабільно перебуває в різних кристалічних модифікаціях зустрічаються рідко.
Контрольні запитання.
1. Чи є наявність температури плавлення, безумовною ознакою кристалічності речовини?
2. Чи існують безумовно кристалічні речовини які не мають певної температури плавлення?
3. Відомо, що процес плавлення відбувається з поглинанням енергії і що при цьому температура речовини залишається незмінною. На що витрачається надана тілу енергія? Як змінюється при цьому кінетична та потенціальна енергія молекул?
4. Лід і вода мають температуру 0ºС. Потенціальна енергія яких молекул більша? Чому?
5. Які фактори впливають на геометричну форму монокристала?
6. Назвіть ознаки кристалічності речовини.
7. Що таке поліморфізм? Наведіть приклади.
8. Поясніть, чому монокристали анізотропні, а полікристали – ізотропні?
§21. Види кристалічних структур.
За характером тих сил, що діють між частинками кристалу та за назвами цих частинок, розрізняють чотири види кристалічних структур:\
− іонна структура,
− атомна структура,
− молекулярна структура,
− металічна структура.
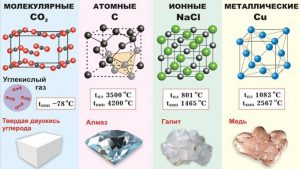
Мал.66. Основні види кристалічних структур.
Гранично стисло описуючи ці структури можна сказати наступне.
Іонна структура – це така кристалічна структура, в вузлах якої знаходяться позитивні та негативні іони відповідної речовини, між якими діють сили іонного зв’язку. Іонний зв’язок – це такий електромагнітний зв’язок, який існує між позитивними та негативними іонами і основною складовою якого є сили електростатичної взаємодії. Іонну структуру мають ті кристалічні речовини які в хімії називаються солями (NaCℓ; CuSO4; AgNO3; …) та основами (NaOH; Cu(OH)2; AgOH; …).
З’ясовуючи загальний устрій іонних кристалів та суть іонного зв’язку, доречно згадати базові фізико-хімічні властивості атомів. А за цими властивостями, все різноманіття атомів можна розділити на три групи: метали, неметали та інертні гази.
Металами називають ті атоми які схильні легко віддавати валентні електрони (електрони зовнішніх енергетичних рівнів) та перетворюватись при цьому на відповідні позитивні іони. Наприклад, атом натрію, на зовнішньому енергетичному рівні має один валентний електрон. Цей електрон слабко утримується ядром атома і тому легко відривається від нього. При цьому атом перетворюється на відповідний позитивний іон: Na0 – e– → Na+. Близько 80% тих атомів що містяться в таблиці хімічних елементів – це атоми металів.
Неметалами називають ті атоми, які схильні приєднувати до себе надлишкові валентні електрони та перетворюватись при цьому на відповідні негативні іони. Наприклад, атом хлору на зовнішньому енергетичному рівні має сім валентних електронів і як будь який неметал, прагне до того, щоб цих електронів було вісім. Тому, за першої ліпшої нагоди, атом хлору приєднує до себе один додатковий електрон і стає відповідним негативним іоном: Сℓ0 + е– → Сℓ–
Яскраво виражених неметалів (окислювачів) небагато: фтор (F), кисень (О), хлор (Сℓ), азот (N), бром (Вr). Однак на базі цих атомів (головним чином кисню) можуть утворюватись стійкі цілісні групи, які мають потужні окислювальні властивості. Це означає, що такі групи атомів, при першій ліпшій нагоді, приєднують до себе певну кількість електронів і перетворюються на відповідні негативні іони:
SO40 + 2e– → SO42– ;
NO30 + e– → NO3– ;
OH0 + e– → OH– .
Інертними називають ті атоми які не схильні а ні віддавати свої валентні електрони, а ні приєднувати до себе додаткові. Це означає, що інертні атоми (He, Ne, Ar, Kr, Xe, Rn) не приймають участі в хімічних реакціях і не утворюють жодних хімічних сполук.
Зважаючи на вище сказане, можна стверджувати, що при зустрічі атома металу з атомом (групою атомів) активного окислювача, певна кількість електронів переходить від металу до окислювача. При цьому утворюється пара різнойменних іонів. Власне ці іони і утворюють ту кристалічну структуру яка називається іонною.
Na → e → Cℓ → Na+ Cℓ– Na → e → OH → Na+ OH–
Cu →2e→ SO4 → Cu2+ SO42– Cu → 2e → (OH)2 → Cu2+ (OH)22–
Ag → e → NO3 → Ag+ NO3– Ag → e → OH → Ag+ OH–
. 
Фізична суть іонного зв’язку полягає в наступному. Загально відомо, що різнойменні заряди притягуються, а однойменні – відштовхуються. А це означає, що в суміші позитивних і негативних іонів, кожний позитивний іон прагне оточити себе негативними іонами і навпаки. Реалізацією цих прагнень і є іонна кристалічна структура. Зазвичай в іонній кристалічній структурі позитивні та негативні іони розташовуються таким чиним, що утворюють просту кубічну решітку. Наприклад, в кристалі хлориду натрію (NaCℓ), кожний позитивний іон натрію оточений шістьма рівновіддаленими негативними іонами хлору. А кожний іон хлору, оточений шістьма рівновіддаленими іонами натрію (мал.67).
Іонні кристали є крихкими, мають відносно не велику міцність та твердість. Більшість з них добре розчиняються у воді. Розчини та розплави іонних кристалів, добре проводять електричний струм. При цьому самі іонні кристали струм не проводять.
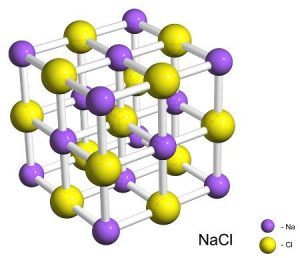
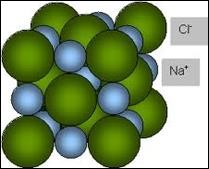
Мал.67. Кристалічна решітка хлориду натрію: а) кулестержнева модель; б) масштабна модель.
Атомна структура – це така кристалічна структура, в вузлах якої розташовані атоми відповідної речовини, між якими діють сили ковалентного зв’язку. Ковалентний зв’язок – це такий електромагнітний зв’язок, який існує між електронейтральними атомами і суть якого полягає в тому, що ці атоми інтенсивно обмінюються валентними електронами. При цьому, кожний атом обмінюється електронами лише з певною строго визначеною групою сусідніх атомів. Потрібно зауважити, що ковалентний зв’язок, є тим хімічним зв’язком за рахунок якого утворюються найміцніші молекули. Власне молекула, це і є хімічно обособлена група атомів об’єднаних ковалентним зв’язком. Наприклад, два атоми водню, інтенсивно обмінюючись валентними електронами об’єднуються в молекулу Н2; атом хлору обмінюючись валентними електронами з атомом водню утворює молекулу НСℓ; атом кисню, обмінюючись валентними електронами з двома атомами водню, утворює молекулу Н2О; атом азоту обмінюючись валентними електронами з трьома атомами водню утворює молекулу NН3 і т.д.
а)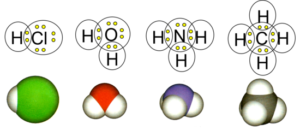 б)
б)
Мал.68. В молекулі певна, обмежена група атомів обособлюються між собою; в атомній кристалічній структурі, всі атоми об’єднуються в єдине ціле.
За рахунок ковалентного зв’язку, утворюються не лише найміцніші молекули, а й найміцніші кристалічні структури. Атомну структуру мають алмаз, корунд, граніт, пісок, коштовне та некоштовне каміння, тощо. На відміну від молекул в яких певна обмежена група атомів обособлюється між собою, в атомній кристалічній структурі, вся сукупність наявних атомів монокристалу, послідовно взаємодіючи один з одним утворюють єдине ціле, а по суті величезну мега молекулу. Наприклад атом вуглецю має чотири валентних електрони. А за законами квантової фізики, на зовнішньому енергетичному рівні, таких електронів має бути вісім. В такій ситуації атом вуглецю розташовується таким чином, щоб постійно обмінюватись валентними електронами з чотирма сусідніми атомами. А ті, в свою чергу, обмінюються електронами з своїми сусідами і т.д. (мал.68б). При цьому, між всією сукупністю наявних атомів утворюються міцні ковалентні зв’язки, які в сукупності і формують відповідну атомну кристалічну структуру, структуру алмазу.
Атомні кристали мають високу механічну міцність та надзвичайно високу твердість. Вони не розчиняються у воді, не проводять електричний струм, мають високу температуру плавлення.
Потрібно зауважити, що в атомних та іонних кристалах, поняття «молекула» втрачає сенс. Адже в цих кристалах по суті не існує тих хімічно обособлених груп атомів, які можна було б назвати молекулами. Тому ви маєте розуміти, що формули SiO2, Aℓ2O3, NaCℓ, CuSO4, AgNO3, тощо, вказують лише на те, з яких атомів (груп атомів) складається відповідна кристалічна структура і в яких співвідношеннях ці атоми зустрічаються в ній.
Металічна структура – це така кристалічна структура, в вузлах якої розташовані атоми металів, між якими діють сили металічного зв’язку. Металічний зв’язок – це такий електромагнітний зв’язок, який існує між атомами металів і суть якого полягає в тому, що ці атоми постійно обмінюються валентними електронами. При цьому, кожен атом почергово обмінюється валентними електронами з всією сукупністю сусідніх атомів. Металічну структуру мають всі метали.
За своєю фізичною природою, металічний зв’язок дуже схожий на ковалентний. Як і при ковалентному зв’язку, атоми металів постійно обмінюються валентними електронами і за рахунок цього обміну, об’єднуються у відповідну кристалічну структуру. Але, якщо при ковалентному зв’язку, певний атом взаємодіє з обмеженою кількістю чітко визначених сусідів, то при металічному зв’язку, кожен атом почергово взаємодіє (обмінюється електронами) з усіма сусідніми атомами. В такій ситуації, ті валентні електрони які забезпечують взаємодію атомів металу, постійно переміщуючись від атома до атома, можуть рухатись в будь якому напрямку. При цьому, за відсутності зовнішньої електричної напруги, рух електронів є хаотичним. За наявності ж такої напруги, цей рух стає хаотично-упорядкованим. Власне упорядковану складову цього руху і називають електричним струмом в металах.
Різноманіття металів таке велике, що серед них є як надміцні так і не надто міцні; як тверді так і не надто тверді; як тугоплавкі так і такі, що плавляться при мінусових температурах. Але от що дійсно об’єднує всі метали, так це їх висока електропровідність. Крім цього, всі метали мають високу теплопровідність та низьку теплоємність.
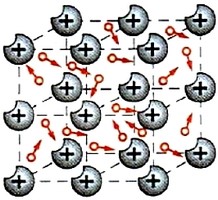
Мал.69. В металічній структурі, кожен атом металу обмінюється валентними електронами з усією сукупністю сусідніх атомів.
Молекулярна структура – це така кристалічна структура, в вузлах якої знаходяться молекули відповідної речовини, між якими діють сили дипольного або водневого зв’язку. Дипольний зв’язок – це такий електромагнітний зв’язок, з яким молекули-диполі взаємодіють між собою як відповідні електричні системи. Водневий зв’язок – це такий електромагнітний зв’язок, з яким позитивно іонізовані атоми водню взаємодіють з негативно іонізованими атомами сусідніх молекул. Молекулярну структуру має лід, нафталін, органічні сполуки та ті хімічно прості речовини, які за звичайних умов є рідкими або газоподібними.
Детальніше пояснюючи суть дипольного та водневого зв’язків, можна сказати наступне. Дослідження показують, що в об’ємі більшості молекул, електричні заряди розподілені нерівномірно, і що тому ці молекули представляють собою певні дипольні системи. Диполь (від «два полюси») – це цілісна система двох, близько розташованих, рівних за величиною і протилежних за знаком електричних зарядів. Наприклад, в молекулі води (мал.70) атом кисню і два атоми водню розташовані не на одній прямій. При цьому кисень, будучи надзвичайно потужним окислювачем, сильно іонізує атоми водню. А це означає, що ті валентні електрони які забезпечують ковалентний зв’язок між воднем і киснем, левову частину часу перебувають біля атому кисню. (В подібних ситуаціях говорять, що ковалентний зв’язок є сильно поляризованим). Результатом такого розташування атомів та поляризованості ковалентного зв’язку, є факт того, що в молекулі води, електричні заряди розподілені нерівномірно, а вона сама представляє собою яскраво виражений диполь.
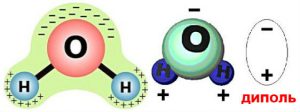
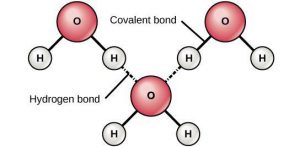
Мал.70. а) В електричному сенсі молекула води є диполем; б) при водневому зв’язку, позитивно іонізовані атоми водню однієї молекули, взаємодіють з негативно іонізованими молекулами кисню іншої молекули.
В тій чи іншій мірі, дипольні властивості мають практично всі взаємодіючі молекули. Навіть ідеально симетричні молекули (Н2, О2, N2, тощо) в процесі взаємодії з іншими молекулами поляризуються і стають дипольними.
Знаючи, що різнойменні заряди притягуються, а однойменні – відштовхуються, не важко збагнути, що молекули-диполі взаємодіють між собою і що ці взаємодії мають електричну природу. Власне ці взаємодії і називаються дипольними або силами Ван дер Ваальса (Йоханнес Ван дер Ваальс (1835-1923) голландський фізик, який дослідив і пояснив слабкі міжмолекулярні взаємодії). Дипольні взаємодії (сили Ван дер Ваальса) відносяться до слабких електромагнітних взаємодій. І тому, побудовані на їх основі молекулярні кристали є такими, що мають малу механічну міцність, низьку температуру плавлення і легко сублімують (випаровуються).
Серед тих кристалічних речовин які мають молекулярну структуру, особливе місце посідає лід. Чи задумувались ви над тим, чому відносно легкі молекули води (m0 = 18а.о.м.) за звичайних умов, конденсуються в рідину, а то й в достатньо міцний кристалічний лід, тоді як інші, більш масивні молекули (О2, N2, CO2, H2S, Cℓ2, тощо) за тих же умов є газоподібними? Ви можете сказати, що молекули води мають яскраво виражені дипольні властивості і що тому між ними діють відносно великі сили Ван дер Ваальса. Певною мірою це правда. Однак розрахунки показують, що якби молекули води об’єднували лише дипольні взаємодії, то вода б плавилась при температурі –90ºС, а кипіла при –80ºС.
Секрет надзвичайних властивостей води полягає в тому, що між її молекулами, окрім сил дипольного зв’язку, діють сили так званого водневого зв’язку. Суть водневого зв’язку полягає в наступному. Атом водню відрізняється від інших тим, що при втраті валентного електрона фактично перетворюється на оголене атомне ядро. В такій ситуації іон водню (Н+) схильний глибоко проникати в електронні оболонки інших атомів та взаємодіяти з їх електронами. В молекулі води, атоми водню формально не є позитивними іонами. Однак фактично є дуже схожими на них. Тому ці, сильно іонізовані атоми, схильні взаємодіяти з електронами сусідніх атомів кисню та встановлювати з ними відносно міцні зв’язки (мал.70б). Власне ці взаємодії та їм відповідні зв’язки і називають водневими зв’язками.
За своїми силовими параметрами, водневий зв’язок в десятки разів сильніший за дипольний. І тому ті молекулярні кристали в яких суттєво проявляється цей зв’язок є відносно міцними. Наочним прикладом такої міцності є лід. До числа тих речовин в яких суттєву роль відіграють водневі зв’язки відносяться практично всі органічні сполуки: вуглеводні, спирти, прості та складні ефіри, органічні кислоти, тощо.
Завершуючи розмову про види кристалічних структур, зауважимо, що поділ цих структур на іонні, атомні, металічні та молекулярні є досить умовним. Умовним бодай тому, що в реальних кристалах часто поєднуються різні види зв’язків. Наприклад, в кристалі графіту, атом вуглецю трьома валентними електронами утворює ковалентні зв’язки, а четвертим – металічний зв’язок. Крім цього, досить умовним є сам поділ зв’язків на іонні, ковалентні, металічні, водневі та дипольні. Адже в реальних кристалах часто-густо іонний зв’язок важко відрізнити від сильно поляризованого ковалентного зв’язку, сильно поляризований ковалентний – від водневого, водневий – від іонного, іонний – від дипольного, а ковалентний – від металічного. І це закономірно. Адже всі ці зв’язки, фактично є проявами одних і тих же електромагнітних взаємодій.
Контрольні запитання.
1. Поясніть чим атоми металів відрізняються від атомів неметалів?
2. Як ви думаєте, чому іонні кристали не проводять електричний струм, а їх розчини і розплави – проводять?
3. В чому суть ковалентного зв’язку?
4. Які загальні властивості тих матеріалів які мають іонну структуру?
5. Які загальні властивості тих матеріалів які мають атомну структуру?
6. Чи правильне твердження: кристали оксиду кремнію складаються з молекул SiO2? Поясніть.
7. Чим металічний зв’язок схожий на ковалентний і чим від нього відрізняється?
8. Які загальні властивості тих матеріалів які мають металічну структуру?
9. Чому легкі молекули води кристалізуються при 0°С, тоді як важкі молекули кисню – лише при –219°С?
10. Чому поділ кристалічних структур на іонні, атомні, металічні та молекулярні, є умовним?
§22. Аморфні тіла та їх властивості.
Аморфні тіла не є такими багаточисельними як тіла кристалічні. До числа аморфних, відносять різноманітні види скла, різноманітні смоли, бурштин, каніфоль, сургуч, цукровий льодяник, різноманітні полімерні матеріали.

Мал.71. Деякі приклади аморфних тіл.
Слово «аморфний» в перекладі з грецької означає «той що не має певної форми». На перший погляд, така назва не є надто прийнятною для позначення тих об’єктів що є твердими, а отже такими які мають певний незмінній об’єм та певну незмінну форму. Однак з іншого боку, аморфні речовини тим і відрізняються від кристалічних, що для них, дійсно нема певної характерної форми, наприклад такої як форма куба для кам’яної солі, форма октаедра для алмазу, чи форма шестигранної призми для кварцу. Умовно кажучи, якщо аморфну речовину розчинити, а потім розчинник випарувати, то на дні відповідної посудини не сконденсуються певні куби, октаедри чи шестигранні призми, а залишиться однорідний «млинець» який матиме форму дна посудини.
Аморфними називають такі умовно тверді речовини (Еп ˃ Ек; V = const; Ф = const), структурні одиниці яких розташовані без певного, періодично повторюваного порядку. Говорячи про те, що аморфні тіла є умовно твердими, мають на увазі факт того, що для аморфних тіл не існує тієї чітко визначеної температурної межі, яка розділяє їх тверду та рідку фази. Дійсно. Якщо взяти аморфне тіло, наприклад звичайне скло і поступово нагрівати його, то починаючи приблизно з 400ºС скло почне поступово розм’ягчатись та перетворюватись на все менш і менш в’язку рідину. При цьому ніхто не зможе з впевненістю сказати, на якому етапі нагрівання, скло перестало бути твердим і стало рідким. Не зможе тому, що аморфні тіла не мають певної температури плавлення. Аморфні тіла не плавляться, а розм’ягчуються, не кристалізуються, а тверднуть.
Твердження про те, що частинки аморфного тіла розташовані хаотично, не є безумовно правильним. Адже насправді, частинки аморфної речовини розташовані не хаотично, а в певній послідовності. Наприклад і в кристалічному кварці (SiO2) і в аморфному кварцевому склі (SiO2) кожен атом кремнію зв’язаний з чотирма атомами кисню, а кожен атом кисню – з двома атомами кремнію. Різниця лише в тому, що в кристалічному кварці, ці атоми розташовані з певною, строго визначеною періодичністю (мал.72а), а в аморфному кварцевому склі, така періодичність відсутня (мал.72б). Тому, характеризуючи розташування частинок аморфної речовини, доречно говорити не про хаотичність цього розташування, а про відсутність певного періодичного порядку в ньому.
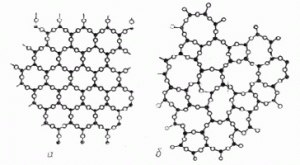
Мал.72. Схема розташування атомів кремнію (•) та атомів кисню (º) в структурі а) кристалічного кварцу, б) аморфного кварцевого скла.
В науковій літературі, той строго визначений, періодичний порядок в розташуванні частинок, який існує в кристалічних тілах, прийнято називати дальнім порядком. А ту повторюваність, що існує в аморфних тілах і яка не характеризується певною строго визначеною періодичністю, називають ближнім порядком. При цьому, кристалічними називають такі тверді тіла в яких існує дальній порядок в розташуванні частинок, а аморфними – ті тверді тіла в яких існує ближній порядок розташування частинок.
Одним з прямих наслідків відсутності періодичного порядку в розташуванні частинок є те, що аморфні тіла перетворюються на відповідну рідину не в процесі плавлення, а в процесі поступового розм’ягчування. І це закономірно. Адже при неупорядкованому розташуванні частинок, ті зв’язки що існують між ними не є рівноміцними. При цьому, як найміцніші так і найслабші зв’язки є хаотично розкиданими по всьому об’єму аморфного тіла. Ясно, що в процесі нагрівання, спочатку руйнуватимуться найбільш слабкі зв’язки, потім – менш слабкі і т.д. А це означає, що в процесі нагрівання, тверде аморфне тіло буде перетворюватись на відповідну рідину не при певній строго визначеній температурі, а в певному температурному інтервалі, межі якого є розмитими та досить умовними.
На практиці, тією умовною температурною межею, що відділяє явно твердий стан аморфного тіла, від того стану де проявляються суттєві ознаки надв’язкої рідини, є температура нагрівостійкості. Наприклад для звичайного віконного скла, температура нагрівостійкості становить 400ºС. Це означає що при температурах нижчих за 400ºС, скло знаходиться в явно твердому стані. А при температурах вищих за 400ºС, воно поступово набуває ознак надв’язкої рідини.
Дослідження показують, що одна і та ж речовина, може бути як аморфною так і кристалічною. Наприклад кварцове скло і кварцовий пісок, це аморфна та кристалічна різновидності однієї і тієї ж хімічної речовини – оксиду кремнію (SiO2). І потрібно зауважити, що за певних умов, кристалічна речовина може ставати аморфною, а аморфна – кристалічною. З’ясовуючи суть цих умов, розглянемо ті процеси, що відбуваються при плавленні та наступному охолодженні кристалічного кварцу.
В процесі плавлення кристалічного кварцу, руйнується не лише періодична упорядкованість в розташуванні його атомів, а й змінюється характер зв’язків між ними. Якщо в кристалічному кварці, атоми кремнію та кисню об’єднувались ковалентними зв’язками, то в процесі плавлення ці зв’язки руйнуються. Результатом цієї руйнації є утворення відповідної рідини, що складається з іонів SiO2+ та О2–, між якими діють сили іонного зв’язку. А оскільки ці сили є достатньо потужними, то і відповідна рідина має достатньо велику в’язкість.
При відносно швидкому охолодженні кварцової рідини, ті іонні зв’язки що діють між її частинками, стають міцними ковалентними зв’язками, а відповідна рідина стає твердою. А оскільки в’язкість рідини була великою, а рухливість частинок відповідно малою, то ці частинки фіксуються в тих положеннях, що є характерними для рідини. Таким чином, в процесі відносно швидкого охолодження, в’язка кварцова рідина набуває явних ознак твердого тіла (Ф=const, V=const, Еп ˃ Ек), при цьому внутрішній устрій цього тіла залишається таким, яким він був у відповідної рідини.
Аналізуючи вище наведені факти, можна виділити ті основні чинники, які визначально впливають на те, стане дана рідина аморфним тілом чи не стане. До числа цих чинників відносяться. 1) Та рідина яка може стати аморфним твердим тілом, повинна мати достатньо велику в’язкість. 2) Охолодження рідини має бути достатньо швидким. 3) Ті структурні одиниці з яких складається рідина мають бути «неповороткими».
Зазвичай, рідка фаза хімічно простих речовин, має відносно малу в’язкість, а їх структурні одиниці є такими рухливими, що дуже швидко вишиковуються в енергетично доцільному порядку. Тому подібні речовини дуже рідко бувають аморфними. Однак при надшвидкому охолоджені, аморфними можуть бути навіть метали.
В деяких наукових джерелах, факт схожості внутрішнього устрою аморфних та рідких речовин, вважають достатньою підставою для того, щоб аморфні тіла віднести до розряду рідин. Що ж, ми не втомлюємся повторювати, Природа – це єдиний цілісний організм і тому, будь який класифікаційний поділ її об’єктів є досить умовним. І в цьому сенсі поділ речовин на тверді та рідкі не є винятком. Тому аморфні тіла можна вважати такими, що займають проміжне місце між тілами безумовно твердими (кристалічними) та безумовно рідкими. Однак, якщо говорити про ті аморфні тіла, температура яких значно менша за температуру нагрівостійкості, то за своїми визначальними ознаками (Ф=const, V=const, Еп ˃ Ек) вони є очевидно твердими.
Дослідження показують, що зазвичай аморфний стан хімічно простих речовин є метастабільним, тобто енергетично нестійким. Ця метастабільність пояснюється тим, що структурні одиниці аморфного тіла розташовані енергетично не оптимальним чином. А це означає, що у відповідності з законами Природи (зокрема тим, який прийнято називати принципом мінімуму), частинки аморфного тіла прагнуть вишикуватись в енергетично доцільному порідку. Результатом цих прагнень є те, що початково аморфне тіло, рано чи пізно стає кристалічним. Наприклад, в процесі достатньо швидкого охолодження високотемпературного насиченого цукрового сиропу, утворюється твердий аморфний льодяник (аморфний цукор). Якщо ж цей аморфний льодяник залишити в спокої, то через лічену кількість місяців він зацукриться, тобто перетвориться на сукупність окремих кристаликів цукру.
Подібним чином ведуть себе й інші аморфні речовини, зокрема скло. Однак тривалість кристалізації скла, вимірюється не місяцями, а тисячоліттями. Результатом подібної кристалізації є поступове перетворення склоподібних вулканічних лав, на кристалічний граніт, базальт, пісок, тощо. Власне факт того, що в природних умовах аморфні тіла зустрічаються рідко, є прямим наслідком того, що такі тіла поступово кристалізуються.
Говорячи про загальні властивості аморфних тіл, потрібно сказати і про те, що ці тіла є ізотропними, тобто такими, фізичні властивості яких в усіх напрямках однакові. І не важко збагнути, що ізотропність аморфного тіла, є прямим наслідком того, що частинки цього тіла розташовані без певного періодичного порядку.
Узагальнюючи вище сказане, можна дати наступне визначення. Аморфними називають такі умовно тверді речовини, структурні одиниці яких, розташовані без певного періодично повторюваного порядку. Результатом відсутності цього внутрішнього порядку є наступні зовнішні ознаки аморфних тіл:
1. Аморфні тіла не мають певної температури плавлення. Вони не плавляться, а розм’ягчуються, не кристалізуються, а тверднуть.
2. Аморфні тіла та будь які їх фрагменти не мають певної характерної форми.
3. Аморфні тіла ізотропні, тобто такі, фізичні властивості яких в усіх напрямках однакові.
На завершення додамо, що поділ твердих речовин на аморфні та кристалічні є досить умовним. Умовним бодай тому, що величезна кількість хімічно тотожних речовин, можуть бути як аморфними так і кристалічними. Якщо ж врахувати факт того, що з плином часу аморфні речовини поступово кристалізуються, то стане очевидним, що на певних етапах цієї кристалізації, однозначно визначити стан аморфно-кристалічного тіла практично не можливо.
Контрольні запитання.
1. Чому аморфні тіла прийнято вважати умовно твердими?
2. Чи є безумовно правильним твердження: частинки аморфного тіла розташовані хаотично? Чому?
3. Чому аморфні тіла не плавляться, а розм’ягчуються?
4. Яку температуру називають температурою нагрівостійкості?
5. Чому в деяких наукових джерелах, аморфні тіла відносять до розряду рідин?
6. Дайте загальну характеристику аморфних тіл.
7. Чому з плином часу, аморфні тіла поступово кристалізуються?
8. Що означає твердження: аморфні тіла ізотропні?
9. Чому поділ речовин на тверді та рідкі, на кристалічні та аморфні, є умовним?
§23. Фази речовини. Фазові переходи.
Нагадаємо, агрегатний стан речовини це такий фізичний стан даної речовини, який характеризується певним набором визначальних властивостей (зокрема наявністю або відсутністю форми та об’єму) і перехід до якого супроводжується стрибкоподібною зміною багатьох, в тому числі і визначальних властивостей цієї речовини, а також стрибкоподібною зміною потенціальної енергії її молекул. Розрізняють три агрегатні стани речовини: твердий, рідкий та газоподібний.
Ми вже говорили про те, що агрегатний стан та йому відповідні фізичні властивості речовини, визначально залежить від її температури та зовнішнього тиску. Цю залежність можна представити у вигляді відповідного графіку, який прийнято називати діаграмою стану речовини або фазовою діаграмою. Діаграма стану речовини будується на основі експериментальних досліджень і є індивідуальною для кожної конкретної речовини. При цьому статистично усереднений вигляд цієї діаграми є наступним.
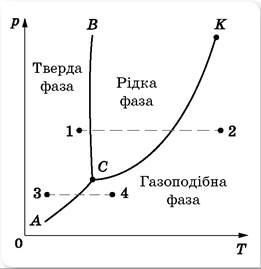
Мал.73. Статистично усереднена фазова діаграма хімічно простої речовини.
В багатьох відношеннях, класифікаційний поділ фізичних станів речовини на її агрегатні стани є недосконалим. Наприклад за побутових умов, звичайне віконне скло (аморфний стан SіО2) є очевидно твердою речовиною. І це при тому, що у відповідності з вище наведеним визначенням терміну агрегатний стан речовини, явно тверде при температурі 20°С і явно рідке при температурі 800°С скло, потрібно вважати одним і тим же агрегатним станом скла. Адже в аморфній речовині, перехід від явно твердого стану до явно рідкого і навпаки, відбувається без будь яких стрибкоподібних змін її властивостей та потенціальної енергії молекул. А це означає, що у відповідності з загально прийнятим визначенням, явно тверду та явно рідку різновидності аморфної речовини, потрібно вважати одним і тим же агрегатним станом цієї речовини, при цьому невідомо яким.
Крім цього, в межах одного і того ж агрегатного стану, одна і та ж речовина, може мати суттєво різні властивості. Наприклад, фізичні властивості алмазу і графіту – діаметрально протилежні. Алмаз, це міцний, крихкий, надзвичайно твердий, прозорий матеріал, який не проводить електричний струм. Натомість графіт, це неміцний, пластичний, м’який, непрозорий матеріал, який проводить електричний струм. І тим не менше, згідно з вище наведеним визначенням, алмаз і графіт є одним і тим же агрегатним станом однієї і тієї ж речовини – твердим (кристалічним) станом вуглецю.
Зважаючи на вище сказане, не важко передбачити, що в науковій практиці мають існувати й інші класифікаційні схеми, які дозволяють більш детально розрізняти суттєво різні стани речовини. І такі схеми дійсно існують. В сучасній науці, наряду з поняттям агрегатний стан речовини, застосовують і більш широке поняття – фаза речовини.
Фазою речовини називають такий фізичний стан даної речовини, який характеризується певним набором фізичних властивостей і перехід до якого супроводжується стрибкоподібною зміною бодай однієї з цих властивостей.
Ясно, що агрегатні стани речовини, одночасно є і відповідними фазами цієї речовини. Наприклад лід, рідка вода та водяний пар, це відповідно тверда, рідка та газоподібна фази води. Не менш очевидним є і те, що поняття «фаза речовини» не є синонімом поняття «агрегатний стан речовини». Адже для того щоб речовина перейшла з одної фази в іншу, потрібна стрибкоподібна (якісна) зміна не багатьох, а бодай однієї з властивостей цієї речовини. А це означає, що застосовуючи поняття фаза, можна класифікувати не лише переходи речовини з одного агрегатного стану в інший, а й будь які стрибкоподібні зміни, що відбуваються в межах одного і того ж агрегатного стану. Наприклад, класифікувати графіт і алмаз, як дві різні фази кристалічного вуглецю.
Процес переходу речовини з одного фазового стану до іншого, називають фазовим переходом. Ясно, що до числа фазових переходів відносяться і ті процеси, при яких змінюється агрегатний стан речовини і які називаються плавленням, кристалізацією, пароутворенням, конденсацією, сублімацією та десублімацією. Але більшість відомих фазових переходів відбувається в межах одного й того ж агрегатного стану. Наприклад, в межах твердого (кристалічного) стану заліза, та в процесі його нагрівання від звичних для нас температур до температури плавлення, відбуваються чотири фазові переходи. Стисло описуючи ці переходи можна сказати наступне.
За звичайних температурних умов, атоми заліза упаковані у вигляді об’ємноцентрованого куба, довжина граней якого 0,286нм (мал.74). При температурі 768ºС (цю температуру називають точкою Кюрі) відбувається перший фазовий перехід кристалічного заліза. Цей перехід не супроводжується суттєвими змінами в розташуванні атомів і характеризується стрибкоподібною зміною лише однієї властивості заліза, яку називають феромагнетизмом: при t ˂ 768ºС – залізо феромагнітне, а при t ≥ 768ºС – залізо не феромагнітне.
При температурі 910ºС з залізом відбувається другий фазовий перехід. В процесі цього переходу кубічна об’ємноцентрована структура заліза змінюється на більш щільну кубічну гранецентровану структуру. Ця структура зберігається до температури 1390ºС. При цій температурі відбувається третій фазовий перехід заліза, в процесі якого розташування атомів знову змінюється: кубічна гранецентрована структура знову трансформується в кубічну об’ємноцентровану структуру, але вже з суттєво іншими параметрами базового куба (довжина граней куба 0,293нм). На кінець, при температурі 1539ºС відбувається четвертий фазовий (він же агрегатний) перехід кристалічного заліза, в процесі якого, залізо переходить з кристалічного стану в рідкий. Цей фазовий перехід називають плавленням. Відразу ж зауважимо, що в процесі охолодження заліза, при вище названих температурах відбуваються аналогічні, але зворотні фазові переходи.
Мал.74. Схема зміни кристалічної структури заліза в процесі його нагрівання.
Кожна фаза речовини характеризується певним набором фізичних властивостей та певними, чітко визначеними температурно тисковими межами свого існування. Ви можете запитати: «Якщо кожна кристалічна модифікація речовини, може існувати лише в своїй області тисків та температур, то чому ж різні модифікації однієї і тієї ж речовини, скажімо той же алмаз і графіть, співіснують в одних і тих же умовах?». Відповідаючи на це важливе запитання, можна сказати наступне. Дійсно. Кожній кристалічній фазі речовини відповідає своя, чітко окреслена область тисків і температур. А це означає, що виходячи за межі цієї області, відповідна структура має певним чином трансформуватись. Однак на практиці, в тих випадках, коли зовнішні умови змінюються достатньо швидко, часто буває так, що кристалічна структура, не встигнувши трансформуватись, опиняється в області «чужих» для неї умов. При цьому, якщо подібний перехід відбувається в процесі швидкого зниження температури, атоми речовини швидко втрачаючи енергію стають неспроможними до енергозатратної перебудови. В такій ситуації, стара кристалічна структура виявляється «замороженою» в нових, більш холодних умовах.
Класичним прикладом «замороженого» кристалу є алмаз. Алмаз, представляє собою кристалічну модифікацію вуглецю, яка формується при температурі в декілька тисяч градусів Цельсія і тиску в сотні тисяч атмосфер. При зниженні температури і тиску, алмаз має перетворюватись на графіт. Але, якщо зниження температури відбувається достатньо швидко, атоми вуглецю не встигнувши перебудуватись і втративши велику кількість енергії, виявляються в буквальному сенсі замороженими в нових, незвично холодних умовах.
В сучасному виробництві «замороження» потрібної кристалічної структури, забезпечує технологічний процес який називається гартуванням. Наприклад, шляхом гартування залізним деталям надають підвищеної твердості та зносостійкості. І справа тут ось в чому. При кімнатних температурах, атоми заліза утворюють так звану кубічну об’ємноцентровану решітку в якій кожен атом має 8 сусідів. Якщо ж температура заліза перевищує 910ºС, його атоми розташовуються щільніше і утворюють так звану кубічну гранецентровану решітку. За такого розташування, кожен атом заліза має 12 безпосередньо з ним контактуючих сусідів. Залізо з числом сусідів 8 є м’яким, а з числом сусідів 12 – твердим. Запитується. Чи можна залізо з більш щільним розташуванням атомів, примусити жити в незвичних для нього, але звичних для нас умовах? Виявляється – можна. Для цього відповідне залізо гартують.
Технологія гартування досить проста: залізну деталь розігрівають до потрібно високих температур (t ˃ 910ºС), а потім швидко опускають в холодну воду або іншу рідину. При цьому деталь охолоджується так швидко, що високотемпературна кристалічна структура виявляється «замороженою» в нових, більш холодних умовах.
Потрібно зауважити, що насправді, вище описаний метод гартування є придатним не для чистого заліза, а для певних сортів сталі, які представляють собою сплав заліза з певною кількістю (менше 1%) вуглецю. Наявність вуглецю, не лише певним чином зміцнює механічні властивості заліза, а й суттєво сповільнює процес трансформації його «твердої» кристалічної структури в «м’яку». Власне це і дозволяє гартувати сталь вище описаним простим методом.
Дослідження показують, що здатність речовини існувати в «чужих» для неї умовах, не є винятковим привілеєм кристалічних фаз. В тій чи іншій мірі, ця здатність притаманна всім фазовим станам речовини. Перенасичений пар, перегріта рідина, переохолоджена рідина, перенасичений розчин, все це приклади того, коли певна фаза речовини, опиняється в умовах, які за визначанням є умовами існування іншої фази. Причина подібних взаємо проникнень фаз полягає в наступному. Фазові переходи завжди починаються з появи зародків нової фази. При цьому, якщо ті фактори які сприяють появі цих зародків вдається нейтралізувати, то практично будь яку речовину можна примусити бути рідкою там, де вона має бути твердою, бути газоподібною там, де вона має бути рідкою і навпаки.
Що правда, більшість подібних станів є нестійкими та короткотривалими. Не випадково ці стани речовини називають метастабільними тобто нестійкими, нестабільними. Втім, в певних випадках, метастабільний стан речовини може виявитись цілком життєздатним. Наприклад, твердий стан аморфного тіла, це не що інше як метастабільний стан відповідної рідини: в процесі відносно швидкого охолодження, в’язкість рідини різко збільшується і її молекули виявляються «замороженими» в характерному для рідини безпорядку. При цьому даний метастабільний стан речовини виявляється достатньо стабільним та довговічним. Та як би там не було, а з плином часу атоми та молекули аморфної речовини вишиковуються в певному, енергетично доцільному порядку і відповідна речовина стає кристалічною.
Загальною ознакою більшості фазових переходів є те, що вони відбуваються з поглинанням або виділенням певної кількості енергії (теплоти фазового переходу). Такі переходи називаються фазовими переходами першого роду. До числа фазових переходів першого роду, окрім плавлення, кристалізації, пароутворення, конденсації, сублімації та десублімації, відносяться ті переходи які пов’язані з перебудовою структурного устрою речовини, в тому числі різноманітні перетворення однієї кристалічної модифікації в іншу. Наприклад, ті перетворення кристалічного заліза які відбуваються при температурах 910ºС і 1390ºС є фазовими переходами першого роду.
Але далеко не всі фазові переходи супроводжуються виділенням або поглинанням енергії. Існують і такі, що відбуваються без суттєвих змін в розташуванні частинок речовини та без виділення або поглинання суттєвої кількості енергії. Такі переходи називаються фазовими переходами другого роду. Наприклад та стрибкоподібна зміна властивостей заліза, що відбувається при температурі 768ºС і яка характеризується стрибкоподібною зміною магнітних властивостей заліза, є фазовим переходом другого роду. Фазові переходи другого роду мають складну квантово механічну природу, вивчення якої виходить за межі молекулярної фізики.
Оперуючи поняттям фаза речовини, можна більш детально класифікувати суттєво різні стани речовини. Однак і ця класифікаційна схема не є бездоганною. Скажімо, за цією схемою не можливо розрізнити твердий і рідкий стани аморфної речовини. Не можливо розділити стан пару і стан газу, стан газу і стан плазми, тощо. Що ж, дані факти в черговий раз підтверджують те, що різноманіття властивостей реальної природи набагато ширше за будь які класифікаційні схеми.
Контрольні запитання.
1. Чому поділ фізичних станів речовини на її агрегатні стани є недосконалим? Наведіть приклади.
2. Що називають фазою речовини? Чим фаза речовини відрізняється від її агрегатного стану?
3. Які фазові переходи і при яких температурах відбуваються в процесі нагрівання заліза?
4. Чи може певна фаза речовини існувати в «чужих» для неї умовах? За яких умов? Наведіть приклади.
5. В чому суть технології гартування?
6. Що називають фазовим переходом першого роду? Наведіть приклади?
7. Що називають фазовим переходом другого роду? Наведіть приклади?
8. Чи можна рідкий і твердий стан аморфного скла вважати: а) різними агрегатними станами скла? б) різними фазами скла? Чому?
9. Чи є поділ фізичних станів речовини на її фазові стани бездоганним? Чому?
§24. Фазові перетворення, як один з проявів закону переходу кількісних змін в якісні.
В Природі, окрім тих законів що мають точне кількісне вираження, діють і такі, які практично не можливо представити у вигляді певних кількісних співвідношень, а відповідно і певних математичних формул. Тим не менше, подібні закони є цілком об’єктивними, тобто такими що відображують реально існуючі закономірності розвитку Природи. Більш того, подібні закони є гранично загальними і такими що є справедливими не лише для тих процесів які відбуваються в неживій природі, а й для тих, що є суттю еволюційного розвитку живої матерії та соціальних систем.
До числа цих гранично загальних законів відноситься закон переходу кількісних змін в якісні. В цьому законі стверджується: будь які послідовно-поступові і на перший погляд не помітні кількісні зміни того чи іншого параметру системи, рано чи пізно призводять до таких стрибкоподібних або відносно плавних змін, в процесі яких система переходить до якісно нового стану.
Наприклад, ми говоримо про теплові процеси, тобто ті процеси що відбуваються при нагріванні (охолодженні) речовини і які пов’язані з тим, що відповідна речовина отримує (втрачає) певну кількість енергії. Припустимо, що в нашому розпорядженні є шматок льоду, температура якого –100ºС. Припустимо, що цьому льоду ми поступово надаємо певну контрольовану кількість енергії та фіксуємо ті зміни які відбуваються при цьому.
Отримуючи енергію, лід поступово нагрівається і його температура стає все вищою і вищою. Ось вона становить –100ºС, … –90ºС, …–80ºС, …–70ºС і т.д. Ми аналізуємо параметри льоду і констатуємо той факт, що в процесі нагрівання, ці параметри певним чином змінюються. Однак ці кількісні зміни не є такими, що кардинально впливають на якісний стан системи. Адже і при –100ºС, і при –70ºС, і при –10ºС, лід залишається льодом, тобто твердою речовиною яка характеризується певним набором визначальних властивостей.
Аналізуючи факт того, що в процесі нагрівання льоду від –100ºС до –1ºС, ми не помітили суттєвих змін його властивостей, логічно передбачити, що і в подальшому відповідна тенденція буде зберігатись, і що ми без особливих проблем нагріємо лід до +5ºС, +10ºС, чи скажімо до +40ºС. Та от дивина, коли температура льоду досягає позначки 0ºС, цей лід починає якісно змінюватись – перетворюватись на рідину. При цьому, щоб ми не робили, а нам не вдасться нагріти лід не те що на 10ºС, а бодай на 0,1ºС. Не вдасться до тих пір допоки лід не перейде до якісно нового стану – стану рідини.
Після того як система переходить до якісно нового стану, її подальше нагрівання знову призводить до підвищення температури та певних кількісних змін параметрів системи. Однак ці кількісні зміни не є такими, що змінюють загальний якісний стан системи. Адже і при +1ºС, і при +40ºС, і при +95ºС, вода залишається водою, тобто певною рідиною з відповідним набором визначальних властивостей.
Аналізуючи дану ситуацію, ми знову можемо передбачити, що наявна тенденція поступових кількісних змін властивостей рідкої води буде зберігатись і в подальшому. Однак, на певному етапі нагрівання (за нормального тиску при температурі 100ºС), ми будемо змушені констатувати факт того, що подальше збільшення температури води, стає не можливим без її переходу до якісно нового стану – стану пару.
Нагріваючи пар, ви неодмінно з’ясуєте, що до певної критичної температури (до t=374,2ºС), пар залишається паром, тобто такою газоподібною речовиною яку шляхом ізотермічного стиснення можна перетворити на відповідну рідину. Однак, як тільки температура пару перейде цю критичну межу, водяний пар неминуче набуде якісно нової властивості і стане газом, тобто такою газоподібною речовиною, яку шляхом ізотермічного стиснення не можливо перетворити на відповідну рідину.
Продовживши експеримент, ви неодмінно зафіксуєте факт того, що на певному етапі нагрівання, газ починає набувати якісно нових властивостей і перетворюватись на те, що прийнято називати плазмою. Що правда дане перетворення буде відбуватись не при певній строго визначеній температурі, а в певному температурному інтервалі. Однак це зовсім не означає, що в даному випадку закон переходу кількісних змін в якісні не працює. Просто на певних етапах якісні зміни відбуваються паралельно зі змінами кількісними.
Потрібно зауважити, що в процесі нагрівання системи, в даному випадку тієї речовини яка спочатку була льодом, потім водою, паром, газом і на кінець плазмою, ви будете фіксувати й інші якісні зміни цієї системи. Зокрема з’ясуєте факт того, що в процесі нагрівання, відповідна речовина випромінюватиме все більш і більш енергійні електромагнітні хвилі. І що ці хвилі спочатку будуть такими які прийнято називати радіохвилями, потім такими які називають інфрачервоним випромінюванням, потім такими які називають видимим світлом, потім – ультрафіолетовим випромінюванням, рентгенівським випромінюванням, гамма випромінюванням. Ви неодмінно з’ясуєте, що при певних надвисоких температурах (понад 106 ºС) ядра атомів водню почнуть об’єднуватись в ядра атомів гелію, і що при цьому буде виділятись величезна кількість енергії. Що при ще більш високих температурах, ядра атомів гелію будуть об’єднуватись в ядра атомів вуглецю та кисню. А ті в свою чергу – в ще більш важкі атомні ядра.
Аналізуючи ті події які відбуваються при нагріванні речовини, ви неодмінно з’ясуєте, що вони утворюють певний ланцюг взаємопов’язаних процесів. Процесів, в яких етапи поступового накопичення малопомітних кількісних змін, рано чи пізно змінюються етапами радикальних перетворень, в результаті яких, система переходить до якісно нового стану. І потрібно підкреслити, що даний стан речей стосується не лише тих подій які відбуваються в процесі нагрівання речовини.
Вивчаючи фізику, ви не раз переконаєтесь в тому, що закон переходу кількісних змін в якісні, так чи інакше проявляється практично в усіх фізичних процесах. Більше того, цей закон значною мірою пояснює і ті процеси, які відбуваються при еволюційному розвитку живої матерії та соціальних систем. Втім, закономірно еволюційного розвитку соціальних систем, не є предметом вивчення молекулярної фізики і фізики загалом. Стосовно ж закономірностей еволюційного розвитку живої матерії, то про них ми поговоримо в тому розділі фізики який називається космологією – наукою про Всесвіт.
На завершення додамо, що закон переходу кількісних змін в якісні, є одним з базових законів діалектики, тобто тієї філософської науки, в якій вивчають загальні закономірності розвитку природи і суспільства.
Контрольні запитання.
1. Що стверджується в законі який називається законом переходу кількісних змін в якісні?
2. Чим закон переходу кількісних змін в якісні відрізняється від інших законів фізики, наприклад закону збереження енергії або закону всесвітнього тяжіння?
3. Опишіть дію закону переходу кількісних змін в якісні на прикладі тих подій які відбуваються в процесі нагрівання води від –20°С до 400°С.
4. Опишіть дію закону переходу кількісних змін в якісні на прикладі тих подій які відбуваються в процесі нагрівання заліза від 20°С до 1600°С.
5. Опишіть дію закону переходу кількісних змін в якісні на прикладі тих змін які відбувалися в процесі еволюції життя на Землі.
6. Опишіть дію закону переходу кількісних змін в якісні на прикладі змін суспільно-економічних формацій.
§25. Рідкі кристали.
Ще одним вагомим доказом умовності класифікаційного поділу речовин на тверді рідкі та газоподібні є факт існування так званих рідких кристалів. Нагадаємо. Кристалічними називають такі речовини, які мають певний сталий об’єм та певну сталу форму і структурні одиниці яких розташовані в певному періодичному порядку. Одним з результатів цього внутрішнього порядку є факт того, що окремі монокристали є анізотропними, тобто такими фізичні властивості яких в різних напрямках суттєво різні. Рідинами називають такі речовини, які мають певний сталий об’єм, але не мають певної сталої форми і структурні одиниці яких розташовані без певного періодичного порядку. Результатом відсутності такого порядку є те, що рідини ізотропні, тобто такі фізичні властивості яких в різних напрямках однакові.
Термін «рідкі кристали» безумовно вказує на те, що рідкокристалічний стан речовини певним чином поєднує як ознаки рідкого так і ознаки кристалічного станів. І це дійсно так. Як і рідини, рідкі кристали не мають певної сталої форми і характеризуються певною плинністю та в’язкістю. Як і кристалічні тіла, вони характеризуються певним порядком в розташуванні частинок та певною анізотропією фізичних властивостей. Іншими словами, за базовими зовнішніми ознаками, рідкі кристали є безумовно рідкими, а за внутрішньою структурою їх можна вважати умовно кристалічними.
Рідкими кристалами називають такі речовини, які з одного боку мають явні ознаки рідини, зокрема текучість та відсутність сталої форми, а з іншого – певні ознаки кристалічності, зокрема певний періодичний порядок в розташуванні молекул та анізотропію властивостей.
Історія рідких кристалів починається з 1888 року. В цьому році австрійський вчений Фрідріх Рейнітцер (1857–1927) досліджуючи ним синтезовану кристалічну речовину (холестерилбензоат) з’ясував, що при температурі 145°С вона плавиться утворюючи каламутну рідину, яка зберігала свою каламутність до температури 179°С. Дослідження показали, що каламутна рідина є анізотропною, тобто такою, фізичні і зокрема оптичні властивості якої в різних напрямках різні. А це означало, що дана рідина має певні властивості кристалічної речовини. Спочатку вирішили що каламутна рідина є певною суспензією, тобто сумішшю рідини з дрібними кристалічними частинками. Однак дослідження безумовно доводили, що каламутна фаза холестерилбензоату не має твердих включень і представляє собою однорідну однофазну речовину. Цей особливий стан рідини назвали її рідкокристалічною фазою. Втім, в науковій практиці часто вживають термін «мезофаза», що в буквальному перекладі означає «проміжна фаза» (проміжна між кристалічною фазою речовини та фазою її ізотропної рідини).
В подальшому було відкрито та досліджено багато рідкокристалічних речовин. При цьому з’ясувалося, що практично всі вони мають одну характерну особливість: їх молекули мають яскраво виражену паличкоподібну форму (мал.75). І не важко збагнути, що маючи таку просторово анізотропну форму, великі групи щільно розташованих молекул схильні мати певну упорядковану орієнтацію.

Мал.75. Молекули рідкокристалічних речовин мають яскраво виражену анізотропію форми.
За способом отримання рідкокристалічної речовини, рідкі кристали розділяють на дві базові групи: термотропні та ліотропні. Термотропними називають такі рідкі кристали, які утворюються в процесі плавлення відповідної кристалічної речовини і які існують в певному інтервалі температур та тисків. На сьогоднішній день відомо декілька тисяч речовин (зазвичай органічних), які в певних температурних інтервалах знаходяться в рідкокристалічному стані.
Ліотропними називають такі рідкі кристали, які утворюються в процесі розчинення відповідної речовини в певному розчиннику і які існують в певному інтервалі концентрацій цього розчину. До числа ліотропних рідких кристалів відносяться розчини багатьох миючих засобів, багатьох поліпептидів та фосфоролипідів.
Термотропні рідкі кристали по суті є окремою фазою рідкого стану відповідної речовини. Описуючи ті процеси які відбуваються при тепловому переході речовини з кристалічного стану в рідкокристалічний, можна сказати наступне. В процесі плавлення, жорстка кристалічна структура речовини руйнується і ця речовина стає рідкою. Однак, в силу того що молекули рідкокристалічної речовини мають яскраво виражену анізотропію форми, а також в силу інших фізико-хімічних особливостей цих молекул, вони в певному температурному інтервалі, зберігають певний порядок свого розташування. Результатом цього порядку є певна анізотропія властивостей рідини. Коли ж температура рідкокристалічної рідини досягає певної критичної величини, порядок в розташуванні молекул повністю руйнується і анізотропна (рідкокристалічна) рідина, стає звичайною ізотропною рідиною.
Дослідження показують, що перехід речовини від кристалічного стану до рідкокристалічного і від рідкокристалічного до ізотропно рідкого, відбувається при певних постійних температурах і супроводжується стрибкоподібною зміною як потенціальної енергії молекул, так і багатьох фізичних властивостей речовини. А це означає, що рідкокристалічна фаза рідини є окремою, самостійною фазою рідкого стану речовини. Фаза, яка займає проміжне місце між кристалічною фазою речовини та її ізотропно-рідкою фазою.
Якщо ж говорити про ліотропні рідкі кристали, то вони також є певними самостійними фазами відповідних розчинів. При цьому межі рідкокристалічної фази ліотропної речовини визначаються не певним температурним інтервалом, а певною концентрацією розчину.
За характером того порядку в якому розташовані молекули рідкокристалічної речовини, ці речовини поділяються на немотичні, смектичні та холестеричні. Немотичними називають такі рідкі кристали, молекули яких орієнтовані в одному напрямку (є співнаправленими) і розташовані таким чином що не мають певного порядку в розташуванні шарів цих молекул (мал. 76а). Смектичними називають такі рідкі кристали, співнаправлені «стоячі» молекули яких, розташовані певними паралельними шарами (мал.76б). Холестеричними називають такі рідкі кристали, співнаправлені «лежачі» молекули яких розташовані певними паралельними шарами, при цьому так, що в масштабі багатьох шарів утворюють характерну спіральну структуру (мал.76в).
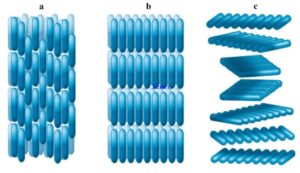
Мал.76. За параметрами того порядку в якому розташовані молекули, рідкокристалічні речовини поділяються на: а) немотичні; б) смектичні; в) холестеричні.
Дослідження показують, що рідкокристалічні речовини не є однорідними і що вони складаються з великої кількості окремих фрагментів, які прийнято називати доменами. В межах певного домену, всі молекули орієнтовані однаково. При цьому орієнтація самих доменів, зазвичай є різною. По суті це означає, що рідкокристалічні речовини є полікристалічними. Але якщо в твердих полікристалічних тілах, монокристали не можуть змінювати своєї просторової орієнтації, то рідкокристалічні домени є достатньо рухливими. Тому під дією певних зовнішніх енергетичних чинників, зокрема електромагнітних полів, орієнтація доменів може змінюватись. Власне цей факт у поєднанні з фактом того, що в різних просторових напрямках рідкокристалічні домени можуть мати різні властивості, зокрема оптичні і лежить в основі широкого практичного застосування рідких кристалів.
Наприклад, в екранах (моніторах) сучасних телевізорів, комп’ютерів, мобільних телефонів, смартфонів, електронних планшетів, калькуляторів, тощо, ті електромагнітні сигнали в яких міститься корисна інформація, певним чином керують просторовою орієнтацією рідкокристалічних доменів і ті «малюють» на екрані відповідне зображення. Не заглиблюючись в деталі устрою та принципу дії рідкокристалічних моніторів про цей устрій та принцип лії можна сказати наступне. Рідкокристалічний монітор представляє собою дві скляні або пластикові пластини, між якими знаходиться певна рідкокристалічна речовина (мал.77). При цьому монітор розділений на велику кількість автономних фрагментів (пікселів) кожен з яких під дією відповідного електричного сигналу, створює свій елемент загального зображення.

Мал.77. Гранично спрощена схема фрагменту рідкокристалічного екрану (1 – рідкий кристал, 2 – скляна пластинка, струмопровідний шар, 4 – прокладка, 5 – керуючий електричний сигнал).
Потрібно зауважити, що сама рідкокристалічна речовина не є тим елементом монітора який світиться. Рідкокристалічна речовина монітора лише певним чином змінює параметри того світла яке через неї проходить. Змінює у відповідності з тими електричними сигналами які керують просторовою орієнтацією рідкокристалічних молекул.
Різноманіття сучасних застосувань рідких кристалів не обмежується електронно оптичними ефектами. В медицині, рідкокристалічні речовини застосовують для комплексної діагностики температури, тиску та деяких захворювань. В промисловості – для неруйнівних методів контролю якості виробів; для виявлення парів шкідливих речовин та радіаційних випромінювань; для контролю температурного режиму роботи приладів. В науці – для візуалізації електромагнітного випромінювання, ультразвукових та інфрачервоних хвиль, тощо.
Контрольні запитання.
1. Що означає твердження: а) окремі монокристали анізотропні? б) рідини – ізотропні?
2. Чим рідкі кристали схожі на кристалічні тіла і чим від них відрізняються.
3. Чим рідкі кристали схожі не звичайні рідини і чим від них відрізняються.
4. В якому агрегатному стані перебувають рідкі кристали?
5. Які рідкі кристали називають термотропними?
6. Які рідкі кристали називають ліотропними?
7. Чи є перехід речовини з рідкокристалічного стану до ізотропно рідкого стану, фазовим переходом? Якщо є, то чому і якого типу?
8. Що означає твердження: рідкокристалічні речовини є полікристалічними?
9. Поясніть загальний устрій та принцип дії рідкокристалічного монітора.
§26*. Полімери та їх властивості.
Все різноманіття твердих об’єктів природи не можливо втиснути в рамки простої класифікаційної схеми: тіла кристалічні – тіла аморфні. Скажімо, деревина, шкіра, кістки, волосся, папір, гума, пінопласт, різноманітні пластмаси, різноманітні тканини та їм подібні матеріали – до якої якого класу об’єктів вони відносяться? Звичайно, за бажання, в деяких з них можна віднайти певні ознаки аморфності або кристалічності. Однак ці ознаки не можуть заперечити факту того, що вище названі та їм подібні матеріали не є а ні аморфними, а ні кристалічними. Ці матеріали називають полімерами (від. грец. polus – багато, meros – частина). Полімерами – називають такі речовини, молекули або інші структурні одиниці яких, складаються з великої кількості повторюваних фрагментів – мономерів.
З’ясовуючи особливості внутрішнього устрою полімерів, розглянемо найпростіший з них – поліетилен. Поліетилен виготовляють з газу, який називається етиленом (С2Н4). Аналізуючи структурну формулу етилену (мал.78а) не важко бачити, що в ній атоми вуглецю (карбону) об’єднані подвійним ковалентним зв’язком. А це означає, що розірвавши один з цих зв’язків, ми отримаємо молекулу яка здатна об’єднуватись з іншими подібними молекулами та утворювати довгі ланцюгові макромолекули. Речовина яка складається з цих ланцюгових макромолекул і є поліетиленом.
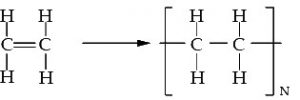
Мал.78. Структурна формула а) етилену; б) поліетилену.
Технологія виготовлення полімерів загалом і поліетилену зокрема, є досить складною. Вона передбачає не лише наявності певних фізичних умов які характеризуються певною температурою та певним тиском, а й широке застосування так званих каталізаторів. Каталізаторами називають такі речовини, які приймають активну участь в проміжних циклах складних хімічних реакцій, впливають на хід та швидкість цих реакцій, але у підсумку залишаються кількісно та якісно незмінними.
Фізичні властивості полімерів залежать від багатьох обставин, зокрема від ступеню їх полімеризації. Ступенем полімеризації називають те загальне число мономерних груп (для поліетилену, це група СН2), що входять до складу усередненої макромолекули даного полімеру. Наприклад, при ступені полімеризації 400, поліетилен – це м’який віскоподібний матеріал, який застосовують як полірувальний віск. При ступені полімеризації 10 000, поліетилен – це помірно міцний, прозорий матеріал, з якого виготовляють різноманітні побутові плівки, посуд для харчових продуктів, тощо. Якщо ж ступінь полімеризації поліетилену становитиме 200 000, то він представлятиме собою надзвичайно міцний, стійкий до зношування матеріал, з якого виготовляють штучні суглоби.
Загалом, характеризуючи полімери, потрібно бути надзвичайно обережним в застосуванні категоричних епітетів як-то міцний, твердий, еластичний, тощо. Адже формально один і той же матеріал, при різних технологіях виготовлення, може мати суттєво різні, іноді діаметрально протилежні властивості.
Різноманіття полімерів таке величезне, що чітко класифікувати це різноманіття, надзвичайно складно. Тому, в різних наукових джерелах можна зустріти суттєво різні класифікаційні схеми. Зазвичай, за ознакою їх походженням, полімери поділяють на: біополімери, штучні полімери та синтетичні полімери.
Біополімерами називають такі природні полімери, які утворюються в процесі природного фото- або біо- синтезу. До числа біополімерів відносяться: клітковина, крохмаль, білки, нуклеїнові кислоти, натуральний каучук, волосся, шкіра, кістки, деревина, тощо. Штучними полімерами називають такі штучно створювані полімери, які отримують шляхом певної хімічної обробки природних біополімерів і перш за все клітковини (целюлози). До числа штучних полімерів відносяться: ацетат-целюлоза, нітро-целюлоза, віскоза, тощо. Синтетичними полімерами називають такі штучно створювані полімери, які створюються шляхом хімічного синтезу, тобто в процесі хімічного об’єднання простих молекул у відповідні складні полімерні молекули. До числа синтетичних полімерів відносяться: різноманітні пластмаси (поліетилен, поліпропілен, полістирол, полівінілхлорид, тощо), різноманітні синтетичні волокна (капрон, нейлон, лавсан, тощо), різноманітні синтетичні каучуки (гуми), різноманітні композиційні матеріали, різноманітні лаки, смоли, клеї, тощо.
За хімічним складом макромолекул, полімери поділяються на органічні та напіворганічні. Органічними полімерами називають такі полімери, ланцюг утворюючим елементом яких є вуглець (карбон С). Скажімо, поліетилен – це органічний полімер. Напіворганічними полімерами (силіконами) називають такі синтетичні полімери, ланцюг утворюючим елементом яких є силіціум (Si), а побічними фрагментами – ті чи інші органічні сполуки. Загальна структура типового лінійного, напіворганічного полімеру представлена на мал.79.
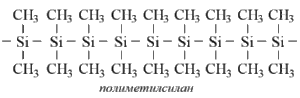
Мал.79. Структурна формула типового силікону.
За геометричною структурою макромолекул, полімери поділяються на лінійні, розгалужені та просторові. Лінійними називають такі полімери, які складаються з довгих, ниткоподібних макромолекул (мал.80а). Наприклад, поліетилен – це лінійний полімер. Розгалуженими називають такі полімери, які складаються з довгих ниткоподібних макромолекул від яких відгалужуються значно коротші лінійні фрагменти (мал80б). Розгалужену структуру має, наприклад полівінілхлорид, тобто той матеріал з якого виготовляють лінолеум, штучну шкіру, тощо. Просторовими називають такі полімери, в яких лінійні макромолекули в деяких місцях «зшиті» міцними ковалентними зв’язками (мал.80в). Прикладом просторового полімеру є гума.
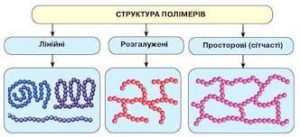
Мал.80. За геометричною структурою макромолекул, полімери поділяються на лінійні (а), розгалужені (б) та просторові (в).
За характером поведінки в процесі нагрівання (охолодження), полімери поділяються на термопластичні та термореактивні. Термопластичними (термопластами) називають такі полімери, які в процесі нагрівання розм’ягчуються, а в процесі охолодження – тверднуть. При цьому, мається на увазі що з термопластами операції нагрівання–охолодження, можна проводити багаторазово. Зазвичай, лінійні та розгалужені полімери є термопластичними. Термореактивними (реактопластами) називають такі полімери, які в процесі нагрівання, до певної температурної межі залишаються твердими, а при досягненні цієї межі – хімічно руйнуються та перетворюються не інші речовини. Термореактивними є більшість просторових полімерів.
Базовою сировиною для більшості просторових реактопластів є різноманітні смоли. Самі по собі, смоли практично не придатні для виготовлення деталей машин. Однак, у поєднанні з певними механічними добавками (ці добавки називають наповнювачами), смоли можуть перетворюватись на так звані композиційні матеріали. Наприклад епоксидна смола, у поєднанні зі скловолокном, перетворюється на матеріал, міцність якого співрозмірна з міцністю кращих сортів сталі. Додайте до цього факт того, що виготовлена з такого матеріалу деталь в 4–5 разів легша за сталевий аналог, і ви зрозумієте чому композиційні матеріали так широко застосовуються в сучасній техніці. Ілюструючи можливості та перспективи такого застосування достатньо сказати, що заміна металевих деталей на полімерні аналоги, дозволила зменшити масу літака «Боінг 757» на 15 тон.
Як правило, просторові реактопласти, це досить міцні, тверді матеріали з низькою пластичністю. Але знову ж таки, ви маєте пам’ятати, що характеризуючи полімери, потрібно уникати категоричних узагальнень. Скажімо, до сімейства тих же просторових реактопластів відноситься і такі м’які та надзвичайно еластичні матеріали як гуми. Своїми дивовижними властивостями, гума має завдячувати її основному компоненту – каучуку. Характерною особливістю молекул каучуку є те, що в них, по-перше між певними атомами вуглецю, існують подвійні ковалентні зв’язки. А по-друге, ці молекули мають зигзагоподібну форму.
У чистому вигляді, каучук представляє собою липку, в’язко-еластичну речовину, яка не має практичного застосування. Але якщо макромолекули каучуку «зшити» в цілісну просторову структуру, то ми отримаємо достатньо міцний, пружно-еластичний матеріал – гуму. Зшивання макромолекул каучуку в цілісну просторову структуру, забезпечує технологічний процес, який прийнято називати вулканізацією. Суть вулканізації полягає в тому, що в процесі нагрівання суміші каучуку з певною кількістю сірки (сульфуру S), деякі подвійні зв’язки макромолекул каучуку руйнуються і між відповідними атомами вуглецю та атомами сірки виникає міцний ковалентний зв’язок. При цьому, атоми сірки, взаємодіючи з двома атомами вуглецю, міцно «зшивають» сусідні макромолекули.
Вулканізований каучук, є ще одним наочним прикладом того, яке різноманіття властивостей можуть мати різновидності одного й того ж полімеру. Адже м’які та еластичні гумові ланцюжки, жорстка гума автомобільних шин і склоподібний, твердий ебоніт, це різновидності одного й того ж матеріалу – вулканізованого каучуку. Різниця лише в тому, що в першому випадку макромолекули каучуку «зшиті» лише в деяких місцях, в другому – щільність таких зшивів є дуже великою, а в третьому – ця щільність є гранично великою.
Потрібно зауважити, що полімерами є не лише ті штучно створені матеріали які прийнято називати пластмасами, гумами, штучними волокнами, композиційними матеріалами і т.д. До числа полімерів відносяться і такі природні матеріали як деревина, шкіра, волосся, кістки, м’язи, тощо. В цих матеріалах, тими мономерами з яких вони складаються, по суті є такі надскладні структури як клітини. І не важко збагнути, що елементарно описати все різноманіття властивостей надскладних природних полімерів практично не можливо.
З іншого боку, до числа природних полімерів можна віднести не лише надскладні біополімери, а й такі гранично прості атомарні кристали як кварц, алмаз, графіт, корунд, силікати, тощо. А це ще раз підтверджує факт того, що будь який класифікаційний поділ об’єктів Природи є досить умовним.
Говорячи про умовність тих класифікаційних схем, які розділяють природні об’єкти на певні групи, доречно сказати і про те, що умовним є не лише поділ речовин на тверді, рідкі та газоподібні, на кристалічні, аморфні та полімерні, а на живі та неживі. І в цьому сенсі, деякі макромолекули складних біополімерів, можна вважати такими, що мають певні ознаки живих структур.
Дійсно. Якщо мова йде про макромолекули природного каучуку, амінокислот, вуглеводнів, жирів та білків, то вони хоч і являються продуктами життєдіяльності живих організмів, але фактично є молекулами неживими. А от молекули дезоксирибонуклеїнових кислот (ДНК) – це об’єкти живі чи не живі? З одного боку, молекула ДНК, це складна полімерна молекула, яка принципово не відрізняється від інших складних біомолекул, наприклад таких як білки. З іншого ж боку, молекула ДНК має основні ознаки примітивного живого організму. Адже за певних сприятливих умов, ця молекула ділиться на дві дзеркально симетричні частини, які «харчуючись» молекулами навколишнього середовища, відновлюють свою початкову структуру і знову діляться. Власне найпростіші сучасні організми – віруси, представляють собою певні обособлені молекули ДНК, які потрапляючи в сприятливе середовище, харчуються продуктами цього середовища і розмножуються.
Контрольні запитання.
1. Поясніть, яким чином із молекул етилену (С2Н4) отримують макромолекули поліетилену.
2. Від чого залежать фізичні властивості поліетилену? Проілюструйте цю залежність.
3. На які класифікаційні групи розділяють полімери: а) за їх походженням; б) за хімічним складом макромолекул; в) за геометричною структурою макромолекул; г) за відношенням до нагрівання.
4. Дайте максимально повну класифікаційну характеристику: а) поліетилену; б) гуми.
5. Які полімери називають композиційними матеріалами?
6. Поясніть суть вулканізації.
7. На прикладі полімерів поясніть умовність поділу речовин на тверді та рідкі; на кристалічні та аморфні; на живі та не живі.