Розділ 2. МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА



Молекулярна фізика – це розділ фізики, в якому вивчаються загальні властивості твердих, рідких та газоподібних речовин та ті теплові процеси які відбуваються з ними.
Речовинами називають такі матеріальні об’єкти, які складаються з тих чи інших частинок (атомів, молекул, іонів, тощо) та мають масу спокою.
Теоретичною основою молекулярної фізики є три твердження, які називаються основними положеннями молекулярно-кінетичної теорії і суть яких полягає в наступному:
1. Всі речовини складаються з молекул (молекул, атомів, іонів).
2. Молекули в речовині безперервно та безладно (хаотично) рухаються.
3. На невеликих відстанях (~10-9м) молекули взаємодіють між собою – в залежності від відстані, притягуються або відштовхуються.
Методологічною основою молекулярної фізики є статистичний метод досліджень, суть якого полягає в тому, що поведінку і властивості надскладної системи молекул, описують на основі законів ньютонівської механіки та статистично усереднених характеристик цих молекул.
Броунівський рух – це безладний рух дрібних, видимих частинок речовини, причиною якого є хаотичний (тепловий) рух молекул навколишнього середовища. Тепловий рух – це безладний (хаотичний) рух молекул речовини.
Дифузія – це явище, суть якого полягає в тому, що в процесі хаотичного руху, молекули однієї речовини перемішуються з молекулами іншої речовини. При цьому, кожна різновидність молекул прагне до того, щоб їх концентрація в усьому доступному об’ємі була однаковою.
Осмос – це явище, суть якого полягає в тому, що в процесі хаотичного руху молекул, одні з них проникають через напівпроникну перешкоду, а інші – не проникають через неї. При цьому, проникаючі через перешкоду молекули, прагнучи до вирівнювання їх концентрації по обидві сторони перешкоди, створюють певний додатковий тиск який називається осмотичним тиском.
Сила міжмолекулярної взаємодії – це результуюча системи багатьох сил, які у своїй сукупності забезпечують міжмолекулярні взаємодії. Суть цих взаємодій полягає в тому, що на невеликих відстанях (r ≅ 1·10-9м) молекули, в залежності від цієї відстані взаємно притягуються або взаємно відштовхуються.
Величини які характеризують кількість речовини та її температуру.
Маса (в молекулярній фізиці) – це фізична величина, яка є загальною мірою кількості речовини в тілі, виміряну в кілограмах.
Позначається: m
Визначальне рівняння: нема
Одиниця вимірювання: [m] = кг.
Маса однієї молекули (атома) визначається за формулою m0=Mr(а.о.м)=
Mr·1,66·10-27(кг), де Мr – масове число.
Масове число (відносна атомна маса) – це безрозмірна величина, яка показує у скільки разів маса усередненого атома даного хімічного елементу (m0) більша за одну атомну одиницю маси. Позначається Мr. Визначається експериментально і записується у відповідну клітинку періодичної системи хімічних елементів.
Атомна одиниця маси (а.о.м.) – це позасистемна одиниця вимірювання маси, яка дорівнює 1/12 маси атома вуглецю-12:
а.о.м.=m0(С612)/12= 1,6605655·10-27кг.
Кількість структурних одиниць – це фізична величина, яка характеризує кількість речовини в тілі, виміряну числом структурних одиниць цієї речовини.
Позначається: N
Визначальне рівняння: N=m/m0
Одиниця вимірювання: [N] =ст.од. (атоми, молекули, іони).
Кількість речовини – це фізична величина, яка характеризує кількість речовини в тілі, виміряну в молях.
Позначається: ν
Визначальне рівняння: ν= m/M
Одиниця вимірювання: [ν] = моль.
Моль – це одиниця вимірювання кількості хімічно простої та хімічно однорідної речовини, яка дорівнює такій порції цієї речовини, в якій міститься стільки її структурних одиниць, скільки атомів міститься в 12г вуглецю-12 (тобто 6,022·1023 структурних одиниць) .
Стала Авогадро (NA=6,022·1023 1/моль) – це постійна величина, яка показує скільки структурних одиниць (молекул) міститься в одному молі відповідної речовини.
Молярна маса – це фізична величина, яка характеризує молярну масу даної хімічно простої речовини і яка дорівнює цій масі, тобто масі тієї порції речовини яка називається молем.
Позначається: M
Визначальне рівняння: M=m0NA
Одиниця вимірювання: [M] =кг/моль .
На практиці, молярну масу речовини визначають за формулою М=Мr(г/моль).
Густина – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки кілограм даної речовини міститься в одиниці її об’єму.
Позначається: ρ
Визначальне рівняння: ρ = m/V
Одиниця вимірювання: [ρ] = кг/м3 .
Концентрація молекул – це фізична величина, яка характеризує кількість речовини в одиниці об’єму і яка показує скільки молекул (структурних одиниць) даної речовини міститься в одиниці її об’єму.
Позначається: n0
Визначальне рівняння: n0 = N/V
Одиниця вимірювання: [n0] = 1/м3.
Температура є однією з тих фізичних величин, які мають декілька загально прийнятих наукових визначення. Зокрема:
Температура – це фізична величина, яка характеризує ступінь нагрітості тіла, виміряну термометром за температурною шкалою Цельсія.
Позначається: t
Визначальне рівняння: нема
Одиниця вимірювання: [t] = °C, градус Цельсія.
Температура – це фізична величина, яка характеризує ступінь нагрітості тіла виміряну еталонним газовим термометром за абсолютною шкалою температур.
Позначається: Т
Визначальне рівняння: нема
Одиниця вимірювання: Т = К, кельвін.
Градус Цельсія °С (кельвін К) – це одиниця вимірювання температури, яка дорівнює одній сотій інтервалу температур між точкою плавлення та точкою кипіння чистої води, визначеними при нормальному атмосферному тиску. Оскільки величини градуса Цельсія та кельвіна є однаковими (°С=К), то між температурою виміряної в кельвінах (Т) і температурою виміряною в градусах Цельсія (t) існує просте співвідношення: Т = t + 273; t = T – 273.
Відмінність між температурою виміряною в градусах Цельсія (t) та температурою виміряною в Кельвінах (Т) полягає в тому, що в першому випадку за початок відліку температури (за t = 0°C) прийнято температуру плавлення води, а в другому випадку, за початок відліку температури (за Т = 0 К) прийнято температуру абсолютного нуля (-273°С).
Абсолютна шкала температур (шкала Кельвіна) – це така температурна шкала, в якій за початок відліку температур прийнято температуру абсолютного нуля, за одиницю вимірювання – кельвін, а за еталонний метод вимірювання – вимірювання за допомогою еталонного газового термометра.
Абсолютний нуль – це температура при якій припиняється тепловий рух молекул речовини і яка відповідає температурі -273?С, точніше -273,15?С.
Температура (в молекулярній фізиці) – це фізична величина, яка характеризує середню кінетичну енергію теплового (хаотичного) руху молекул речовини, виміряну не в джоулях а в кельвінах.
Позначається: Т
Визначальне рівняння: Т = Ек/(3/2)k
Одиниця вимірювання: [Т] = К , кельвін.
Стала Больцмана (k = 1,38·10-23Дж/К) – це постійна величина, яка показує, на скільки джоулів зміниться середня кінетична енергія однієї молекули речовини, при зміні температури цієї речовини на 3/2 кельвіна.
Загальні відомості про тверді, рідкі та газоподібні речовини.
Твердими називають такі речовинні об’єкти, які мають певну сталу форму та певний сталий об’єм, і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію. Іншими словами, для твердих речовин: Ф=const; V=const; Еп > Ек.
Рідинами називають такі речовинні об’єкти, які мають певний сталий об’єм але не мають певної сталої форми, і в яких середня, потенціальна енергія молекул мінімально більша за їх середню кінетичну енергію. Іншими словами, для рідин: Ф≠const; V=const; Еп ≅ Ек.
Газоподібними називають такі речовинні об’єкти, які не мають а ні певної сталої форми, а ні певного сталого об’єму, і в яких, середня потенціальна енергія молекул значно менша за їх середню кінетичну енергію. Іншими словами, для газоподібних речовин: Ф≠const; V≠const; Еп < Ек. Газоподібні речовини можуть знаходитись в двох суттєво різних станах: пар та газ.
Газами називають такі газоподібні речовини, які знаходяться при за критичних температурах (t > tкр). Це означає що: а) середня кінетична енергія молекул газу набагато більша за їх середню потенціальну енергію (Ек >> Еп); б) газ не можливо перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Фізичний стан певної маси газу (m=const) можна охарактеризувати трьома величинами: тиск (р), об’єм (V) та температура (Т), які прийнято називати основними термодинамічними параметрами газу. Процеси при яких так чи інакше змінюються термодинамічні параметри певної маси газу (m=const) називаються термодинамічними процесами. Термодинамічні процеси, при яких маса газу та один з його основних термодинамічних параметрів (р,V,Т) залишаються незмінними, називаються ізопроцесами ( від грецького “ізос” – незмінний). Розрізняють три ізопроцеси:
ізотермічний: m=const, T=const;
ізобаричний: m=const, p=const;
ізохоричний: m=const, V=const.
Ті співвідношення які існують між основними термодинамічними параметрами певної маси газу (m=const), називаються газовими законами. Наукова значимість газових законів полягає в тому, що вони стали експериментальною основою сучасної молекулярно-кінетичної теорії.
Закон Бойля – Маріотта – це закон, в якому стверджується: при ізотермічному процесі, добуток тиску будь якого газу на його об’єм, залишається незмінним. Іншими словами: якщо m=const, T=const то pV=const.
Закон Гей-Люсака – це закон, в якому стверджується: при ізобаричному процесі, відношення об’єму будь якого газу до його абсолютної температури залишається незмінним. Іншими словами: якщо m=const, р=const то V/T = const, або V/(t+273) = const.
Закон Шарля – це закон, в якому стверджується: при ізохоричному процесі, відношення тиску будь якого газу до його абсолютної температури залишається незмінним. Іншими словами: якщо m=const, V=const то р/T = const, або р/(t+273) = const.
Об’єднаний газовий закон – це закон, в якому стверджується: для постійної маси будь якого газу, відношення добутку тиску газу на його об’єм до абсолютної температури газу, залишається незмінним. Іншими словами: якщо m=const, то pV/T=const або pV/(t+273)=const.
Закон Клапейрона – це закон, в якому стверджується: для одного моля будь якого газу виконується співвідношення pVмоль/Т=R, де R – постійна величина, яка називається молярною газовою сталою.
Молярна газова стала (R=8,31Дж/К·моль) – це постійна величина, яка показує на скільки джоулів зміниться середня кінетична енергія одного моля (тобто 6,02·1023 молекул) речовини, при зміні температури цієї речовини на 3/2 кельвіна (тобто на 1,5°С).
Закон Менделєєва – Клапейрона – це закон, в якому стверджується: для довільної кількості молей будь якого газу, виконується співвідношення pV/T=(m/M)R, m – загальна маса газу, M – молярна маса цього газу.
Закон Авогадро – це закон, в якому стверджується: за нормальних умов (р=101,3кПа, Т=273К) один моль будь якого газу займає об’єм 22,4 літра (22,4·10-3м3).
Закон Дальтона – тиск суміші хімічно не взаємодіючих газів, дорівнює сумі тих парціальних тисків, які створюють окремі складові цієї суміші, тобто
р = р1 + р2 +…+ рн.
Ідеальний газ – це спрощена (ідеалізована) модель реального газу, в якій: 1) молекули – ідеально круглі пружні кульки; 2) енергія взаємодії молекул дорівнює нулю (Еп=0); 3) в сторону будь якої стінки куба, в будь який момент часу рухається 1/6 частина наявних молекул.
Представляючи реальний газ у вигляді його спрощеної моделі (ідеального газу) та знаючи фізичну суть того, що називається тиском, температурою, об’ємом, концентрацією молекул, силою, прискоренням, тощо, можна теоретично «відкрити» всі вище сформульовані газові закони.
За певних високих температур (t>1500°C) газ поступово перетворюється на плазму. Плазмою називають частково або повністю іонізований газ, в якому концентрація вільних позитивно та негативно заряджених частинок є усереднено однаковою. Процес переходу газу в стан плазми, називають іонізацією газу. Зворотній процес, тобто перехід речовини з стану плазми до стану газу, називають рекомбінацією плазми.
Парами називають такі газоподібні речовини, які знаходяться при до критичних температурах (t < tкр). Це означає що: а) середня кінетична енергія молекул пару не набагато більша за їх середню потенціальну енергію (Ек > Еп); б) пар можна перетворити на відповідну рідину шляхом його ізотермічного стиснення.
Пароутворення – це такий тепловий процес, який відбувається з поглинанням енергії та супроводжується переходом речовини з рідкого стану в газоподібний.
Конденсація – це такий тепловий процес, який відбувається з виділенням енергії та супроводжується переходом речовини з газоподібного стану в рідкий.
Випаровування – це таке пароутворення, яке відбувається при будь якій температурі рідини і при якому перехід речовини з рідкого стану в газоподібний здійснюється лише з вільної поверхні рідини.
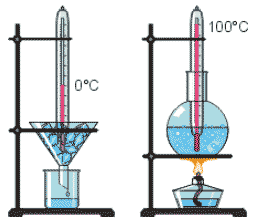
Кипіння – це таке пароутворення, яке відбувається при певній постійній температурі (температурі кипіння) і при якому утворення пару відбувається в усьому об’ємі рідини. Візуальною ознакою кипіння, є утворення наповнених паром відповідної рідини бульбашок.
Температура кипіння – це така постійна для даного зовнішнього тиску і даної речовини температура, при якій, тиск насиченого пару рідини в точності дорівнює тому зовнішньому тиску що діє на поверхню цієї рідини.
Насиченим паром називають такий пар, що знаходиться в стані динамічної рівноваги зі своєю рідиною. Насичений пар має гранично велику для даної температури густину (ρн) і створює відповідний гранично великий тиск (рн).
Ненасиченим паром називають такий пар, густина якого менша за густину відповідного за температурою насиченого пару (ρ < ρн).
Критичний стан речовини – це такий стан динамічної рівноваги між рідиною та її насиченим паром, при якому густина рідини і густина пару є чисельно рівними і при якому будь які відмінності між рідиною та її паром зникають. Критичний стан речовини характеризується певною критичною температурою (tкр) та певним критичним тиском(ркр).
Абсолютна вологість повітря – це фізична величина, яка характеризує фактичну густину того водяного пару що міститься в повітрі і яка дорівнює цій густині.
Позначається: ρа
Визначальне рівняння: ρа = m(H2O)/V
Одиниця вимірювання: [ρа]=кг/м3, або [ρа]=г/м3.
Відносна вологість повітря – це фізична величина яка характеризує відносну вологість повітря і яка дорівнює відношенню фактичної густини того пару що знаходиться в повітрі (абсолютної вологості повітря), до його максимально можливої при даній температурі густини (густини насиченого пару).
Позначається: В
Визначальне рівняння: В = (ρа/ρн)100%
Одиниця вимірювання: [В] = % .
Точка роси (позн. tр) це така температура, при якій повітря в процесі охолодження стає насиченим водяними парами (при t=tр, ρа = ρн , В=100%).
Рідинами називають такі речовинні об’єкти, які мають певний сталий об’єм але не мають певної сталої форми, і в яких середня, потенціальна енергія молекул мінімально більша за їх середню кінетичну енергію. Іншими словами, для рідин: Ф≠const; V=const; Еп ≥ Ек.
Факт того, що енергією взаємодії молекул рідини мінімально більша за їх енергію руху (Еп ≥ Ек), по суті означає: 1) різні рідини мають суттєво різні фізичні властивості; 2)загальної теорії рідин, подібної до теорії газів не існує.
Поверхневий натяг рідини – це явище, суть якого полягає в тому, що поверхневий шар рідини веде себе як пружна плівка яка прагне до максимального скорочення.
Сила поверхневого натягу – це направлена вздовж поверхні рідини сила, яка є результуючою всієї сукупності тих міжмолекулярних взаємодій, що відбуваються в приповерхневому шарі рідини і яка протидіє збільшенню площі цього приповерхневого шару.
Позначається: Fпн
Визначальне рівняння: Fпн=σl
Одиниця вимірювання: [Fпн] = Н.
Коефіцієнт поверхневого натягу рідини – це фізична величина, яка є силовою характеристикою поверхневого шару рідини і яка дорівнює відношенню сили поверхневого натягу, до довжини тієї лінії поверхні на якій ця сила діє.
Позначається: σ
Визначальне рівняння: σ= Fпн/l
Одиниця вимірювання: [σ] = Н/м.
Твердими називають такі речовинні об’єкти, які мають певну сталу форму та певний сталий об’єм, і в яких, середня потенціальна енергія молекул значно більша за їх середню кінетичну енергію. Іншими словами, для твердих речовин: Ф=const; V=const; Еп > Ек. Все різноманіття хімічно простих твердих речовин можна розділити на дві групи : кристалічні та аморфні.
Факт того, що енергією взаємодії молекул твердого тіла не можна знехтувати по суті означає: 1) різні тверді речовини мають різні фізичні властивості; 2) загальної теорії твердих речовин, подібної до теорії газів не існує.
Кристалічними називають такі тверді речовини, структурні одиниці яких розташовані в певному періодичному порядку. Результатом цього внутрішнього порядку є наступні властивості кристалів:
1.Всі хімічно однорідні кристалічні речовини, мають певну температуру плавлення (плавлення, сублімації чи хімічної руйнації).
2. Монокристали мають певну геометричну форму, яка певним чином відображає параметри відповідної кристалічної решітки.
3. Монокристали, анізотропні, тобто такі, фізичні властивості яких в різних напрямках суттєво різні.
Кристалічна решітка (гратка) – це спрощена (ідеалізована) модель внутрішнього устрою кристалічного тіла, в якій його структурні одиниці зображають у вигляді певних умовних символів (точок, кульок, тощо), а їх розташування характеризують відповідними, статистично усередненими значеннями.
Плавлення – це процес переходу речовини з кристалічного стану в рідкий, який відбувається при певній постійній температурі (температурі плавлення) та супроводжується поглинанням енергії.
Кристалізація – це процес переходу речовини з рідкого стану в кристалічний, який відбувається при певній постійній температурі (температурі плавлення) та супроводжується виділенням енергії.
Сублімація (узгін) – це процес безпосереднього переходу речовини з кристалічного стану в газоподібний, який супроводжується поглинанням енергії і інтенсивна стадія якого відбувається при певній постійній температурі (температурі сублімації).
За характером тих сил, що діють між частинками кристалу та за назвами цих частинок, розрізняють чотири види кристалічних структур:
Іонна структура – це така кристалічна структура, в вузлах якої знаходяться позитивні та негативні іони відповідної речовини, між якими діють сили іонного зв’язку. Іонний зв’язок – це такий електромагнітний зв’язок, який існує між позитивними та негативними іонами і основною складовою якого є сили електростатичної взаємодії. Іонну структуру мають ті кристалічні речовини які в хімії називаються солями (NaCl; CuSO4; AgNO3; …) та основами (NaOH; Cu(OH)2; AgOH; …).
Атомна структура – це така кристалічна структура, в вузлах якої розташовані атоми відповідної речовини, між якими діють сили ковалентного зв’язку. Ковалентний зв’язок – це такий електромагнітний зв’язок, який існує між електронейтральними атомами і суть якого полягає в тому, що ці атоми інтенсивно обмінюються валентними електронами. При цьому, кожний атом обмінюється електронами лише з певною строго визначеною групою сусідніх атомів. Атомну структуру мають алмаз, корунд, граніт, пісок, коштовне та не коштовне каміння, тощо.
Металічна структура – це така кристалічна структура, в вузлах якої розташовані атоми металів, між якими діють сили металічного зв’язку. Металічний зв’язок – це такий електромагнітний зв’язок, який існує між атомами металів і суть якого полягає в тому, що ці атоми постійно обмінюються валентними електронами. При цьому, кожен атом почергово обмінюється валентними електронами з всією сукупністю сусідніх атомів. Металічну структуру мають всі метали.
Молекулярна структура – це така кристалічна структура, в вузлах якої знаходяться молекули відповідної речовини, між якими діють сили дипольного або водневого зв’язку. Дипольний зв’язок – це такий електромагнітний зв’язок, з яким молекули-диполі взаємодіють між собою як відповідні електричні системи. Водневий зв’язок – це такий електромагнітний зв’язок, з яким позитивно іонізовані атоми водню взаємодіють з негативно іонізованими атомами сусідніх молекул. Молекулярну структуру має лід, нафталін, органічні сполуки та ті хімічно прості речовини, які за звичайних умов є рідкими або газоподібними.
Аморфними називають такі умовно тверді речовини, структурні одиниці яких, розташовані без певного періодично повторюваного порядку. Результатом відсутності цього внутрішнього порядку є наступні зовнішні ознаки аморфних тіл:
1. Аморфні тіла не мають певної температури плавлення. Вони не плавляться, а розм’ягчуються, не кристалізуються, а тверднуть.
2. Аморфні тіла та будь які їх фрагменти не мають певної характерної форми.
3. Аморфні тіла ізотропні, тобто такі, фізичні властивості яких в усіх напрямках однакові.
Температурний коефіцієнт лінійного розширення – це фізична величина, яка характеризує теплове лінійне розширення твердого тіла (даного матеріалу) в певному інтервалі температур і яка чисельно дорівнює тому лінійному видовженню (Δl) яке отримує тіло довжиною 1м при його нагріванні на 1°С.
Позначається: α
Визначальне рівняння: α = Δl/l0Δt
Одиниця вимірювання: [α] = 1/°С = °С-1.
Пружність – це механічна властивість твердого тіла, яка полягає в тому, що відповідне тіло після припинення дії деформуючої сили повністю відновлює свою попередню форму і розміри.
Пластичність – це механічна властивість твердого тіла, яка полягає в тому, що відповідне тіло після припинення дії деформуючої сили зберігає отриману в процесі деформації форму та розміри.
Міцність – це механічна властивість твердого тіла, яка полягає в тому, що відповідне тіло протидіє деформуючій силі, без руйнації цього тіла та без небезпечних змін його форми і розмірів.
Крихкість – це механічна властивість твердого тіла, яка полягає в тому, що руйнація відповідного тіла відбувається при його незначних деформаціях.
Твердість – це механічна властивість твердого тіла, яка полягає в тому, що відповідне тіло має здатність протидіяти появі на його поверхні подряпин, надрізів, вм’ятин, тощо.
Теплові процеси.
Теплообмін, це такий самовільний незворотній процес, при якому теплова енергія передається від більш нагрітого тіла до менш нагрітого, або від більш нагрітої частини тіла до менш нагрітої і який не супроводжується виконанням механічної роботи.
Теплопровідність, це такий теплообмін, при якому обмін тепловою енергією відбувається в процесі взаємодії мікрочастинок речовини і який не супроводжується переносом самої речовини.
Конвекція, це такий теплообмін, при якому обмін тепловою енергією відбувається в процесі перемішування різнонагрітих частин рідини або газу.
Променевий теплообмін, це такий теплообмін, при якому тіла обмінюються тепловою енергією шляхом випромінювання та поглинання електромагнітних хвиль (фотонів електромагнітного випромінювання).
Внутрішня енергія – це та енергія яка зосереджена всередині даного тіла і яка чисельно дорівнює сумі кінетичних і потенціальних енергій всіх молекул цього тіла.
Позначається: U
Визначальне рівняння: U = ∑Екі + ∑Епі
Одиниця вимірювання: [U] = Дж.
Кількість теплоти – це фізична величина, яка показує на скільки джоулів змінюється внутрішня енергія тіла в результаті того чи іншого теплового процесу.
Позначається: Q
Визначальне рівняння: Q = ΔU
Одиниця вимірювання: [Q] = Дж.
Кількість тієї теплоти що виділяється або поглинається при нагріванні-охолоджені, плавленні-кристалізації, пароутворенні-конденсації та горінні, можна визначити за однією із наступних формул:
· Qн = cmΔT
· Q Qпл = λm
· Qпар = rm
· Qгор = qm
де c, λ, r, q – постійні для кожної речовини величини, значення яких визначається експериментально та записується у відповідну таблицю.
Рівняння теплового балансу – це закон, в якому стверджується: при теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої (енерго ізольованої) системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи. Іншими словами: ∑Qвтр = ∑Qотр .
Нагрівання, це такий тепловий процес, який відбувається з поглинанням енергії, супроводжується підвищенням температури речовини і не супроводжується зміною її агрегатного стану. При нагріванні, надана речовині теплова енергія йде на збільшення кінетичної енергії її молекул, при цьому потенціальна енергія цих молекул залишається практично незмінною: Q → Eк↑; Еп = const.
Охолодження, це такий тепловий процес, який відбувається з виділенням енергії, супроводжується зниженням температури речовини і не супроводжується зміною її агрегатного стану. При охолодженні, виділення енергії відбувається за рахунок зменшення кінетичної енергії молекул речовини, при цьому потенціальна енергія цих молекул залишається практично незмінною: Q ← Eк↓; Еп = const.
Питома теплоємність речовини – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб один кілограм відповідної речовини нагріти на один кельвін (на один градус Цельсія).
Позначається: с
Визначальне рівняння: с = Qн/mΔT
Одиниця вимірювання: [с] = Дж/кг·К.
Питома теплота плавлення – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує скільки енергії потрібно витратити на те, щоб розплавити один кілограм відповідної речовини, за умови що вона вже знаходиться при температурі плавлення.
Позначається: λ
Визначальне рівняння: λ = Qпл/m
Одиниця вимірювання: [λ] = Дж/кг.
Питома теплота пароутворення – це фізична величина, яка характеризує теплові властивості даної речовини і яка показує, скільки енергії потрібно витратити на те, щоб при певній постійній температурі (зазвичай при температурі кипіння) випарувати один кілограм відповідної речовини.
Позначається: r
Визначальне рівняння: r = Qпар/m
Одиниця вимірювання: [r] = Дж/кг.
Питома теплота згорання – це фізична величина, яка характеризує теплові властивості даного виду палива і яка показує скільки енергії виділиться в процесі повного згорання одного кілограма відповідного палива.
Позначається: q
Визначальне рівняння: q = Qгор/m
Одиниця вимірювання: [q] = Дж/кг.
Горіння, це такий тепловий процес, який супроводжується певними хімічними реакціями та інтенсивним виділенням великої кількості теплової і певної кількості світлової енергії. В процесі горіння потенціальна енергія хімічних зв’язків, перетворюється на кінетичну енергію продуктів згорання: Еп → Ек.
Фотосинтез, це складний багатоступеневий фотохімічний процес, суть якого полягає в тому, що в клітинах рослин та деяких бактерій, під дією енергії сонячного світла, із води та вуглекислого газу синтезуються енергоємні молекули простих вуглеводнів, зокрема глюкози. В процесі фотосинтезу, кінетична енергія електромагнітних хвиль (фотонів світла) перетворюється на потенціальну енергію хімічних зв’язків продуктів фотосинтезу: Ек → Еп.
Розділ 3. Термодинаміка.
Термодинаміка – це розділ фізики в якому вивчаються загальні властивості речовин та ті теплові процеси які з ними відбуваються. Теоретичною основою термодинаміки є два твердження які називаються началами термодинаміки. Методологічною основою термодинаміки є термодинамічний метод досліджень.
Термодинамічний метод досліджень, це такий метод наукових досліджень при якому поведінку та властивості складної системи описують на основі тих параметрів які характеризують цю систему в цілому і тих законів, які відображають взаємопов’язаність цих параметрів.
По суті молекулярна фізика і термодинаміка, це дві науки про одне і те ж: загальні властивості речовин та ті теплові процеси, які відбуваються з ними. При цьому ці науки є абсолютно різними. Різними бодай тому, що пояснюють відповідні властивості та явища по-різному. Молекулярна фізика виходить з того, що всі речовини складається з молекул які безперервно рухаються і взаємодіють між собою. Термодинаміка ж виходить з того, що при будь-яких процесах які відбуваються в замкнутій системі, загальна кількість енергії цієї системи залишається незмінною (закон збереження енергії) і що теплова енергія сама по собі не може переходити від холодного тіла до гарячого (друге начало термодинаміки).
В межах програми загальноосвітньої школи, переважна більшість тих явищ, що є предметом вивчення термодинаміки, вивчається в молекулярній фізиці. Головна перевага молекулярної фізики в її наочності, а отже зрозумілості. Адже, в ній кожен об’єкт, кожна фізична величина і кожне явище можна представити у вигляді певного наглядного образу. Якщо ж говорити про термодинаміку, то ця наука є менш наглядною і тому менш зрозумілою. В термодинаміці не важливо на скільки добре ви розумієте суть того, що називається речовиною, теплотою, температурою, тиском, внутрішньою енергією чи ентропією. В термодинаміці важливо знати її базові аксіоми (начала термодинаміки) та вміти застосовувати їх на практиці. Такий підхід дозволяє одержувати точні та достовірні результати, що є безумовним плюсом термодинаміки. В той же час, подібний формалізм позбавляє термодинаміку наочності та зрозумілості, що є безумовним недоліком цієї науки. Зважаючи на ці обставини, в загальноосвітній школі термодинаміку вивчають як певне продовження та доповнення молекулярної фізики.
Перше начало термодинаміки – це закон, в якому стверджується: Надана системі теплота (Q) частково йде на збільшення внутрішньої енергії системи (ΔU), а частково, на виконання нею механічної роботи (Амех), при цьому Q = ΔU + Aмех.
Рівняння теплового балансу – це закон, в якому стверджується: при теплообміні, загальна кількість теплоти втраченої одними тілами замкнутої (енерго ізольованої) системи, дорівнює загальній кількості теплоти отриманої іншими тілами цієї системи. Іншими словами: ∑Qвтр = ∑Qотр .
Не важко довести, що при теплообміні, тобто такому тепловому процесі який відбувається без виконання механічної роботи (Амех = 0), перше начало термодинаміки (Q=ΔU+Aмех) набуває вигляду рівняння теплового балансу (Qвтр = Qотр). Дійсно, для теплообміну (Амех = 0), перше начало термодинаміки (Q=ΔU+Aмех) набуває вигляду Q=ΔU. І не важко збагнути, що в умовах першого начала термодинаміки, тим об’єктом який втрачає теплову енергію є джерело енергії, а тим об’єктом який отримує теплову енергію є робоче тіло. Іншими словами, в умовах першого начала термодинаміки Q = Qвтр, ΔU = Qотр. А це означає, що для теплообміну перше начало термодинаміки по суті набуває вигляду Qвтр = Qотр. Таким чином, те що ми називаєм рівнянням теплового балансу, є прямим наслідком першого начала термодинаміки, сформульованому для теплообміну.
Друге начало термодинаміки – це закон, в якому стверджується: неможливо здійснити такий тепловий процес при якому все надане системі тепло, повністю перетворилось би в механічну роботу. Не можливо тому, що Природа влаштована таким чином, що в ній енергія прядку (механічна робота) легко та повністю перетворюється в енергію безпорядку (теплоту), а от енергія безпорядку, якщо і перетворюється на енергію порядку, то лише за певних умов (примусово) і не повністю, тобто з певними енергетичними втратами.
Тепловий двигун, це прилад, який перетворює внутрішню енергію палива (теплоту) в механічну роботу. За способом перетворення теплоти в механічну роботу, та за характерними конструктивними ознаками, теплові двигуни поділяють на поршневі, турбінні та реактивні. Принцип дії будь якого теплового двигуна полягає в наступному: 1. Нагрівник (джерело енергії) надає робочому тілу певну кількість теплоти (Q1). 2. Робоче тіло, частину цієї теплоти перетворює на механічну роботу (А), а частину (Q2= Q1-А) – передає холодильнику, яким по суті є навколишнє середовище.